三、实验内容
(一)仪器与材料
1.仪器
主要有恒流泵、紫外-可见分光光度计、分析天平、恒温水浴、红外灯、玻璃插管、移液管、锥形瓶(100 mL)、注射器(20 mL)、剪刀、镊子、手术刀片等。
2.材料
主要有法莫替丁、酚红、1 mol/L NaOH、生理盐水、Krebs-Ringer缓冲液、20%乌拉坦溶液等。
动物:实验大鼠,体重(200±20)g,实验前禁食一夜,可自由饮水。
(二)实验部分
1.供试液的配制
(1)法莫替丁供试液(100 μg/mL):精密称取法莫替丁25 mg和酚红5 mg,加Krebs-Ringer缓冲液使溶解(必要时微热),并稀释到250 mL,即得。
(2)酚红溶液(20 μg/mL):精密称取酚红5 mg,加Krebs-Ringer缓冲液使溶解,并稀释到250 mL,即得。
2.大鼠在体肠管回流操作
(1)大鼠麻醉:用20%(g/mL)乌拉坦溶液按1 g/kg给大鼠腹腔注射麻醉,翻正反射消失后,将背部固定于操作台上。
(2)小肠两端插管:腹部除毛后,沿腹部正中线切开腹部(3~4 cm),在小肠段间隔10 cm处各插入细玻璃管1支,并用手术线扎紧插入端,另一端分别接橡皮管(小肠上端向下插,小肠下端向上插)。
(3)洗涤肠管:将37℃生理盐水经小肠上端玻璃管缓慢注入肠管,洗去肠管内容物,充分洗涤后送入空气使洗涤液尽量流尽。
(4)肠管回流:按图19-2进行肠管回流实验。吸取法莫替丁供试液50 mL置贮液瓶中(贮液瓶置于37℃水浴中保温),开动恒流泵进行循环流动,药液从小肠上端流入肠管,经小肠下端流入贮液瓶中,先以5 mL/min的流速回流10 min,然后将流速调节为2.5 mL/min,再循环流动120 min。
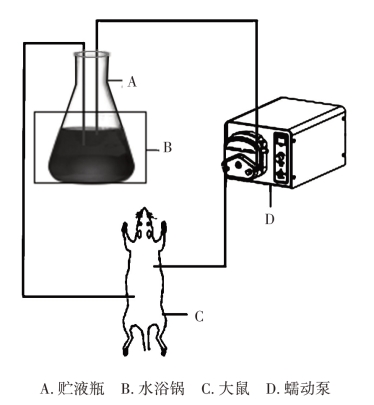 (https://www.daowen.com)
(https://www.daowen.com)
图19-2 大鼠在体肠管回流装置
(5)取样:回流开始后10 min,从贮液瓶取供试液两份,一份1 mL,另一份0.5 mL,分别作为药物和酚红的零时间样品。其后,每隔10 min同样取样两份,每次取样后,立即补充1.5 mL 20 μg/mL酚红溶液。取样至120 min后停止回流。测定供试液中法莫替丁和酚红的浓度。
3.含量测定
(1)法莫替丁的测定:
①法莫替丁标准曲线:精密称取法莫替丁12.5 mg,置于100 mL容量瓶中,用Krebs-Ringer缓冲液溶液并稀释至刻度,摇匀,作为贮备液用。精密量取法莫替丁贮备液0.5 mL、1.0 mL、1.5 mL、2.0 mL、2.5 mL、3.0 mL至25 mL容量瓶中,各加5 mL浓度为20 μg/mL的酚红溶液,用Krebs-Ringer缓冲液稀释至刻度,得法莫替丁浓度为2.5 μg/mL、5.0 μg/mL、7.5 μg/mL、10.0 μg/mL、12.5 μg/mL、15.0 μg/mL的标准溶液。以Krebs-Ringer缓冲液为空白,分别在284 nm及265 nm处测定A1与A2值,计算ΔA=A1-A2(双波长等吸收消去法),以ΔA与法莫替丁浓度C(μg/mL)进行线性回归,得法莫替丁标准曲线。
②供试液中法莫替丁的测定:将供试液1 mL置于25 mL容量瓶中,用Krebs-Ringer缓冲液稀释至刻度,摇匀。以Krebs-Ringer缓冲液为空白,分别在284 nm及265 nm处测定A1与A2值,计算ΔA=A1-A2。根据标准曲线计算法莫替丁的浓度。
(2)酚红的测定:
①酚红标准曲线:取酚红25 mg,用Krebs-Ringer溶液加热溶解至250 mL容量瓶中,并稀释至刻度。取5 mL、10 mL、15 mL、20 mL、25 mL、30 mL加至50 mL容量瓶中,用Krebs-Ringer稀释至刻度。各取0.5 mL酚红溶液加至5 mL 1 mol/L NaOH中,摇匀,于557 nm测吸光度。以1 mol/L NaOH液为空白,以吸收度A与酚红浓度C(μg/mL)进行线性回归,得酚红标准曲线。
②供试液中酚红的测定:将供试液0.5 mL与5 mL 1 mol/L NaOH摇匀,用1 mol/L NaOH作为空白对照液,在557 nm处测定吸收度。按标准曲线计算酚红的浓度。
【注解】
(1)适应证及用法:适用于胃及十二指肠溃疡、反流性食管炎、上消化道出血等症。
(2)Krebs-Ringer磷酸缓冲液的配方:1000 mL蒸馏水中含氯化钠7.8 g、氯化钾0.35 g、氯化钙0.37 g、碳酸氢钠1.37 g、磷酸二氢钠0.22 g、氯化镁0.22 g、葡萄糖1.4 g,用盐酸调节pH至7.4。
(3)20%乌拉坦溶液用于大鼠麻醉时使用剂量为每千克体重腹腔注射1 g。
(4)小肠插管时,将小肠上端剪一小缺口,插入直径为7 mm的玻璃管,小肠下端则插入直径为5 mm玻璃管。插管后,将小肠小心放回腹腔,注意维持完整的小肠血液供应。在鼠腹部切口部位覆盖生理盐水纱布,并用红外灯维持体温在37℃。
(5)洗肠管时,用150~200 mL(37℃生理盐水)沿小肠上端插管缓慢注入肠管,冲洗去肠内脏物,冲洗速度要缓慢,以免把小肠胀破。
(6)由于小肠存在黏膜皱袋、绒毛及微绒毛等结构,因此很难测定吸收性黏膜的真实表面积。本实验中实验小肠段的浆膜面积计算方法为:将回流小肠段冲洗后剖开,平铺于坐标纸上,沿小肠边缘剪下坐标纸,冲洗后晾干,精密称重。剪取10倍面积的坐标纸称重,即为小肠浆膜面积。
