耳蜗毛细胞及其传入、传出通路
上面重点叙述了一般神经生物学的基本知识。作为听觉系统中枢各级神经元及其信息传导特点,基本符合这些规律,但同时存在着许多不同之处。下面着重讨论听觉系统的耳蜗毛细胞及耳蜗内传入、传出神经的结构和功能特点。
(一)耳蜗内、外毛细胞结构、功能比较
表3-2 内、外毛细胞的特点比较
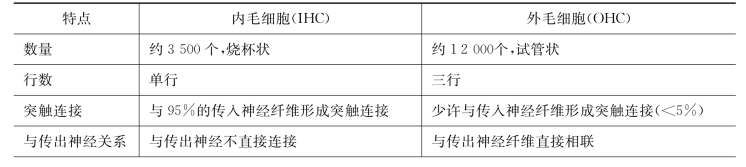
(续 表)
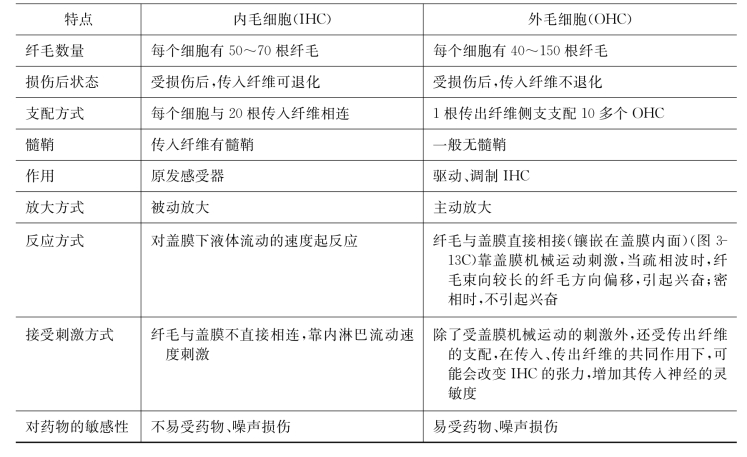
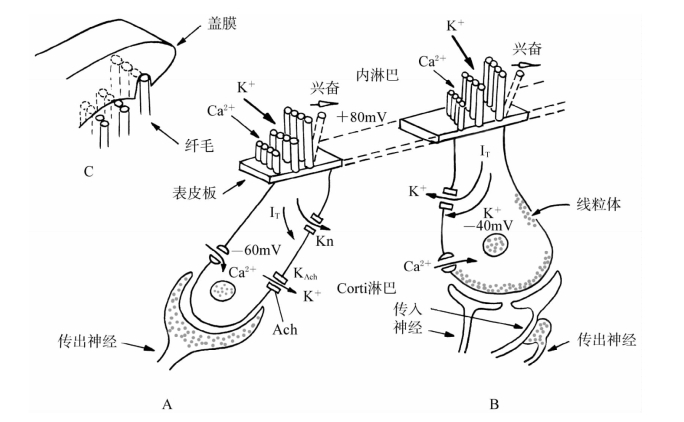
图3-13 内、外毛细胞纤毛的机-电转换通道和胞膜的主要离子通道开启过程
A.示外毛细胞;B.示内毛细胞;C.显示纤毛与盖膜之间的镶嵌关系Ir为由声波引起的纤毛摆动所控制的换能电流
在体的胞内记录技术的发展(Dallos P和Russel IJ),发现了IHC具有较高的敏感性,其表现为OHC在低声强时有超极化直流电位,OHC最大输出<IHC。IHC、OHC具有不同的锁相特征,IHC超前OHC 90°。IHC响应于基膜的运动速度,OHC响应于基膜的位移。
OHC与盖膜、基膜共同构成感受效应系统,即驱动系统,调节IHC的频率选择性和敏感性,而目前尚未发现OHC本身可产生传向中枢的冲动。然而低声强时,IHC反应需要OHC来驱动或者激活。
以上的发现修正了过去双元理论提及的OHC决定反应阈值(响应低声强),IHC响应高强度刺激的说法,而认为IHC较OHC更敏感,但前提是在外毛细胞完好的情况下,一旦外毛细胞受损,内毛细胞的敏感性将下降。
正因为OHC有主动机制及驱动作用,使OHC胞内记录的感受器电位表现出非线性特点;而胞外(中阶记录)的微音电位(CM)、总和电位(SP)也为非线性。但在噪声暴露后,OHC受到损伤,上述非线性特点减弱,表现出IHC的被动线性特点。以上实验结果进一步说明,此非线性特点来自OHC。试验中也观察到CM的两音抑制现象,但噪声暴露后,两音抑制现象减弱。顺铂灌流后,OHC受损,CM、SP和复合动作电位(compound action potential,CAP)非线性特点减弱。
(二)耳蜗OHC的兴奋性特点
OHC的静纤毛是以高低不等分布于表皮板上,各纤毛的顶尖部有“桥”(tip-link)连接,纤毛上有机-电换能通道,是非选择性离子通道,除Ca2+通道外主要以K+通道为主,当纤毛受到盖膜位移机械刺激后,如果向较高(长)一侧的纤毛弯曲时,K+通道开启,通透性增加,K+向胞体内流增多;而向相反方向弯曲时通道开启减少,K+电流也相应减弱,因此这种K+电流可随声波刺激频率的正、负相摆动而受到调变,这一方面形成感受器电位,另一方面导致毛细胞的去极化。当毛细胞去极化后,使得分布于毛细胞底侧壁上L型Ca2+通道开启,胞外Ca2+进入胞内,胞内Ca2+的增加又激活毛细胞侧壁的Ca2+依赖性K+通道开启,形成Ca2+依赖性钾电流(IKCa)使毛细胞超极化(图3-13),当K+进入Corti液(成分同外淋巴液)后参与耳蜗内K+循环(图3-11);此外OHC的底侧壁上电压依赖性外向钾电流,对胞外的K+有高度选择性和依赖性(图3-13)。正如在神经细胞功能一节中所述那样,这种电流可能与形成静息电位有关;浸于淋巴液中的静纤毛还有ATP激活的与ATP受体P2X型相偶联的Ca2+通道形成Ca2+内向性离子流,使毛细胞去极化;另外,在耳蜗传出神经与OHC底部形成的突触后膜还有ACh可激活的ACh离子型受体通道开启,一般是先Ca2+内流,使细胞产生去极化,然后由Ca2+又引起Ca2+依赖性K+通道开启,形成外向型K+电流使OHC极化(图3-13)。
早在19世纪,就有人认识到听觉系统存在传出神经。1946年,发现上橄榄复合体(superior olivory complex,SOC)。SOC与耳蜗螺旋器之间有传出神经联系,称橄榄耳蜗束(olivocochlear bundle,OCB)。内侧橄榄耳蜗束(medial olivocochea,MOC)以较粗的有髄鞘纤维通过交叉与不交叉两种纤维支配双侧耳蜗OHC,人体有95%左右的MOC纤维自第四脑室底中线交叉至对侧,约5%的MOC纤维不交叉,在猫和小鼠,交叉的MOC纤维约占70%~75%,在大鼠、豚鼠和猴则占60%~65%。MOC纤维在OHC底部直接与细胞膜形成突触。业已证明,乙酰胆碱(Ach)是MOC传出神经系统的主要神经递质,以后又发现了γ-氨基丁酸(GABA)。在活体OHC底部用GABA可引起胞体可逆性伸长,Ach则引起OHC可逆的缓慢收缩。说明这两种神经递质在耳蜗放大系统的调控中起相互平衡的作用。有关MOC对OHC如何调控,在第6章中将详细论述。
(三)耳蜗IHC的兴奋性特点
与OHC一样,在IHC表皮板上也有2~4排高低不等的静纤毛,因为内毛细胞是浸泡在内淋巴液中的,当受到内淋巴液波动的机械刺激时,纤毛产生内外摆动,并引起纤毛底部机-电换能通道(非选择性阳离子通道,以K+通道为主,其次是Ca2+通道)开启,以开放程度调节换能电流大小(图3-13)。当阳离子电流增大时,IHC去极化。这种去极化使IHC底侧壁Ca2+通道开启,形成Ca2+内流,细胞内Ca2+浓度的增加一方面导致神经递质的释放,引起所支配的神经纤维产生动作电位,另一方面使细胞侧壁上的Ca2+依赖性K+通道开启,形成外向性K+电流(IKCa)使毛细胞超极化,从而恢复到静息电位水平。除此以外,K+外流还参与耳蜗K+离子循环和动态平衡(见图3-11)。
IHC兴奋后释放出神经递质(谷氨酸)到突触,并与突触后膜上的谷氨酸递质受体相结合,激活与谷氨酸受体相偶联的Na+离子通道开启,Na+内流使传入神经末梢去极化,从而产生动作电位。但也有报道可能激活了与谷氨酸受体相耦联的Ca2+通道开启,Ca2+内流使神经末梢去极化。但后者引起的是幅度低、下降缓慢的动作电位。
早已证明,在中枢神经系统,神经元与胶质细胞间存在谷氨酸-谷氨酰胺循环。目前不少学者也在探讨耳蜗中是否存在着此循环机制,推测当IHC释放出谷氨酸至内毛细胞与Ⅰ型螺旋神经节神经元之间的突触间隙,一部分Glu激活离子型谷氨酸受体,使非选择型阳离子通道开启,引起神经末梢的兴奋,对于过量释放再被突触后膜受体结合后过多的Glu被支持细胞上的谷氨酸转运体(GLAST)转运进入支持细胞,在谷氨酸合成酶的作用下转变为谷氨酰胺,并释放到细胞外,由内毛细胞摄取后在磷酸激活的谷氨酰胺酶作用下重新合成谷氨酸完成循环。在中枢神经系统内谷氨酸受体可分为离子型受体和代谢型受体。前者可分为NMDA受体,NMDA受体又包括NR1和NR2两个亚型和非NMDA受体,而后者又可分为AMPA受体和海人藻酸(KA)受体。实验证明,在耳蜗中存在NMDA和AMPA受体。NMDA受体亚型NR2B主要分布在螺旋神经节底部,特别是在邻近OHC处。此外,在IHC上还存在谷氨酸受体即自身受体;当对离体培养的IHC加入外源性Glu后,用共聚集激光显微镜可观察到,IHC内游离钙增加,由此也证明IHC膜上存在Glu自身受体,并以正反馈机制调节细胞内的Ca2+。当外源性Glu行全耳蜗灌流时,会引起CAP幅值下降,阈值升高。而CM、SP未改变,提示Glu选择性破坏IHC及IHC下突触而不伤及OHC,从而推断IHC上有谷氨酸代谢受体,OHC上则无此受体。当IHC受损后会继续诱发传入神经末梢的退行性病变,证明Glu及其代谢型受体对神经末梢有营养作用。
(四)耳蜗传入突触复合体结构及功能
1.结构 内毛细胞突触复合体(the inner hair cell synaptic complex)包括:
(1)传入突触(afferent):由IHC和传入听神经树突的突触小结(lutton)构成(图3-3左a)。
(2)传出突触(efferent):由外侧橄榄耳蜗束(lateral olivocochlea,LOC)的无髄鞘传出神经末梢大部分与同侧传入听神经树突的突触小结构成(图3-3左e)。
(3)外毛细胞则与传出神经(图3-3右e)、传入神经(图3-3右a)直接形成突触连接。(https://www.daowen.com)
2.主要功能
(1)IHC与所有的螺旋神经节Ⅰ型细胞形成突触并组成放射状传入神经纤维,进入脑干的耳蜗核。在哺乳类动物,耳蜗每个IHC有10~30个活动区,每个活动区只与一条传入神经纤维的突触小结形成突触连接。内毛细胞上的一个活动区提供了一条传入神经纤维上的所有听觉信息。同时起源于同侧上橄榄复合体(ISO)外侧的小神经元通过传出突触对IHC下的传入突触进行反馈调节。
以上这些结构对言语的时间整合及相位编码等可能起重要作用,即在耳蜗信息传入部位就开始对言语进行编码和初级的识别。听神经病患者言语识别率下降程度与其纯音听力下降不成比例,这也许是原因之一。
(2)突触前膜“快速可释放池”(readily releasable pool,RRP)的耗竭现象可能在听觉快速适应过程中起重要作用。实验证明小鼠耳蜗底回IHC的25个活动区中的每一个区域,都可以在突触前膜以最快2 000个囊泡/s的速率快速释放递质。这么高的突触前膜融合速率显然可以满足听神经上最高频率的冲动发放。而且某些毛细胞仅对某一频率范围的声刺激产生反应而表现出电位共振,这种电位共振依赖于L型Ca2+通道与Ca2+激活的K+通道。这些IHC及突触前膜的“RRP”和钙通道的特点为耳蜗的频率分析机制之一——排放理论提供了重要依据,而频率分析又是言语识别的基础。在突触前膜记录到反映RRP耗竭的IHC出胞速率减慢的现象,其时程与快速听觉适应的时程相似,且RRP恢复时程的两个阶段与听神经复合动作电位从适应中恢复的时程也相似。因此,突触前膜的RRP的耗竭现象可能在听觉快速适应中起重要作用。而传入突触的突触抑制作用,即同侧橄榄耳蜗束的传出神经递质多巴胺的作用,可能是快速听觉适应的基础。这实际是一种学习记忆的过程,而这个过程也是言语识别的基础。所以听觉适应对言语的识别至关重要。
(3)IHC拥有功能不同的活动区,它们分别与具有不同自主频率和阈值的听神经纤维形成突触连接,而活动区之间不同的释放特性可解释听神经纤维间自主频率的变化。已观察到功能不同的活动区RRP恢复动力学是有差异的。换句话说,与听皮质相似,耳蜗内毛细胞上也有空间分布特点,即位置编码作用,这也是耳蜗进行言语编码的基础之一。
(五)耳蜗感受器电位与钾离子循环
1.耳蜗毛细胞的微环境及钾离子循环
在前面已述,外淋巴液离子成分与细胞间(外)液相近。在柯替器中,毛细胞纤毛浸泡在内淋巴液中,而胞体和底部则被柯替液和外淋巴液包围(柯替液和外淋巴液离子成分相近)。内淋巴液与外淋巴液成分的重要区别在于内淋巴液像细胞内液一样,高钾(约150mmol/L)而低钠(约1mmol/L),外淋巴液则是低钾(约3mmol/L)、高钠(约140mmol/L)。因此,如果相对于外淋巴毛细胞内的电位大约为-60mV,而内淋巴相对于外淋巴有大约80mV的正电位,故在毛细胞纤毛侧的内(外淋巴)、外(内淋巴)绝对电位差值为140mV(图3-14)。在中阶(内淋巴)记录到的直流电位高达80mV,称为蜗内直流电位(endocochlear potential,EP)。

图3-14 耳蜗内电位及其等效电路
实验证明,形成如此大的电位差是靠K+循环形成的(图3-11)。而内淋巴的高K+并不是来源于血管纹丰富的血液供给,而是来自血管纹中多种细胞的协同活动和耳蜗毛细胞、支持细胞等构成的K+循环。K+循环可能存在三种途径:①K+通过支持细胞间的缝隙连接到达螺旋韧带,然后通过螺旋韧带到达血管纹,最后进入内淋巴;②K+通过外淋巴到螺旋韧带,通过血管纹进入内淋巴;③K+通过支持细胞到达螺旋韧带的纤维细胞和齿间细胞,最后通过齿间细胞的Na+-K+ATP酶泵入内淋巴。以上均提示耳蜗中支持细胞在保持耳蜗K+循环和毛细胞正常功能发挥着重要作用。实验证明,Hensen细胞电压依赖性钾电流参与了耳蜗中K+循环以及EP的形成。
2.耳蜗感受器电位与钾电流 前面已论述在毛细胞纤毛侧的内、外存在140mV的电位差,在纤毛顶的机械-电换能通道开启时K+内流使毛细胞去极化,继而使毛细胞侧壁上的Ca2+依赖性K+通道打开,形成毛细胞外向钾电流,称为换能电流。
早些时候Davis认为,耳蜗内直流电位(EP)和跨越毛细胞顶部的电动势(总共140mV)是感受器电位产生的动力。当耳蜗接受声波刺激后,耳蜗中淋巴液和基膜产生振动,于是镶嵌于盖膜中的OHC的纤毛与盖膜之间产生相对位移,包括相位、方向、大小,使之阻抗值产生相应的变化,其位移的变化(即阻抗大小)调制了上述换能器电流,于是产生了随声波频率变化的感受器电位,即耳蜗微音器电位(CM),而新近离子通道研究证明,上述电阻之变化实际上是纤毛上的机械-电换能通道开放状态的变化。
受声波刺激后,纤毛向最高的纤毛方向弯曲时,这种机械-电换能通道开启使K+进入细胞内增多,毛细胞去极化(产生兴奋)。而向相反方向弯曲时通道开启减少,于是流经毛细胞的K+电流会根据纤毛摆动方向,大小受到调节。这种电流在毛细胞侧膜上产生的电压就是感受器电位(receptor potential)。
那么毛细胞纤毛顶端上的机-电换能通道是如何开启和关闭的呢?有一个“门控弹簧”假设可以比较好的解释此问题。当纤毛向长纤毛方向弯曲时,纤毛之间的连接桥张力可能增加,使本来关闭着离子通道的塞子被拔出,从而打开了离子通道,使离子向细胞内流增加,毛细胞兴奋;当纤毛向短纤毛方向弯曲时,纤毛之间的连接桥张力下降,离子通道关闭,中断了离子向细胞内流,毛细胞不兴奋,这就是所谓负相波使毛细胞兴奋,正相波毛细胞不兴奋的机制所在。
总之,凡是在听觉通路(从周边到中枢)上,任何一个环节受病理因素的影响,如耳蜗K+循环的障碍使EP下降;谷氨酸-谷氨酰胺循环障碍,使突触谷氨酸堆积造成谷氨酸兴奋性毒性;毛细胞Ca2+通道过渡开放,使胞内Ca2+超载,以及压迫神经纤维、传入神经纤维脱髓鞘病等都会引起电生理指标(包括耳蜗电位、听性脑干反应(ABR)、40Hz相关电位(40Hz auditory event related potential,40Hz AERP)、多频稳态反应(multiple auditory steady-state response,MASSR)等缺如或出现异常。
