二、发病部位
尽管该病的发病部位存在诸多争议,目前国外大多数学者认为听神经病病损部位可能是内毛细胞、内毛细胞与树突的突触、螺旋神经节和第Ⅷ脑神经听支。其病变部位可能在耳蜗内毛细胞,传入突触及部分传入神经纤维。李兴启等认为,将听神经病视为耳蜗传入通路疾病可能更为确切,其病因之一可能与谷氨酸的兴奋性毒性有关。
(一)从电生理检测看病变部位
ABR无反应的原因包括:①没有神经活动;②神经传导阻滞;③听神经纤维非同步化放电或同步化放电遭到破坏。从听神经病患者存有可定量测定的听力,即有一定的神经冲动传入来看,第3种情况可能性较大。而导致有髓神经纤维非同步化放电最常见的原因是脱髓鞘病变。ABR波Ⅰ未引出,表明耳蜗内听神经纤维存在病变,可能在内毛细胞,螺旋神经节细胞,或两者之间的突触连接,如突触连接结构的损害可使神经元放电丧失时间的锁定导致神经冲动发放的非同步化,首先表现为耳蜗电位中SP-AP复波的变异,-SP/AP>0.4,波形增宽,甚至AP消失,ABR消失或严重异常,镫骨肌反射及OAE对侧声抑制效应消失。EOAE正常反映耳蜗外毛细胞功能正常,OAE对侧声抑制效应消失,Berlin认为可能的解释有:①Ⅰ型听觉传入纤维非同步放电不足以激动耳声发射对侧抑制;②仅仅依靠Ⅱ型听觉传入纤维维持某些频率区正常的纯音听阈;③初级听觉神经元同步化放电受听觉传出系统调控,即传出系统的功能障碍是疾病的首发因素。由于白噪声并不能使听觉通路神经元同步化放电,说明耳声发射对侧抑制反射弧的激动并不需要听觉传入系统同步化放电。听神经病患者在有足够声刺激传入的情况下对侧抑制现象消失,提示脑干听觉通路或听觉传出系统存在病变,第3种可能性并不能轻易排除。另外还要注意可能出现的继发性耳声发射引不出,所以必要时应同时检测诱发性耳声发射和耳蜗微音电位。与耳声发射对侧抑制相似,镫骨肌反射的激动并不依赖于听觉传入纤维的同步化排放,听神经病患者在有一定听觉传入信号的情况下仍引不出镫骨肌反射,提示听觉脑干通路存在病变。Ⅰ型螺旋神经节细胞与内毛细胞连接的解剖结构特点有利于神经元同步化放电。在听神经病中是否存在由于细胞连接结构的破坏而使神经元放电丧失了时间锁定,进而导致ABR引不出和言语听力下降的可能性?另外,两者突触连接的病变,从理论上分析同样可以产生听神经病的表现。内毛细胞合成及释放递质的非同步化,必然导致神经冲动排放的非同步化。听神经病的表现具有明显的个体差异,这种个体差异的产生是由于病变部位不同还是由于同一病变而程度不同,目前还无法确定。40Hz听觉相关电位多数能引出正常波形,提示脑干以上中枢部位正常,推断听神经病的病理损害以听神经末梢(远端)最为明显。从电生理学角度看耳蜗活动与中枢系统反应分离的特征,提示病变部位可能在听觉初级神经元,内毛细胞或两者之间的突触。否则至少可以引出听神经动作电位和听性脑干反应的Ⅰ波。Starr等和Zeng等推测言语识别能力差与听神经非同步化放电有关。Rance等则认为是到达更高位中枢的听觉信号发生语音畸变所致。
(二)从传入突触复合体结构和功能看病变部位
解剖学研究表明,内毛细胞突触复合体(the inner hair cell synaptic complex)包括传入突触(afferent),由内毛细胞(IHC)和传入听神经树突的突触小结(lutton)构成(图12-5左耳a);传出突触(efferent),由外侧橄榄耳蜗束传出神经末梢与听神经树突的突触小结构成(图12-5左耳e);而外毛细胞则与传出神经(图12-5右耳e)和传入神经(图12-5右耳a)直接形成突触连接。这种突触复合体具有以下特点:

图12-5 内毛细胞突触复合体
左耳a:内毛细胞与传入神经直接形成突触连接;左耳e:传出神经末梢与听神经树突的突触小结构成传出突触;右耳:外毛细胞与传出神经(右耳e)和传入神经(右耳a)直接形成突触连接
1.IHC 与所有的螺旋神经节Ⅰ型细胞形成突触并组成放射状传入神经纤维,进入脑干的耳蜗核。有研究证明,在哺乳类动物耳蜗每个IHC有10~30个活动区,每个活动区只与一条传入神经纤维的突触小结形成突触连接。内毛细胞上的一个活动区提供了一条传入神经纤维上的所有听觉信息。同时起源于同侧上橄榄复核体(ISO)外侧的小神经元通过传出突触对IHC下的传入突触进行反馈调节(图12-6)。
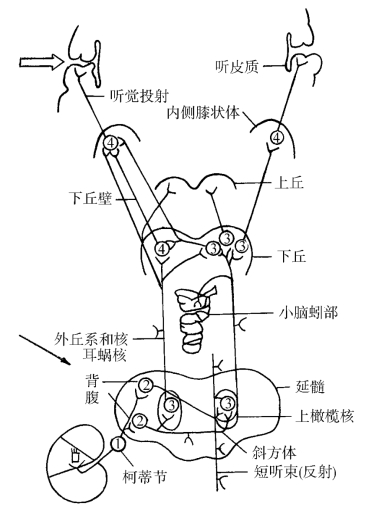
图12-6 听觉神经通路
箭头→所示为神经冲动从耳蜗核一部分传至同侧橄榄核,一部分传至对侧橄榄耳蜗核。箭头所示为皮质听放射箭头所示为皮质听放射
如果把一个内毛细胞视为一个神经元,且与10~30根传入纤维相接,实际上形成了一“放射状”结构。这种“放射状”传入结构及反馈调节初级网络结构与听皮质中枢的听放射及网状结构相似(图12-6)。这些结构对言语的时间整合及相位编码等起重要作用。因此,可以推测在耳蜗信息传入部位就开始对言语进行编码和初级的识别。听神经病患者言语识别率下降程度与其纯音听力下降不成比例,这也许是原因之一。临床上部分听神经病患者行耳蜗置入后言语识别率明显提高,可能的解释为:用有效的电刺激直接刺激了传入神经,取代了原来不正常的IHC下突触复合体间的化学传递,完成了耳蜗的部分言语编码功能。
2.突触前膜(readily releasable pool,RRP)“快速可释放池”的耗竭现象 可能在听觉快速适应过程中起重要作用。(https://www.daowen.com)
(1)实验证明,小鼠耳蜗底回IHC的25个活动区中的每一个均可以以最快2 000囊泡/s的速率快速在突触前膜释放递质。这么高的突触前膜融合速率显然可以满足听神经上最高频率的冲动发放。这些在快速相释放的突触囊泡组成了“RRP”。另有研究表明不仅内毛细胞Ca2+通道是毛细胞频率调谐过程所必需的前提,而且某些毛细胞仅对某一频率范围的声刺激产生反应而表现出电位共振,这种电位共振依赖于L型Ca2+通道与Ca2+激活的K+通道。这些IHC及突触前膜的“RRP”和钙通道的特点,为耳蜗的频率分析机制之一的排放理论提供了重要依据,而频率分析又是言语识别的基础。
(2)Moser等在突触前膜记录到反映RRP耗竭的IHC出胞速率减慢的现象,其时程与快速听觉适应的时程相似,且RRP恢复时程的两个阶段与听神经复合动作电位从适应中恢复的时程也相似。因此,突触前膜的RRP的耗竭现象可能在听觉快速适应中起重要作用。而传入突触的突触抑制作用,类似于同侧橄榄耳蜗束的传出神经递质多巴胺的作用,这可能是快速听觉适应的基础。听觉适应现象是指在持续给声刺激时,听神经的冲动发放速率在开始时最大,然后很快降低。这实际是一种学习记忆的过程,而这个过程又是言语识别的基础。所以听觉适应对言语的识别至关重要。
3.IHC 拥有功能不同的活动区,它们分别与具有不同自主频率和阈值的听神经纤维形成连接,而活动区之间不同的释放特性可解释听神经纤维间自主频率的变化。已观察到功能不同的活动区RRP恢复动力学是有差异的。换句话说,与听皮质相似(图12-7),耳蜗内毛细胞上也有空间分布特点,即位置编码作用,这也是耳蜗进行言语编码的基础之一。
那么为什么其他感音神经性聋言语识别率与纯音听阈成比例变化呢?原因之一,可能此种感音神经性聋主要以外毛细胞损伤为主,对IHC及其突触复合体的结构并未伤及或伤及不多。当OHC损伤后,则只引起IHC及其传入复合动作电位(CAP)灵敏度下降,所以对耳蜗的言语编码功能影响不大。原因之二,听觉传入通路除了在耳蜗是单侧效应外,到橄榄耳蜗核换元后,其神经冲动就是双侧传入(见图12-6→所示)。若一侧的外侧丘系及其以上的听觉传导通路受损,不产生明显的听功能障碍。但当损伤耳蜗传入神经时,其信息传入受到阻断,向上传入的双侧效应丧失,故产生明显的听觉障碍。正如单侧听神经瘤的患者,也可引起言语识别率下降与纯音听力不成比例的变化。如果中枢传入通路一侧的某部位损伤,不一定造成言语识别率大幅度下降,原因在于有双侧效应特性存在。
综上所述,根据IHC下突触复合体的结构和功能,提示耳蜗传入通路(包括IHC、突触、传入神经末梢)除具有频率分析的功能,如同听中枢一样,可能还存在较为复杂的言语时间、空间和强度编码的功能。如果听神经病的患者发病部位确定在耳蜗传入通路,除了纯音听力下降,和由于听力下降引起听皮质的言语识别率下降外,还需加上耳蜗传入通路病变引起的言语编码功能下降。这两者之和就会造成言语识别率大幅度下降。
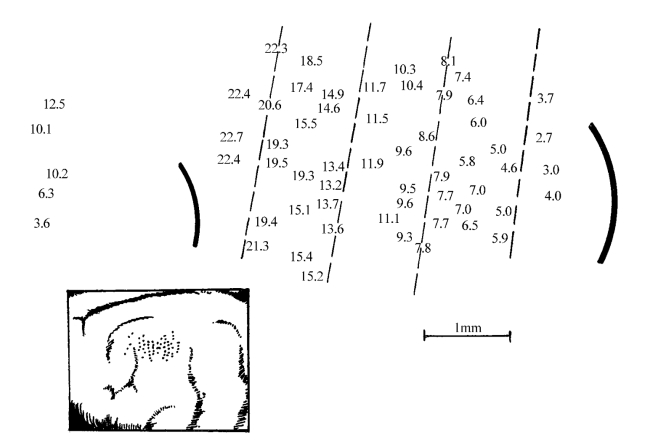
图12-7 听皮质表面的声音频率投射(猫)
数字表示该区细胞反应的最优频率(kHz);左下角照片示记录电极所在位置(引自梁之安)
