一、记录技术
(一)受试者准备
在做电反应测听前,应先向受试者及其家属说明测试目的和意义。让受试者了解“电反应”并不是用电刺激而引出的反应,而是声音引起的人体正常的电活动,打消受试者不必要的顾虑。
对不配合测试的儿童需给以镇静或麻醉,经鼓膜作鼓岬电极记录耳蜗电图时可用氯胺酮等麻醉,全身麻醉最好是由麻醉科医生进行。测试室中应有吸痰、输氧等急救设备。
作外耳道鼓环银球记录时,以乙醇或乙醚使鼓环处充分脱脂。如果用针形鼓岬电极,则更必须严格消毒。
受试者应舒适躺在测试台上,垫枕以放松颈部和肩部肌肉。
(二)测试环境
应在符合要求的隔声、电屏蔽的双间测听室中进行,室内本底噪声应达到纯音测听要求。如用扬声器给声则应符合声场测听要求。对室内进行视听监控,经过观察窗和监听耳机了解受试者的情况和给声情况。
(三)常用刺激声
1.短声(click) 通常用来引导CAP。短声是以100μs宽度的窄方波输入耳机,冲击耳机产生一种宽频带噪声,但一般能量主要集中在3~4kHz。由于短声上升时间快,所以是引起神经冲动同步最佳的信号,可得出最清晰的反应波形。但短声的缺点是不能像纯音那样具有频率特异性。
2.滤波短声(filtered click) 将100μs的方波电脉冲通过1/3倍频程滤波器,输出即为含一系列的准正弦波(6~7个)的滤波短声,其正弦波的频率决定于滤波器的滤波带的中心频率,这种短声的时相(从上升到下降至消失)随频率的不同而不同。高频时的滤波短声具有一定的频率特异性,低频时(0.25、0.5、1kHz)频率特异性较差。
3.短音(tone pip) 短音的声学波形与滤波短声的波形甚为相似,频谱的外形与滤波短声的外形基本相仿。
(四)电极及其放置位置
1.鼓岬电极 用一长约6cm的细于22号皮下注射针头或针灸针,除针夹和尾端外均涂以绝缘材料(如聚四氟乙烯、六氟六烯),国外有市售的ECochG专用针电极,经75%乙醇浸泡或高压消毒后备用。电极经鼓膜后下象限刺入鼓室直抵鼓岬,参考电极置同侧耳垂,额部接地。合作的成人可在局麻下放置电极,儿童则需氯胺酮全麻。从鼓岬记录的CAP反应振幅较外耳道电极记录的大,可在主观听阈10dB以内检出CAP反应阈。怀疑听神经瘤的患者,当外耳道电极记录不出CAP时,则需行鼓岬电极记录。
2.外耳道电极 用一绝缘银丝,末端烧成小珠状(直径约0.5mm),放入NaCl溶液中通过直流进行泛极化处理,涂上导电膏,用膝状镊将电极珠送至外耳道鼓环处,参考电极和接地位置同上。从外耳道记录的CAP反应振幅较鼓岬电极记录的小,但反应规律两者基本一样。有作者报道,从鼓岬记录的CAP阈值平均比从外耳道记录的低17.6dB(图4-17)。
3.外耳道皮下电极 用1%普鲁卡因溶液浸润麻醉外耳道局部皮肤,再用针形电极刺入达骨性外耳道外缘附近,参考电极和接地位置同上,因后者为创伤性法,故不常用。(https://www.daowen.com)
(五)ECochG引导程序
1.CM引导 动物实验研究常用CM作为指标,记录电极一般放在圆窗龛,故电位振幅较大,通常在示波器上直观测试。在人身上记录CM,近年来上海生理研究所梁之安报道了全频CM图、多频CM图和单频CM图的记录方法。前两者需要频谱分析仪或计算机处理,一般实验室条件达不到;用单频纯音作刺激,只要用一个简单的正弦波同步信号发生器,使平均器的扫描与纯音正弦波的周期同步,分析时间为10ms,则10s内即可叠加1000次。耳垂作记录电极时CM振幅虽小,但波形清晰,快速易行(图4-18)。
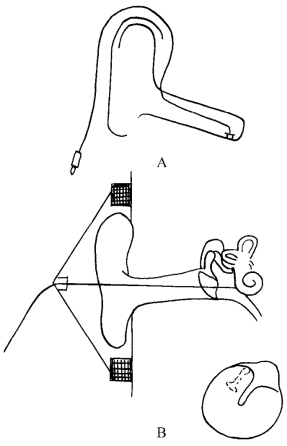
图4-17 电极放置位置
A.银珠外耳道电极放置位置;B.经鼓膜鼓岬电极放置位置
2.SP引导 通常临床应用短声引导CAP。在耳蜗病变时,往往可见-SP,形成AP-SP的复合波。用短纯音引导时,其上升、下降时间和持续时间各家应用有异。用上升下降时间为2ms,持续时间为10ms的短纯音,在豚鼠圆窗记录时可获得AP和正性SP的复合波。观察-SP振幅的变化对判断耳蜗病变是有意义的。给人用外耳道电极,上升下降时间为4ms,持续时间为8ms,则可记录到-SP而不见AP。放大器滤波带宽0(或0.5)Hz至某一高频,例如用1 000Hz的短纯音,高通截止频率为1 000 Hz,以消除伪迹。以此类推,或者不作任何滤波处理也可。声刺激重复率一般用30次/s。扫描时间20ms,灵敏度:50μV或100μV,平均次数:256~512次。
图4-18 耳垂记录电极的CM振幅
A.从豚鼠圆窗龛处记录出的单频CM图;B.从人耳垂处记录出的单频CM
3.CAP引导 刺激声常用短声或滤波短声。后者为进一步了解耳蜗各部功能而用,刺激重复率10次/s,一般不得超过30次/s。放大器滤波带宽:80(或100)Hz~1.5(或3)kHz;扫描时间:10或20ms;灵敏度:50μV或100μV;平均次数256~512次。
常规必须做出阈值反应,在阈值附近时,需重复几次测试,以期获得确切的反应波形。
(六)动物ECochG的记录
做人和动物耳蜗功能检测的最大区别在于前者只能做无创伤的表面电极记录,而在动物实验中可将电极直接置于所需位置,真正做到近电场记录,所记录的CAP或CM幅度均可达到毫伏级。下面以豚鼠为例来说明具体做法:
如果做急性实验,可腹侧进路暴露听泡。在听泡上打一个3mm直径的小孔。在显微镜下透过小孔观察,并确定圆窗龛的位置。将事先做好的银球记录电极(用带特氟隆的银丝10cm,在乙醇灯下将银丝一头烧成圆球,直径约1mm。)卡在圆窗龛上,后续银丝固定在听泡上,参考电极置于已暴露的肌肉上,鼻尖接地。记录系统的平均器和放大器各参数的选定,同记录人的ECochG。引导CAP时,选用的刺激声可为短声、短音、短纯音(短纯音的平台不长于4ms)。引导CM时,可用平台较长(10ms以上)的短纯音,以便取CM中间较平稳一段,量取幅度,做出CM的输入/输出(I/O)函数曲线,可作试前试后的比较,以确定OHC损伤的程度以及对CAP阈值的影响。
如果做慢性实验,可背侧进路暴露乳突:在乳突下1/3处钻一小孔(直径约1mm),在显微镜下观察并确认圆窗龛的位置。将上述的带银丝的银球电极卡在圆窗龛上,用牙科水泥固定后续银丝于上述乳突小孔处。待牙科水泥干后,并确认固定已牢。将银丝从头皮穿至颅顶,并与预先准备好的微型插座上相应插头焊接。在颅顶不同位置处钻两小孔,用微型螺钉(与细的不锈钢丝焊接)拧于小孔处,钢丝另一头焊在微型插座上,分别作为参考电极和接地,微型插座与头颅固定(图4-19)。待1周后,如果无感染,(或测试CAP为正常阈值,)即可作为正式实验的动物。只需将记录系统的前置放大器的记录电极、参考电极及地线插进与微型插座相应的插孔,即可记录出CAP、CM、SP等。记录系统的平均器、放大器各参数的选择参考上述急性实验。选用刺激声及CAP、CM记录、数据处理同上述急性实验。但慢性电极植入可远期全程观察耳蜗生理功能发生发展及恢复过程。可观察更多的规律,提示更深层的认识。无论急性或慢性实验,从器官或细胞水平了解其功能,为功能基因的研究提供了有利条件,将大大促进功能基因组计划(蛋白组计划)研究的进程。
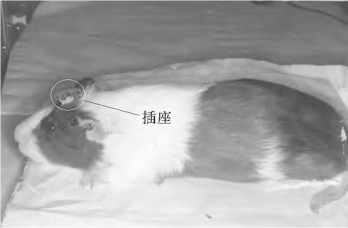
图4-19 慢性试验中,电极插座固定位置
