一、项目开展前
实验室在正式开展HEp—2 IFA检测抗核抗体之前,首先必须做好荧光显微镜的校准,确保荧光激发光功率在说明书规定的范围内,对荧光显微镜的光强响应度、分辨率、定位误差、照明均匀度及光谱响应度等指标进行测试并确保达标。若使用全自动荧光免疫分析仪,应有仪器校准报告,随后须进行操作人员培训,以及候选试剂的性能验证。
(一)操作人员培训
HEp—2 IFA对读片人员要求较高,因此实验室在正式开展该项目前,需要对操作人员进行培训。培训内容至少包括:HEp—2 IFA方法原理、实验操作步骤及注意事项、荧光核型临床意义及判读标准、不同荧光核型相关自身抗体及实验操作质量控制相关规程等。
目前,抗核抗体荧光核型国际共识(international consensus on ANA patterns,ICAP)中文网站(www.ANApatterns.cn)已开通培训模块。其中模块1包括HEp—2 IFA简介、实验内容和目的、工作空间要求、细胞底物、分析流程等培训视频,可作为临床实验室操作人员的培训内容之一。在完成培训内容后,培训者若通过最后的理论考核,可获得由ICAP颁发的培训证书(图2—1—1)。

图2—1—1 ICAP网站培训模块证书
(二)HEp—2 IFA性能验证
HEp—2 IFA属于临床定性免疫检测项目,按照中华人民共和国卫生行业标准WS/T505—2017《定性测定性能评价指南》和CNAS—GL038《临床免疫学定性检验程序性能验证指南》规定,其分析性能参数至少包括:符合率、精密度(重复性)、检出限和参考区间的验证。性能验证报告中需至少包括实验日期、试剂批号、样本来源、操作人员,以及判读结果(阳性结果需包含荧光核型和滴度),并保留所有原始图片等原始数据材料存档。
1.符合率·符合率可根据诊断准确度标准是否明确来验证诊断符合率或方法符合率验证不同方法学和(或)相同方法学在不同实验室之间的比对。以方法符合率为例,举例说明如下。
(1)样本来源:符合率验证可使用室间质评样本或来源于不同实验室(优先选择通过ISO15189等实验室能力认证认可的实验室)的样本。从其他实验室收集样本进行符合率验证时,样本要求诊断明确,选取阴性样本10份,阳性样本≥10份。
1)阴性样本选择:因HEp—2 IFA检测ANA阴性标准为显微镜下无明显荧光或有荧光亮度但核型不清,因此阴性样本选择时需涵盖这两部分,而不应仅选择显微镜下无荧光样本作为阴性比对样本。
2)阳性样本选择:阳性样本选择需同时考虑滴度和荧光核型两方面。滴度需包括低(1∶ 8 0~1∶ 1 60)、中(1∶ 3 20~1∶ 6 40)、高(≥1∶ 1 280)不同滴度或以![]() 稀释系统的不同滴度。荧光核型建议涵盖项目开展后实验室所报告的所有或主要荧光核型,如均质型、致密细颗粒型、核颗粒型、着丝点型、核仁型、核膜型、胞浆纤维型、胞浆颗粒型、胞浆网状/线粒体样型、高尔基体型、胞浆棒环状型和纺锤体型等,以保证候选试剂可检出临床实验室所报告的所有核型。
稀释系统的不同滴度。荧光核型建议涵盖项目开展后实验室所报告的所有或主要荧光核型,如均质型、致密细颗粒型、核颗粒型、着丝点型、核仁型、核膜型、胞浆纤维型、胞浆颗粒型、胞浆网状/线粒体样型、高尔基体型、胞浆棒环状型和纺锤体型等,以保证候选试剂可检出临床实验室所报告的所有核型。
(2)应用举例:将所收集的进行符合率验证的样本进行HEp—2 IFA检测和结果判读。
(3)可接受标准:符合率计算基于阴阳性符合,阳性样本核型一致,滴度上下相差一个滴度为符合。可接受标准可按试剂说明书声称的性能标准或根据实验室检测方法预期用途由实验室自行设置,但通常符合率需≥80%。
2.精密度·精密度指在规定条件下,对样本反复多次测量,测得值之间的一致程度,包括批间精密度和批内精密度。(https://www.daowen.com)
(1)样本来源:精密度验证可使用源于其他同级别实验室(优先选择通过ISO15189等实验室能力认证认可的实验室)的临床样本或抗核抗体HEp—2 IFA商品化定值质控品(表2—1—1),应至少评估2个水平,且应选择实验室常见荧光核型样本。若临床实验室采用倍比稀释系统,建议至少评估阴性和1∶ 1 60两个滴度水平;如使用10稀释系统,建议至少评估阴性和1∶ 3 20两个滴度水平。
(2)应用举例:HEp—2 IFA检测商品化定值(倍比稀释系统建议选择1∶ 1 60滴度,![]() 稀释系统建议选择1∶320滴度)抗核抗体均质型、核颗粒型、核仁型和着丝点型质控品,以及抗核抗体谱阴性质控品。同一批内重复检测20次作为批内精密度。每天4次,连续检测5天作为批间精密度。
稀释系统建议选择1∶320滴度)抗核抗体均质型、核颗粒型、核仁型和着丝点型质控品,以及抗核抗体谱阴性质控品。同一批内重复检测20次作为批内精密度。每天4次,连续检测5天作为批间精密度。
(3)可接受标准:精密度计算基于阴阳性一致,阳性样本核型一致,上下相差一个滴度为一致。可接受标准可按厂商检验方法标准或根据实验室检测方法预期用途由实验室自行设置,但通常符合率需≥80%。
3.检出限·检出限指某一分析方法在给定的置信度条件下可从被测样本中检出待测组分的最小量,通常是验证厂商试剂说明书中声明的最低检测限。
表2—1—1 HEp—2 IFA检测抗核抗体商品化定值质控品*
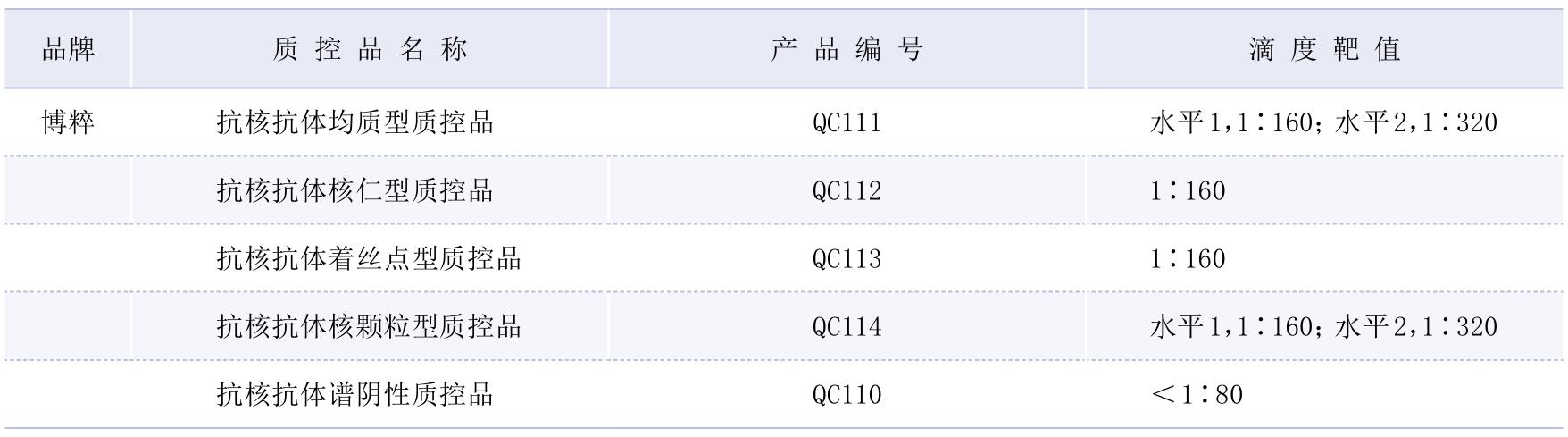
注:*表内为获得国内商品化注册证的定值质控品(2021年1月30日前)
(1)样本来源:用于评估HEp—2 IFA检测抗核抗体的检出限,建议采用低滴度弱阳性定值质控品(如1∶160)。
(2)应用举例:如需验证的厂商声明的检出限为1∶40,可将1∶160的定值质控品用HEp—2 IFA阴性血清或试剂盒内样本稀释液4倍稀释(如10 μl 1∶160的定值质控品加入30 μl样本稀释液),将稀释后的样本在不同批内进行检测(如每天一次,测定4份样本,连续5天),获得20个结果。记录实验日期、试剂批号、样本来源、操作人员,以及阴阳性判读结果(阳性结果需包含荧光核型和滴度),并保留所有原始图片等原始数据材料存档。
(3)可接受标准:依据CNAS—GL038《临床免疫学定性检验程序性能验证指南》,若≥95%的样本检出阳性,则验证通过。
4.参考区间验证·实验室需要对厂商声明的参考区间进行验证。
(1)样本来源:实验室可从本地参考人群中筛选少量健康个体(至少20例)进行检测,筛选时应考虑性别、年龄等因素。
(2)应用举例:将所收集的进行参考值验证的样本进行HEp—2 IFA检测和结果判读。
(3)可接受标准:依据WST 402—2012 《临床实验室检验项目参考区间的制订》,90%参考区间验证样本HEp—2 IFA ANA阴性,则验证通过。但正常人群中HEp—2 IFA阳性率约10%~15%,因此实验室可按实际情况设立可接受标准,但需要说明依据(如某文献报道当地健康人群HEp—2 IFA检测ANA阳性率)。
