细颗粒型(AC—4)
【荧光核型特征】
1.分裂间期细胞·核浆呈现较均匀细颗粒样染色,核仁可染色或阴性(图3—3—3)。
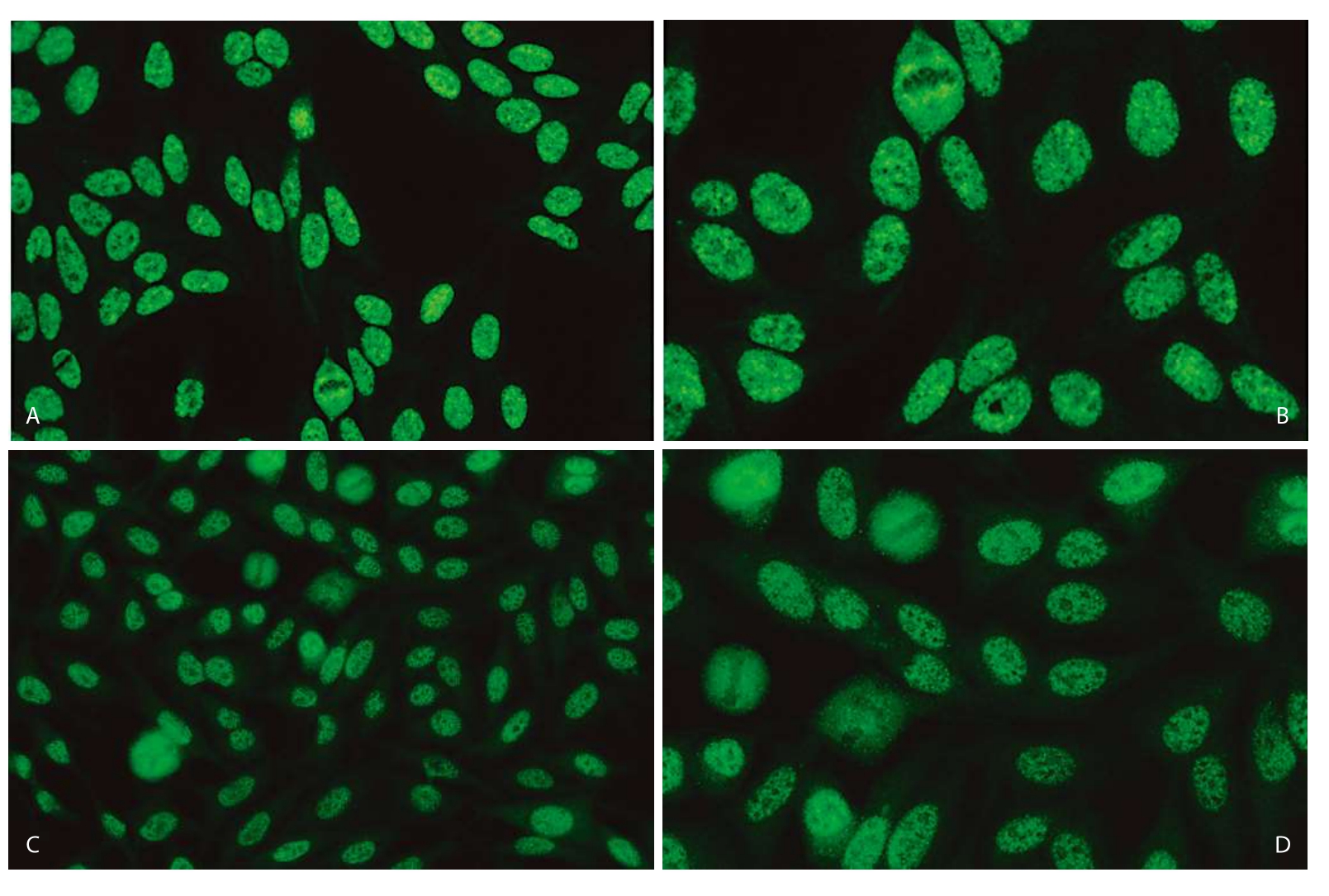
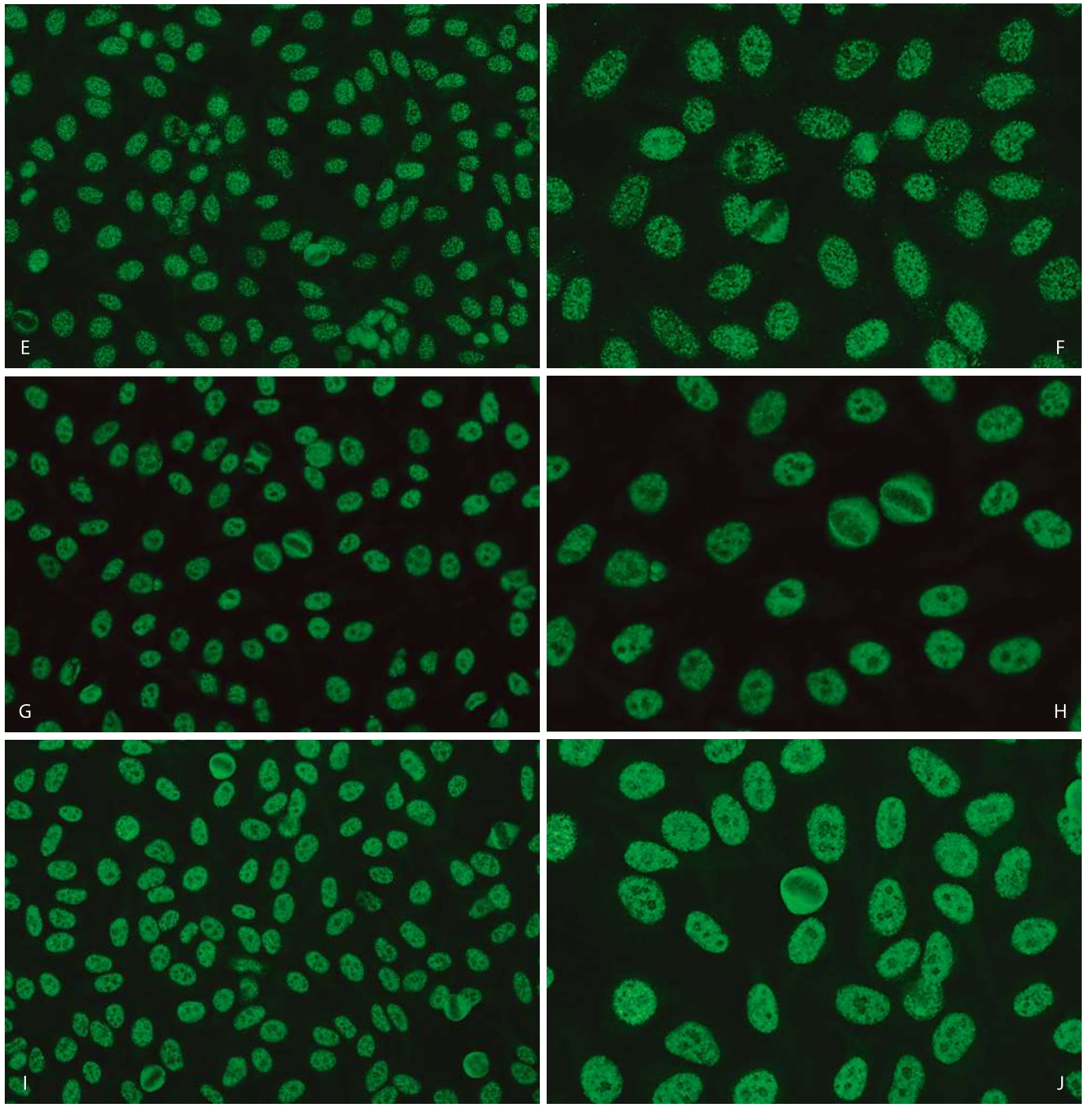
图3—3—3 不同品牌试剂HEp—2 IFA细颗粒型(AC—4)核型特点
A.欧蒙(20倍镜);B.欧蒙(40倍镜);C.INOVA(20倍镜);D.INOVA(40倍镜);E.AESKU(20倍镜);F.AESKU(40倍镜);G.MBL(20倍镜);H.MBL(40倍镜);I.康润科技(20倍镜);J.康润科技(40倍镜)
2.有丝分裂期细胞·浓缩染色体阴性(图3—3—3)。
【核型鉴别】
1.粗颗粒型(AC—5)·间期细胞内颗粒AC—4细小且染色均匀,AC—5颗粒较粗大。某些品牌HEp—2 IFA荧光片AC—4与AC—5较难区别,可报告核颗粒型(AC—4/AC—5)。
2.均质型(AC—1)+细颗粒型(AC—4)混合核型·与AC—4单一核型相同,AC—1和AC—4混合核型间期细胞核呈细颗粒样染色。但后者分裂中期、分裂后期及分裂末期细胞染色体阳性且染色均匀,而AC—4单一核型分裂期细胞染色体阴性。
3.点状核膜型(AC—12)·与AC—4相同,AC—12间期细胞核呈细颗粒样染色,且分裂期细胞染色体阴性。但AC—12间期细胞核膜呈现颗粒状或点状荧光,相邻细胞接触部分荧光染色增强,而AC—4无该荧光特征。
【相关靶抗原】
(一)SSA/Ro60
1.生物学功能·SSA/Ro60是胞质小核糖核蛋白复合体(small cytoplasmic ribonucleoprotein complexes)的一种蛋白质组分,位于细胞核及核仁中。它能结合错误折叠的非编码RNA,可能参与其最终降解,此外在紫外线照射后的细胞存活中也有重要作用。SSA/Ro60由两个结构域组成,一个是由一系列α螺旋重复序列组成的环状结构,另一个结构域类似于血管性血友病因子A(von Willebrand factor A)。SSA/Ro60通常与一些功能未知的非编码RNA(称为Y RNAs)组成Ro60—Y RNAs复合物。在脊椎动物细胞中,因核磷蛋白SSB/La常结合许多新转录的非编码RNA包括Y RNAs,故SSB/La存在于Ro60—Y RNAs复合物中。
此外,抗SSA/Ro60抗体阳性患者常伴有抗Ro52抗体阳性,但目前尚无法证明Ro52可与Ro60—Y RNAs复合物结合。Ro52实为三结构域蛋白(tripartite motif,TRIM)家族的TRIM21,是一种泛素E3连接酶(ubiquitin E3 ligase),而并非Ro蛋白,因此两者同时检出的原因尚需进一步研究。
2.临床意义
(1)干燥综合征(Sjogren’s syndrome,SS):38%~90%的SS患者可检出抗SSA/Ro60抗体,因此该抗体被美国风湿病学会(American College of Rheumatology,ACR)和欧洲抗风湿病防治联盟(European League Against Rheumatism,EULAR)定为SS诊断标准(2016 ACR—EULAR分类标准)之一[4]。SS可分为两种亚型,一种仅累及唾液腺和泪腺,导致眼干和口干;另一种累及其他器官,导致血管炎、间质性肺病(interstitial lung disease,ILD)、周围神经病变、中枢神经系统疾病、间质性肾炎、淋巴瘤等疾病。抗SSA/Ro60抗体阳性SS患者多为后者,易发生上述腺外表现及合并症、高丙种球蛋白血症及其他B细胞活化表现。因此相较于该抗体阴性患者,抗SSA/Ro60抗体阳性SS患者预后较差。
(2)系统性红斑狼疮:抗SSA/Ro60抗体可检出于30%~40%的SLE患者。该抗体阳性的成人及儿童SLE患者,以皮肤和骨骼肌肉受累为主,可见皮疹、光敏感、皮肤血管炎,但肾脏、神经系统受累较少,且较少发生血小板减少症[5]。
(3)新生儿并发症:母体中抗SSA/Ro60抗体和(或)抗SSB/La抗体通过胎盘后,可引起胎儿短暂并发症,如约10%的婴儿出现新生儿红斑狼疮皮疹,20%出现短暂性血细胞减少,30%出现轻度短暂性转氨酶升高,但这些并发症可随着孩子体内母体抗体的减弱而自然消失。抗SSA/Ro60抗体和(或)抗SSB/La抗体阳性,且无新生儿狼疮生育史的孕妇所产胎儿中,约2%可发生完全性心脏传导阻滞(complete heart block,CHB);而有新生儿狼疮生育史的孕妇所产胎儿中,约13%~18%可发生CHB。这可能是母体自身抗SSA/Ro60抗体和抗SSB/La抗体通过胎盘引起胎儿房室结炎症和随后的纤维化所致。
(4)抗SSA/Ro60抗体与抗Ro52抗体:抗Ro60抗体与抗Ro52抗体双阳性,常见于原发性干燥综合征;抗Ro60抗体阳性,抗Ro52抗体阴性,多见于SLE患者;仅抗Ro52抗体阳性,可见于SSc、肌炎、其他炎症性风湿免疫病或非自身免疫病患者。
3.检测方法·HEp—2不是IFA筛查抗SSA/Ro60抗体的理想细胞底物,主要原因为HEp—2细胞内SSA/Ro60抗原丰度较低,以及乙醇、甲醛等细胞固定剂会明显降低其荧光强度,因此部分抗SSA/Ro60抗体阳性血清呈现HEp—2 IFA阴性(AC—0)。HEp—2000细胞是经Ro60 cDNA转染的HEp—2细胞,可明显提高IFA检测抗SSA/Ro60抗体的敏感性(敏感性77%~91%)[6]。转染HEp—2000细胞中有10%~15%的细胞在与抗SSA/Ro60抗体阳性血清孵育后表现出明显的细颗粒及核仁染色。临床实验室常采用ELISA、LIA、CLIA和流式荧光法检测抗SSA/Ro60抗体(表3—3—2)。值得注意的是,部分抗SSA抗体检测试剂盒包被的纯化SSA抗原,实际为SSA/Ro60与Ro52的混合物。因抗SSA/Ro60抗体与抗Ro52抗体临床意义不同,建议临床实验室分开检测该两种抗体。科研实验室除上述方法外,还可采用ALBIA、固相多分析物阵列(solid-phase multianalyte arrays)检测,但WB无法检测抗SSA/Ro60抗体,其原因为在蛋白变性过程中,Ro60的抗原性丧失[7]。
表3—3—2 实验室部分抗SSA/Ro60抗体检测试剂盒
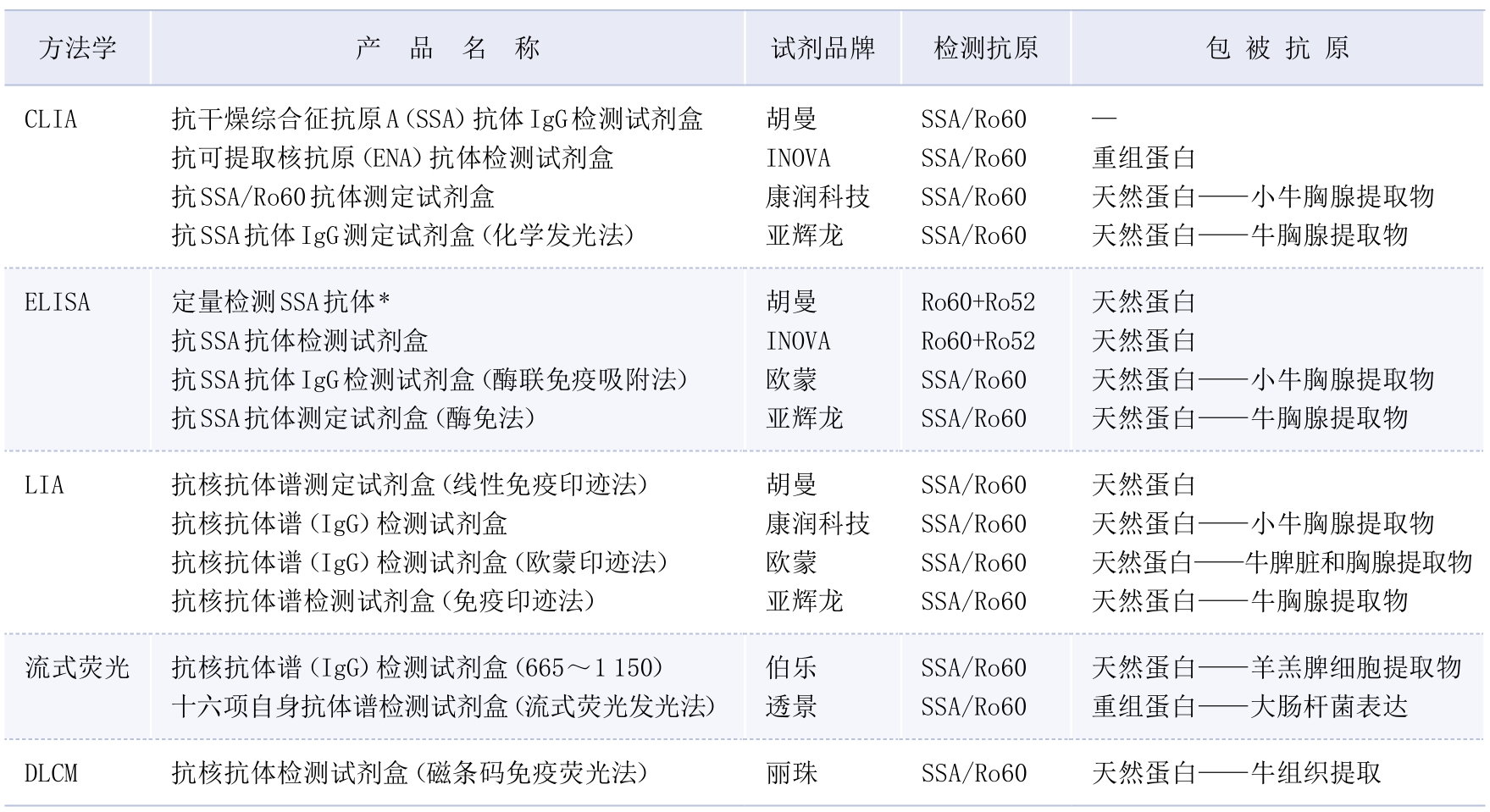
注:*试剂为科研试剂,目前尚无体外诊断试剂注册证产品。—:抗原来源未提供
(二)SSB/La
1.生物学功能·SSB/La蛋白(分子量48 kDa)是一多区域磷酸化蛋白,包括高度保守的N端La型核糖核酸结合域(La-type ribonucleic acid-binding motif,LAM)、中间典型RNA识别域(RNA recognition motif 1,RRM1)、C端非典型RNA识别域2(RNA recognition motif 2,RRM2),以及一条长多肽链[包含短基本结构域(short basic motif,SBM)]。SSB/La蛋白可结合多种RNA分子,包括Ro60—Y RNAs复合物,其中LAM,以及RRM1主要识别并结合RNA聚合酶Ⅲ(RNA polymeraseⅢ,RNAPⅢ)转录RNA产物的特异性多尿苷酸序列(U),RRM2和SBM则与非多尿苷酸序列RNA [non-poly(U)RNA] ,如病毒RNA、末端寡嘧啶信使RNA(messenger RNA,mRNA)相结合。SSB/La蛋白在RNA代谢中发挥不同作用,可作为RNAPⅢ转录的终止因子,并在细胞周期中转录物的成熟过程起关键作用。同时该蛋白也是一种E3连接酶,可调节γ干扰素诱导的细胞因子的产生。
2.临床意义·抗SSB/La抗体可在30%~50%的SS患者中检出,但一般同时伴有抗SSA/Ro60抗体阳性。仅2.3%~7%的SS患者存在抗SSB/La抗体单阳性(抗SSA/Ro60抗体阴性)[8]。在抗SSA/Ro60抗体单阳性或抗SSA/Ro60抗体与抗SSB/La抗体双阳性患者中,表现为SS的典型临床表现,如干眼、口腔干燥等,明显重于抗SSB/La抗体单阳性或者抗SSA/Ro60抗体和抗SSB/La抗体均阴性患者。因此2016年ACR/EULAR将抗SSB/La抗体从SS诊断标准(2016 ACR—EULAR)中去除[4]。
3.检测方法·临床实验室一般采用ELISA和LIA检测抗SSB/La抗体(表3—3—3),两种方法敏感性特异性相似。值得注意的是,ELISA包被人来源抗原检测抗SSB/La抗体敏感性远高于牛来源抗原 [敏感性:93%(人来源)vs.50%(牛来源)] [9]。科研实验室可采用RNA沉淀法(RNA precipitation)、ALBIA、对流免疫电泳(counter immune electrophoresis)进行检测,其中RNA沉淀法是检测抗SSB/La抗体的金标准。由于SSB/La与Ro52电泳迁移率相似且常同时检出,不推荐WB检测抗SSB/La抗体。(https://www.daowen.com)
表3—3—3 实验室部分抗SSB/La抗体检测试剂盒

注:—:抗原来源未提供
(三)Mi—2
1.生物学功能·Mi—2作为核小体重构脱乙酰酶复合物(nucleosome remodeling-deacetylase)的重要组成部分,是一种脱氧核糖核酸依赖性核小体刺激的腺苷三磷酸酶,参与调节基因转录。抗Mi—2抗体是第一个以小牛胸腺提取液为抗原,经免疫双扩散识别的皮肌炎(dermatomyositis,DM)自身特异性抗体,可免疫沉淀两种蛋白质:Mi—2α(530 AA,220 kDa)和Mi—2β(1 912 AA,218 kDa)。Mi—2α与Mi—2β的N端区域(137~645 AA)的序列有83.3%相似性。
2.临床意义·抗Mi—2抗体属于肌炎特异性抗体(myositis-specific antibody,MSA)之一,对DM有较高特异性,其在成人DM中检出率为11%~59%,在儿童DM中检出率为4%~10%[10],而在多发性肌炎(polymyositis,PM),以及散发性包涵体肌炎(sporadic inclusion body myositis)中少见。因缺乏大规模的多中心研究,抗Mi—2抗体目前尚未被纳入特发性炎性肌病(idiopathic inflammatory myopathies,IIM)诊断标准中。抗Mi—2抗体阳性DM患者常有向阳性红斑、披肩样皮疹、角质层过度生长、Gottron丘疹和V字征等典型DM皮肤损伤,但一般对皮质类固醇类激素疗效较好,肺部受累发生率低,且并发其他恶性肿瘤的比率明显低于抗小泛素样修饰激活酶(small ubiquitin-like modifier activating enzyme,SAE)、抗转录中介因子1γ(transcriptional intermediary factor 1γ,TIF1γ),以及抗核基质蛋白2(nuclear matrix protein—2,NXP—2)等MSA。另外,抗Mi—2抗体滴度可能与疾病活动度有关,但尚需进一步临床研究证实。
3.检测方法·抗Mi—2抗体虽然在HEp—2 IFA表现为核细颗粒荧光核型,但该方法学并不适合进行抗Mi—2抗体筛查。免疫沉淀法(immunoprecipitation,IP)为检测抗Mi—2抗体的金标准,仅科研开展,无商品化试剂盒。临床实验室常用的检测方法包括LIA和ELISA(表3—3—4)。研究显示LIA检测结果为抗Mi—2α抗体和抗Mi—2β抗体双阳性的血清,IP一般抗Mi—2抗体阳性(真阳性),LIA仅抗Mi—2β抗体单阳性者常为假阳性,而抗Mi—2α抗体单阳性者约50%为真阳性。[11]另外,LIA抗Mi—2抗体信号强度(灰度值)与ELISA检测结果相关性高,可用于准确估计抗Mi—2抗体滴度[11]。科研实验室可采用IP和基于粒子的多分析物技术(particle-based multi-analyte technology,PMAT)[10]等方法检测。PMAT与LIA对于抗Mi—2抗体检测相关性好,且PMAT抗Mi—2β抗体阳性检测结果与DM临床症状相关性高[10]。
表3—3—4 实验室部分抗Mi—2抗体检测试剂盒
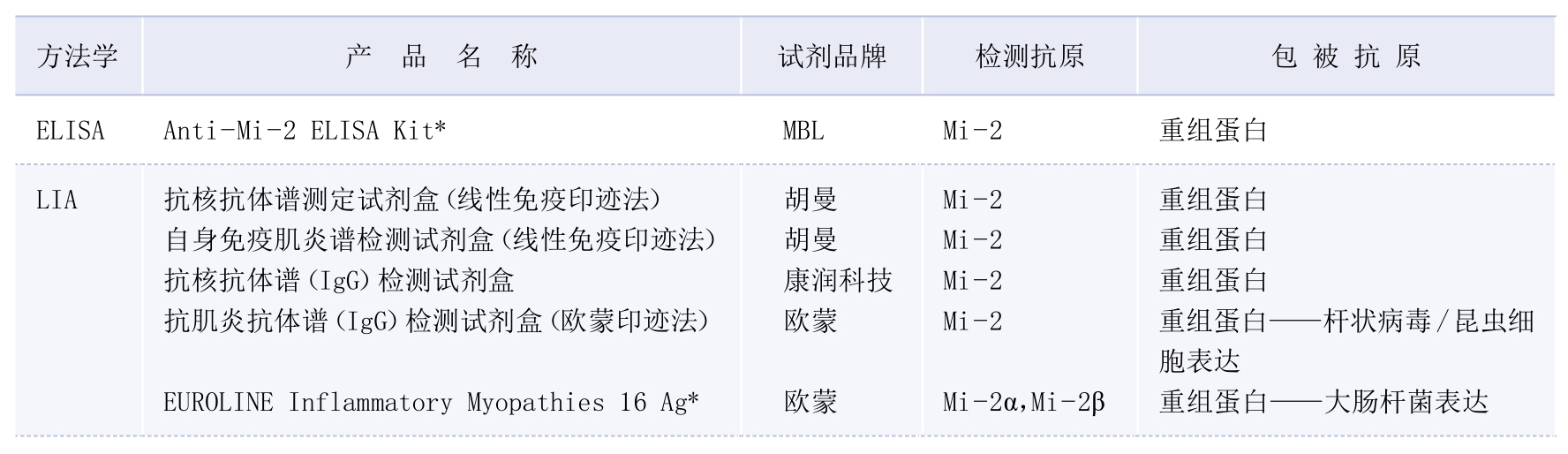
(续表)
注:*试剂为科研试剂,目前尚无体外诊断试剂注册证产品
(四)Ku
1.生物学功能·Ku蛋白是由Ku70(p70,70 kDa)和Ku80(p80,80 kDa)组成的位于细胞核内的异源二聚体,可结合dsDNA,通过非同源末端连接(non-homologous end-joining)途径,在dsDNA修复过程起关键作用。另外,Ku蛋白在V(D)J重组和端粒保护等过程中也起着重要作用,参与DNA复制和基因转录调控。
2.临床意义·抗Ku抗体最初报道见于硬皮病—多发性肌炎重叠综合征(sclerodermapolymyositis overlap syndrome,SSc—PM重叠征)患者,但随后发现其可检出于多种自身免疫病,包括MCTD、SLE、SS、SSc、IIM、SSc—IIM重叠征、RA等。
(1)肌炎相关抗体:在肌炎抗体谱中,抗Ku抗体不是MSA,而属于肌炎相关抗体(myositisassociated autoantibody,MAA)。抗Ku抗体在中国IIM患者中检出率约1.7%,常伴有ILD,以及肌酸激酶升高。皮疹常见于抗Ku抗体合并MSA阳性患者,而抗Ku抗体单阳性IIM患者则更易发生严重的免疫介导坏死性肌病(immune-mediated necrotizing myopathy)和ILD。
(2)系统性红斑狼疮:抗Ku抗体可检出于SLE患者,且不同人种SLE患者中检出率差异较大,如亚洲人4.1%~6%[12]、非洲裔美国人14%、美国白种人0.6%[13]。抗Ku抗体阳性IIM患者常合并SLE。此外,若抗Ku抗体阳性患者合并抗dsDNA抗体阳性,易并发肾小球肾炎。
3.检测方法·IP是检测抗Ku抗体的金标准。临床实验室一般采用LIA检测抗Ku抗体(表3—3—5)。值得注意的是,Ku蛋白是DNA结合蛋白,当固相包被的Ku蛋白中存在DNA污染,而患者血清中有抗dsDNA抗体时,可出现抗Ku抗体假阳性。另外,若患者血清中存在抗dsDNA抗体/DNA复合物,该复合物中的DNA可能会与固相包被的Ku蛋白结合,造成抗Ku抗体假阳性。因此,检测抗Ku抗体时需注意DNA干扰(0.5 mol/L或更高浓度的氯化钠溶液可洗脱DNA与Ku蛋白的结合)。科研实验室可采用IP、ELISA等检测抗Ku抗体,或通过WB区分抗Ku70抗体及抗Ku80抗体两种抗体。
表3—3—5 实验室部分抗Ku抗体检测试剂盒
(五)TIF1γ
1.生物学功能·TIF1γ属于TRIM超家族,又被称为TRIM33,分子量约155 kDa。其N末端有一个RBCC(ring-B-boxcoiled-coil)单元,包括一个环结构域(ring domain)、B盒(B boxes)和一个螺旋线圈结构域(coiled-coil domain),所有这些都与Smad4泛素化有关,而Smad4则在TGFβ信号传导通路中起重要作用;C末端的PHD(plant homeodomain)和bromo结构域可与H3、H4相互作用;中间连接体能与活化的Smad2和Smad3相互作用。TIF1γ在转录延伸、DNA修复、细胞分化、胚胎发育、有丝分裂和皮肌炎中均有作用。另外,TIF1γ在不同的细胞中既可以作为肿瘤抑制因子也可作为启动子发挥作用:在非小细胞肺癌、乳腺癌、胶质瘤和肾透明细胞癌中,TIF1γ作为肿瘤抑制因子,其表达降低;而在B淋巴细胞白血病、胰腺癌和宫颈癌中,TIF1γ起到了肿瘤启动因子的作用,可阻止肿瘤细胞凋亡。
2.临床意义·抗TIF1γ抗体为肌炎特异性抗体之一,可见于7%~31%成人DM,以及23% ~35%幼年型皮肌炎(juvenile dermatomyositis,JDM)患者[14]。在成人DM患者中,抗TIF1γ抗体是肿瘤相关皮肌炎(cancer-associated dermatomyositis)的血清标志物,其增加DM患者并发恶性肿瘤的风险一般仅见于DM发病三年内。这种情况多见于39岁以上患者,并发的肿瘤以乳腺癌、卵巢癌和肠癌多见[15]。抗TIF1γ抗体阳性DM患者一般较少发生ILD、雷诺现象及关节炎/关节痛等症状,但常发生更广泛的皮肤受累,其特征性皮肤表现包括:手掌角化过度、丘疹、银屑病样病变、色素减退和“白上红”毛细血管扩张斑块;此外,尽管患者吞咽困难风险更高,但肌炎症状较轻。
3.检测方法·临床实验室常采用LIA检测抗TIF1γ抗体(表3—3—6),科研实验室可采用放射免疫沉淀法(radio immunoprecipitation)[15]和ELISA进行检测。研究表明LIA(κ=0.88)和ELISA(κ=0.91)检测抗TIF1γ抗体与IP的结果有较高一致性,LIA与ELSIA两者间结果一致性也较高(κ=0.91)[16]。
表3—3—6 实验室部分抗TIF1γ抗体检测试剂盒
注:*试剂为科研试剂,目前尚无体外诊断试剂注册证产品
