胞浆极性/高尔基体样型(AC—22)
【荧光核型特征】
1.分裂间期细胞·分布于细胞质两极的沿细胞核周围不连续斑点或颗粒样带状荧光染色(图3—11—2)。
2.有丝分裂期细胞·分裂期细胞染色体区阴性(图3—11—2)。
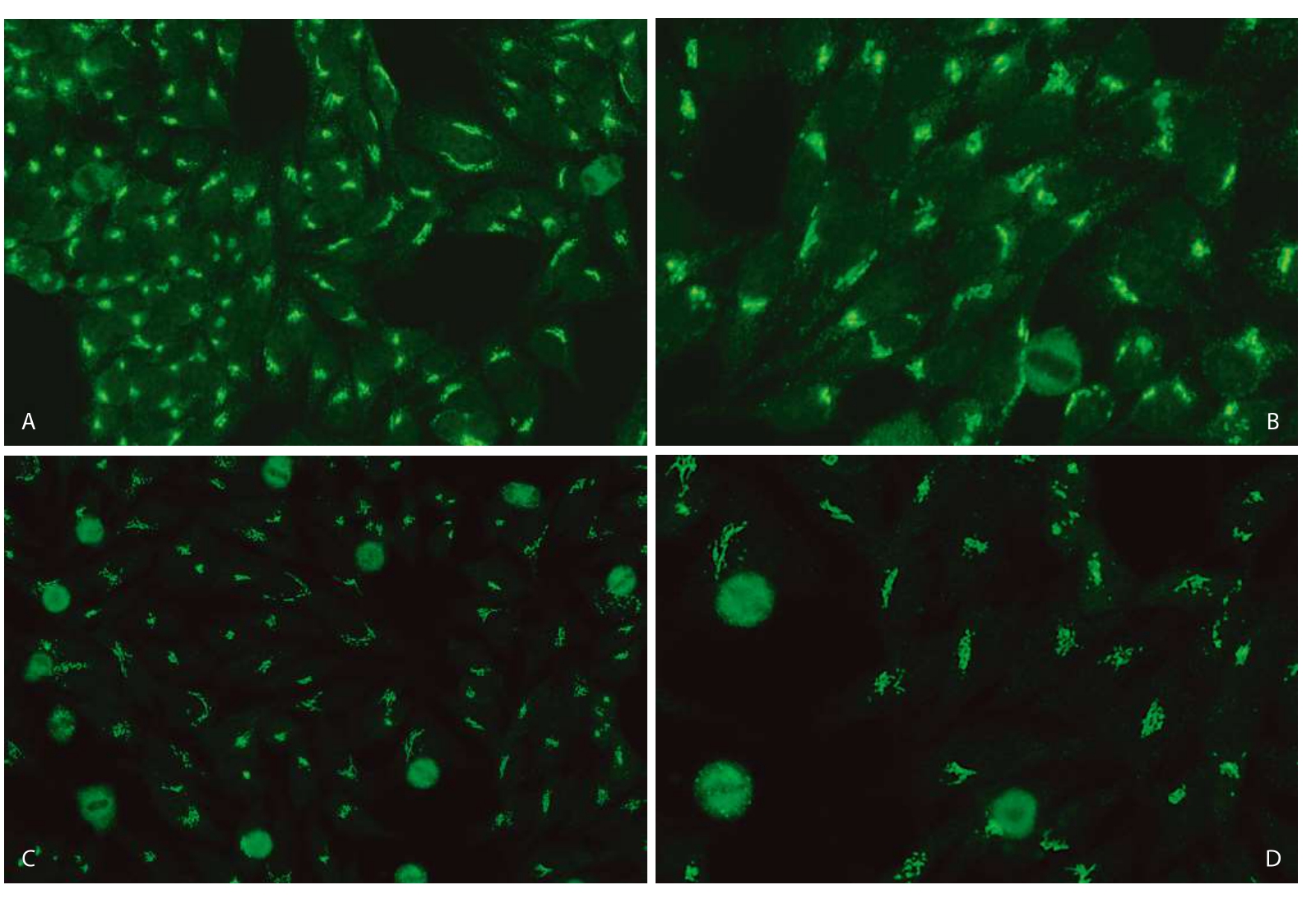
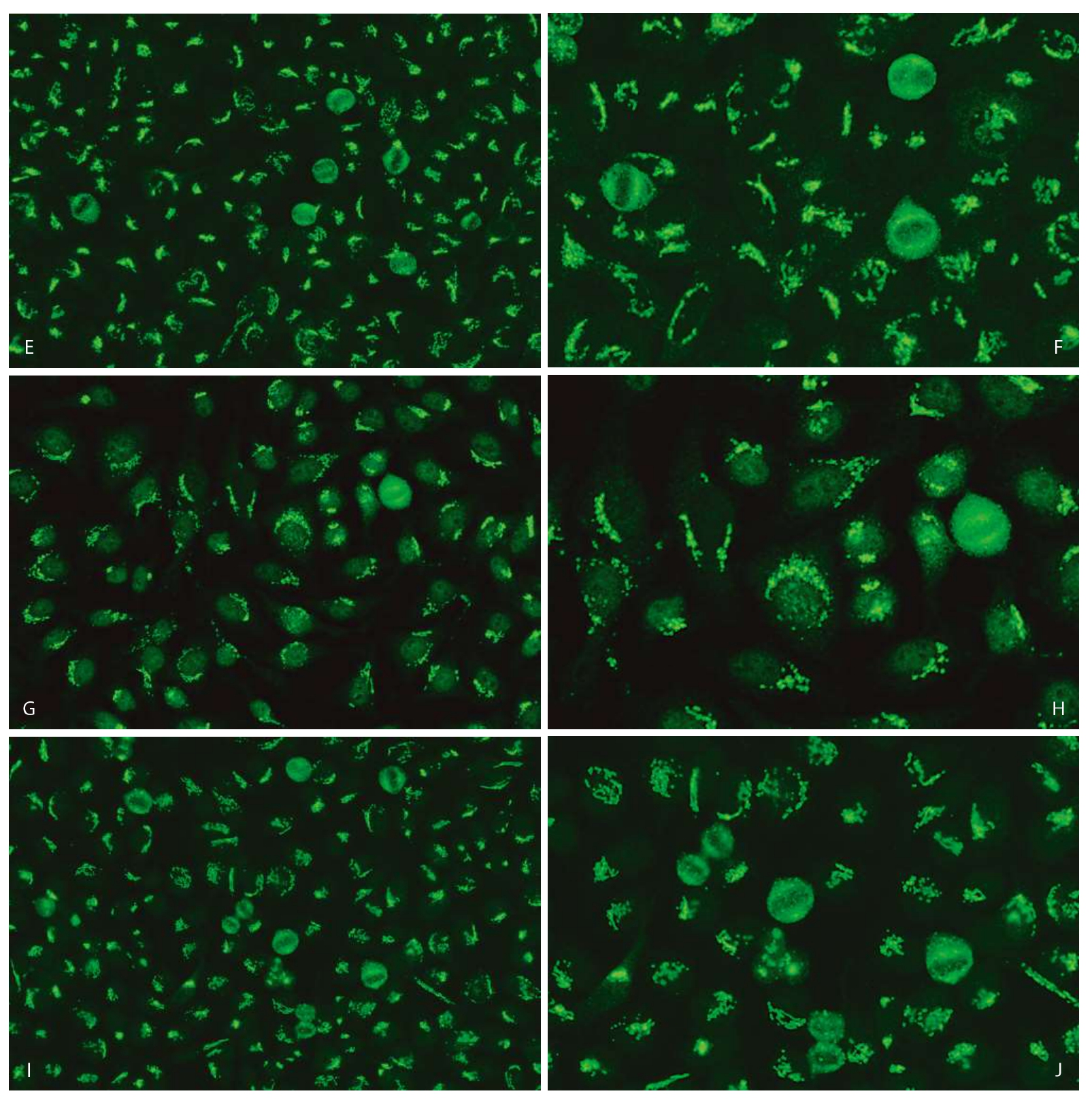
图3—11—2 不同品牌试剂HEp—2 IFA胞浆极性/高尔基体样型(AC—22)核型特点
A.欧蒙(20倍镜);B.欧蒙(40倍镜);C.INOVA(20倍镜);D.INOVA(40倍镜);E.AESKU(20倍镜);F.AESKU(40倍镜);G.MBL(20倍镜);H.MBL(40倍镜);I.康润科技(20倍镜);J.康润科技(40倍镜)
【核型鉴别】
胞浆细颗粒型(AC—20)·见本章第十节胞浆细颗粒型核型鉴别4。
【相关靶抗原】(https://www.daowen.com)
高尔基复合体
1.生物学功能·高尔基体(golgi apparatus),又称为高尔基复合体(golgi complex),是定位于真核细胞核周区域的细胞器,以在空间和功能上由不同的顺式(cis-)、内式(medical-),以及反式(trans-)高尔基体网络组成的膜状堆叠为特征。高尔基体在粗面内质网的加工、运输和筛选新合成的蛋白质方面具有突出功能。抗高尔基复合体抗体(anti-golgi appratus antibody,AGAA)最早在1982年被发现于一个患有淋巴瘤的SS患者血清中。目前已知AGAA识别的自身抗原包括:巨高尔基蛋白(giantin/macrogolgin/GCP372,分子量370 kDa)、golgin—245/p230(分子量245 kDa)、golgin—160/GCP170(分子量160 kDa)、golgin—95/GM130(分子量95/130 kDa)、golgin—97(分子量97 kDa)和golgin—67(分子量67 kDa)[13]。这些大分子蛋白具有共同的结构特征,即除了氨基端和羧基端外,都包含贯穿整个蛋白质的长卷曲螺旋棒状结构域。此外,巨高尔基蛋白在羧基端还存在一个单一的跨膜结构域,是其主要的抗原表位。在所有已知高尔基体相关靶抗原中,AGAA识别最常见的靶抗原是巨高尔基蛋白(50%),而golgin—97最不常见(3.8%)。
2.临床意义
(1)检出率低:AGAA少见于风湿病群体,仅在少数患者中被报道,检出率仅0.05%~0.2%[14],有报道显示在中国人群中,AGAA(HEp—2 IFA)阳性率约0.08%[15]。
(2)无疾病特异性:AGAA不具有疾病特异性,可见于SS、SLE、RA、MCTD、韦格氏肉芽肿病(Wegener’s granulomatosis),以及人类免疫缺陷病毒(human immunodeficiency virus,HIV)感染等,对SARD的诊断价值较低[16]。
(3)系统性自身免疫病:高滴度AGAA的存在可能是SARD的早期迹象。自身免疫病患者AGAA滴度较非自身免疫病患者AGAA滴度更高;且部分AGAA阳性患者随访记录表明,自身免疫病患者可维持较高水平AGAA滴度,而非自身免疫病患者AGAA滴度仅能维持较短时间或消失[15]。
3.检测方法·临床实验室目前尚无针对特异性AGAA的商品化检测试剂。科研可采用IP、ELISA等检测特异性AGAA[17]。
