Topo Ⅰ型(AC—29)
【荧光核型特征】
依据国际抗核抗体荧光核型共识,AC—29有以下5个核型特征(图3—3—5)。
1.分裂间期细胞
(1)细胞核呈细颗粒荧光染色(AC—4样)。
(2)核仁呈外圈明显增亮或颗粒样染色。
(3)细胞胞浆可呈现较弱的网状结构染色。
2.有丝分裂期细胞
(1)染色体呈较均匀的细颗粒样荧光染色。
(2)染色体中的NOR区染色强阳性(染色体上增强的点状荧光)。
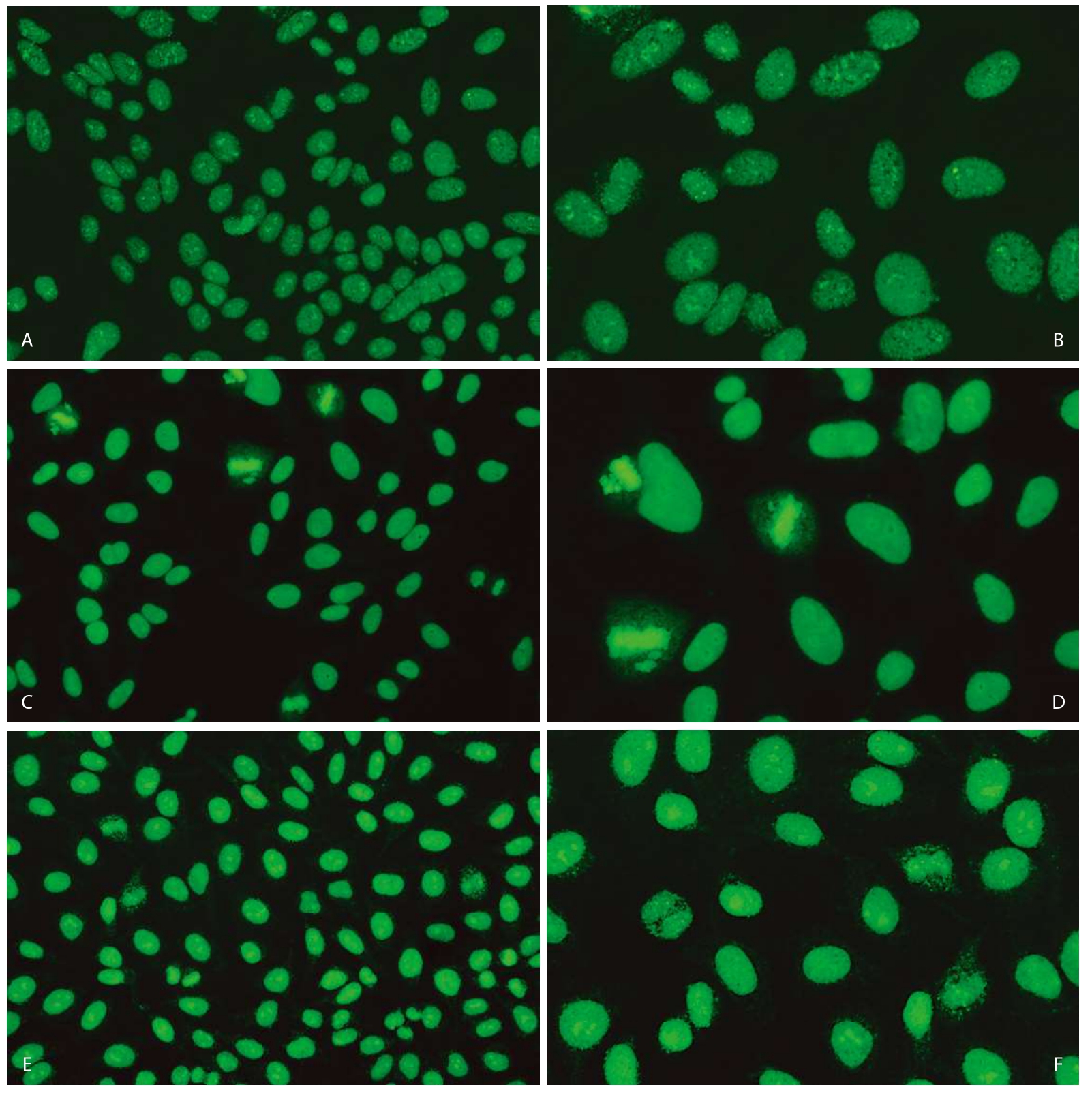
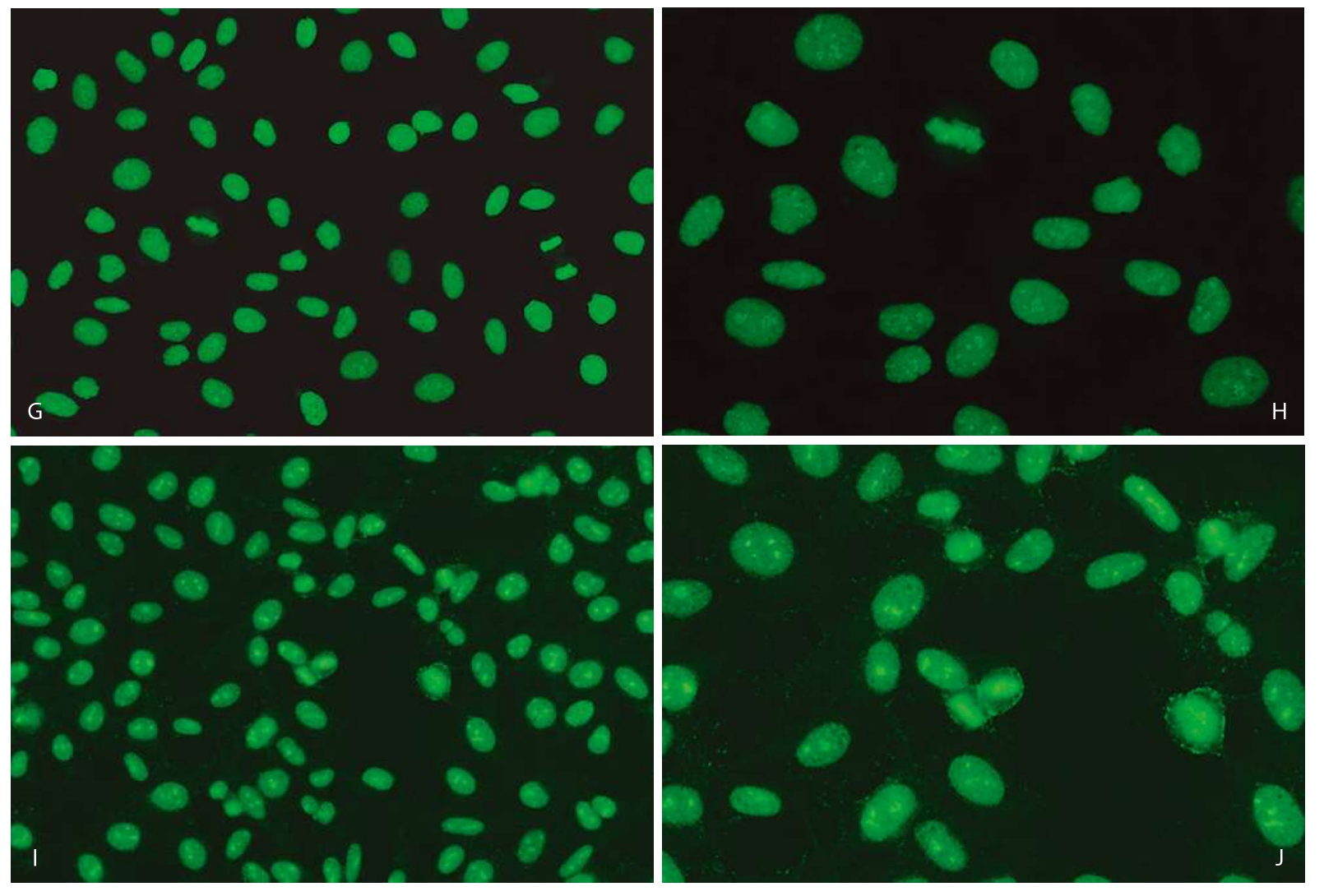
图3—3—5 不同品牌试剂HEp—2 IFA Topo Ⅰ型(AC—29)核型特点
A.欧蒙(20倍镜);B.欧蒙(40倍镜);C.INOVA(20倍镜);D.INOVA(40倍镜);E.AESKU(20倍镜);F.AESKU(40倍镜);G.MBL(20倍镜);H.MBL(40倍镜);I.康润科技(20倍镜);J.康润科技(40倍镜)
AC—29的五个核型特征中,间期细胞胞浆网状染色通常不易被观察到,这主要是由于AC—29胞浆染色较弱,在1∶80或1∶100稀释度下可能不易观察到。另外,当染色体染色强度较高时,NOR区点状染色有时也不易发现,镜检时缓慢上下调节显微镜的微调旋钮有助于观察NOR区染色。
【核型鉴别】
1.均质型(AC—1)·见本章第二节均质型核型鉴别4。(https://www.daowen.com)
2.均质型(AC—1)+均质核仁型(AC—8)混合核型·AC—1+AC—8混合核型可见间期细胞均质样染色且核仁阳性,分裂中期细胞染色体均匀着色。但该混合核型分裂中期染色体不可见NOR区强阳性点状染色,且胞浆无弱的网状结构染色。
【相关靶抗原】
DNA拓扑异构酶I
1.生物学功能·topoⅠ通过瞬时断裂和连接DNA单链,在细胞复制、重组、转录和DNA修复等过程中改变DNA分子空间构象或拓扑结构。Topo Ⅰ由765个氨基酸组成,包括五个不同区域分别是,N端区(AA:1~215)、核心亚区Ⅰ— Ⅱ(AA:216~435)、核心亚区Ⅲ(AA:436~636)、连接区(AA:637~713)和C端区(AA:714~765),其中整个核心区及C端区是topoⅠ催化活性的主要区域。
抗topoⅠ抗体于1979年首次在SSc患者中经免疫印迹法发现其可识别70 kDa蛋白,后续研究证明该蛋白是topoⅠ蛋白(分子量105 kDa)的分解产物,因此抗topoⅠ抗体又称为抗Scl—70抗体。抗Scl—70抗体可识别DNA拓扑异构酶Ⅰ上多个位点,如450~600 AA是SLE和dcSSc患者血清中抗Scl—70抗体常见的共同识别位点。另外,dcSSc患者抗Scl—70抗体可特异识别该分子N端区,SLE患者抗Scl—70抗体识别位点主要在核心亚区Ⅰ/Ⅱ,而lcSSc患者中该抗体识别位点散在分布于整个topoⅠ。
2.临床意义
(1)系统性硬化症:抗Scl—70抗体是SSc特异性分子标志物,可检出于9.4%~71% SSc患者,其中以dcSSc更常见。抗Scl—70抗体阳性SSc患者较少合并检出(<1%)其他SSc相关自身抗体如抗着丝点抗体等,患者主要特征为弥漫性皮肤纤维化,但速度不及抗RNAPⅢ抗体阳性患者。抗Scl—70抗体阳性是SSc患者风险评估的重要参数,因其易并发ILD、肾脏疾病和心脏传导阻滞,前者是目前造成SSc患者死亡的主要原因,且该抗体阳性也是SSc患者并发肿瘤的危险因素,多见于肺癌。对于SSc患者中抗Scl—70抗体滴度与疾病活动性是否相关目前尚有争议,有些研究显示两者无关联,但也有报道显示该抗体水平可随有效治疗而降低甚至消失,其生存率明显高于抗Scl—70抗体滴度未下降组[26]。
(2)系统性红斑狼疮:抗Scl—70抗体很少见于正常人或SSc患者家庭成员及其他结缔组织病患者,但可见于0~25% SLE患者(平均4.1%)[27]。因此,抗Scl—70抗体阳性不能排除SLE的诊断,但SLE患者中该抗体滴度明显低于SSc患者。
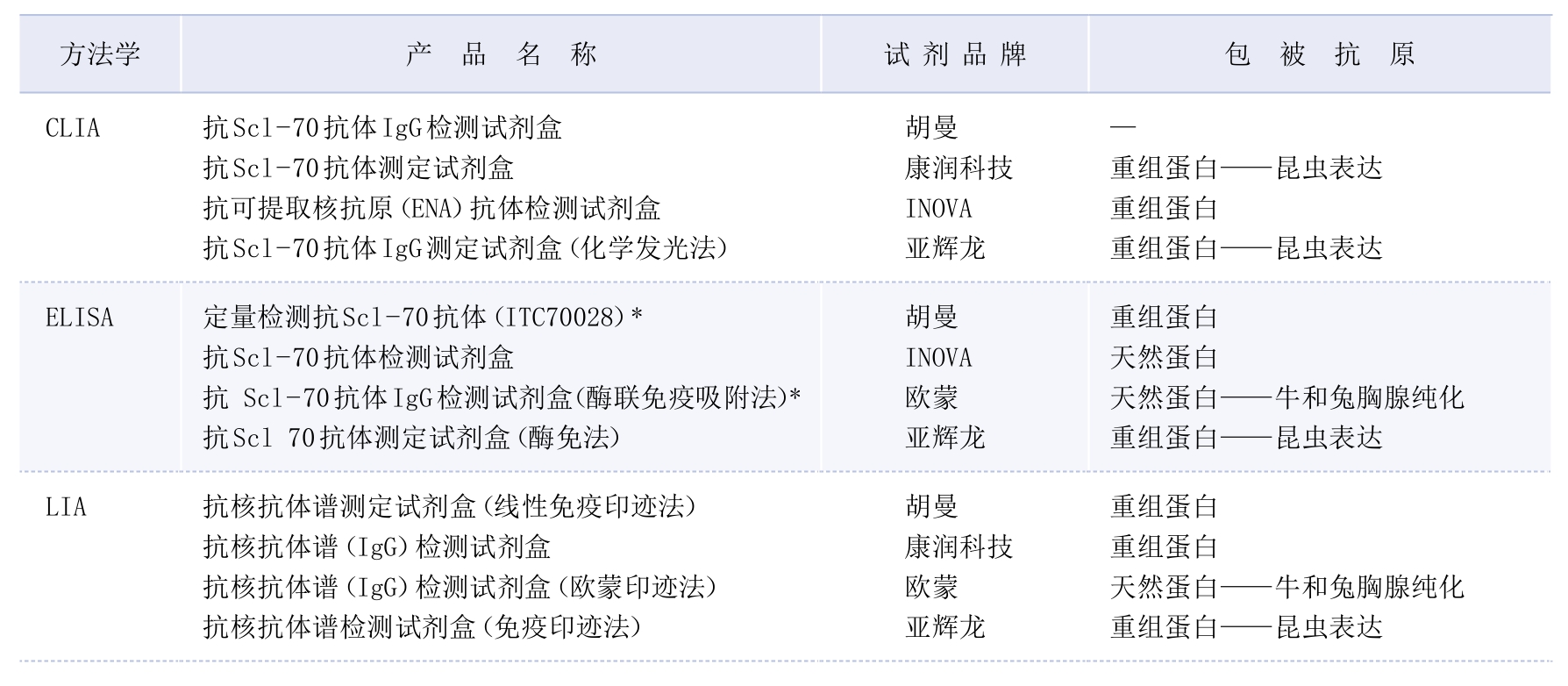
3.检测方法·国内实验室可采用商品化LIA、ELISA和CLIA试剂盒检测抗Scl—70抗体(表3—3—10)。研究显示ELISA和DIB检测抗Scl—70抗体特异性敏感性均较高(ELISA特异性为99.2%,敏感性为97.2%;DIB特异性为97.6%,敏感性为96.1%),但科研实验室常用的WB则特异性低(假阳性率为27%)[28]。
表3—3—10 实验室部分抗Scl—70抗体检测试剂盒
(续表)
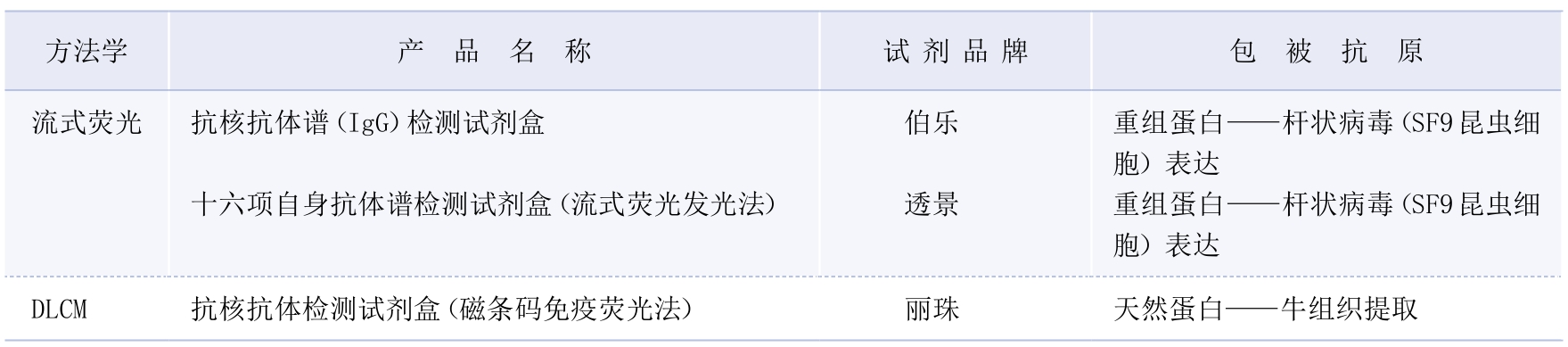
注:*试剂为科研试剂,目前尚无体外诊断试剂注册证产品。—:抗原来源未提供
