补肾软坚方药对兔一氧化氮、脂质过氧化产物及超氧化物歧化酶的干预
本研究从动脉粥样硬化氧化应激状态入手,观察补肾软坚方药对实验性动脉粥样硬化家兔血脂、一氧化氮、脂质过氧化产物及超氧化物歧化酶等影响,明晰其作用机理。
(一)材料与方法
1.主要试剂与仪器 血清总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白(LDL)、超氧化物歧化酶(SOD)、丙二醛(MDA)、一氧化氮(NO)试剂盒(南京建成生物技术有限公司);NF-κB免疫组化试剂盒(美国CHEMICON公司);氧化低密度脂蛋白(ox-LDL)ELISA试剂盒(美国RB公司);200型半自动生化分析仪(荷兰威图公司);OLYMPUS-BX40生物显微镜(BX40,日本奥林巴斯公司);HMIAS-2000高清晰度彩色病理图像分析系统(武汉同济医科大学千屏影像工程公司)。
2.药物 补肾软坚方药(主要药物组成:党参、丹参、杜仲、桑寄生、龟甲、淫羊藿、何首乌、石菖蒲、茯苓、砂仁、夏枯草、海藻等,0.5g/片,60片/瓶,天津中医药大学第一附属医院制剂,批号:071105); 辛伐他汀(40mg/片,5片/盒,Meck sharp&Dohme Ltd.U.K 生产,杭州默沙东制药有限公司分装,批号:07283)。
3.实验方法
(1)动物分组 选用普通级雄性日本大耳白兔36只,北京市维同利华实验动物中心提供,SCXK京2007-0001,体重(2.2±0.2)kg。所有动物给予普通饲料适应性饲养1周,然后随机分为正常对照组6只,模型组10只,补肾软坚组10只,辛伐他汀组10只。所有动物单笼饲养,饮水不限,自由摄食,每日每只给予150g饲料;对照组动物给予普通饲料,其他组给予高脂饲料,共9周,第10周取材。
(2)造模和给药方法 造模方法:同第三章第一节。给药方法:给予高脂饮食的同时,给药组分别给予辛伐他汀5mg/kg/次,1次/d;补肾软坚方药1g/kg/次,2次/d。
(3)血清学指标检测 分别于实验开始及第3、6、10周进行采血,采血前禁食12h,然后经耳缘静脉抽取空腹血3mL,静置1h后3000r/min离心10min,取血清于-80℃冻存待用。TG、TC以酶比色法,LDL-C、HDL-C以可见光匀相清除法,采用半自动生化分析仪测定。NO用硝酸还原酶法,SOD采用黄嘌呤氧化酶法,MDA用硫代巴比妥酸(TBA)法,ox-LDL用ELISA方法检测,步骤严格按照说明书进行。
(4)病理检测 第10周取材,用3%戊巴比妥钠(30mg/mL/kg)麻醉成功后,取出主动脉血管组织,沿纵轴剪开,生理盐水冲洗后置于10%中性福尔马林固定,进行苏丹Ⅲ染色,分析斑块面积占内膜面积的百分比;然后改刀、石蜡包埋、切片、HE染色,光镜观察病理改变并进行图像分析。测量计算内膜中膜厚度比(IT/MT)、纤维帽厚度与内中膜厚度比(FCT/IMT)及内中膜面积比值即内膜增生指数(IHI)。
(5)免疫组织化学检测 选取与病理图像分析所用切片相邻的切片用免疫组化方法检测NF-κB阳性表达。步骤:脱蜡→0.01mol PBS洗3次→3%过氧化氢封闭→0.01mol PBS洗3次→打孔液打孔10min→蒸馏水冲洗,0.01mol PBS洗3次→微波枸橼酸热修复→冷却至室温→5%兔血清封闭液封闭45min→4℃过夜→滴加一抗NFkB P65→4℃取出,复温20min→滴加二抗→37℃孵育→0.01mol PBS洗3次→DAB显色→苏木素复染,自来水冲洗→分化液分化,自来水冲洗→返蓝→中性树胶封片→显微镜下观察。每只动物选取3张切片,每张切片随机观察5个不同的高倍镜视野(40×),计算阳性细胞的面积占内膜面积的百分比,取其平均值。
(6)统计学方法 实验数据计量资料以x±s表示,多组间比较采用单因素方差分析(SPSS 11.5统计软件),差异显著性水平设为a=0.05。
(二)结果
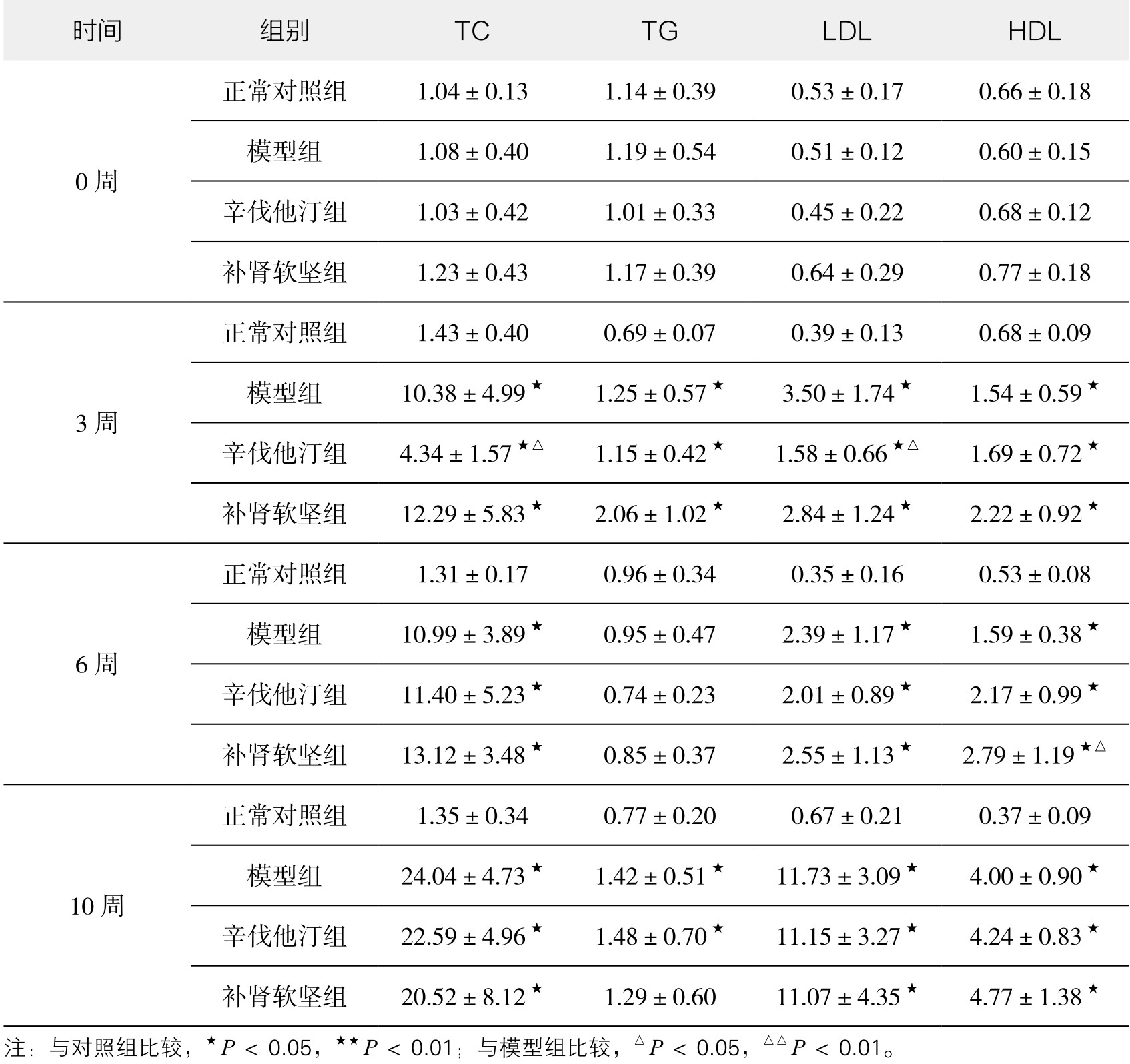
1.各组血脂水平变化的比较 表3-6显示,与正常对照组比较,模型组TC、TG、LDL、HDL呈增长趋势(P<0.05或P<0.01)。给药组与模型组比较,辛伐他汀在第3周时对血脂具有明显降低作用,与模型组比较有统计意义。补肾软坚方药对血脂的影响主要在于调脂,在第6周时对HDL-C的升高作用,与模型组比较有统计意义。
表3-6 各组血脂水平变化情况(mmol/L)(正常对照组n=6,其他组n=10)
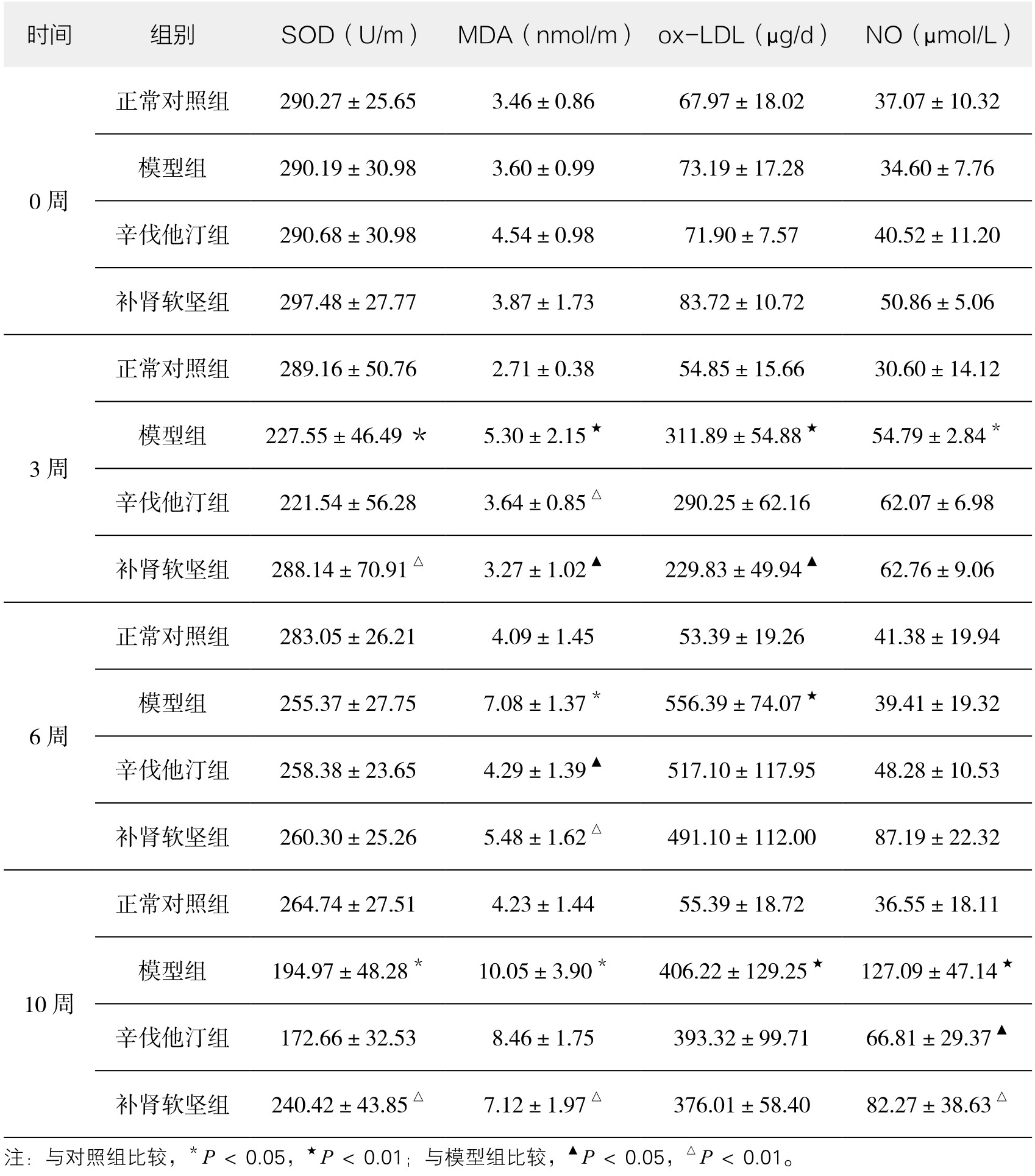
2.补肾软坚方药对SOD、MDA、ox-LDL、NO水平的影响 表3-7显示,与正常对照组比较,模型组SOD水平在第3、10周时降低,NO水平在第3、10周时增高,至第10周时,此水平大幅增加;MDA、ox-LDL水平在各时间点均增高(P<0.05或P<0.01)。给药组与模型组比较,补肾软坚组SOD水平在第3、10周时高于模型组;NO水平在第6周时高于模型组,第10周时低于模型组;MDA水平在第3、6、10周时均低于模型组;ox-LDL水平在第3周时低于模型组(P<0.05或P<0.01)。辛伐他汀组MDA水平在第3、6周时水平低于模型组;NO水平在第10周时低于模型组(P<0.05或P<0.01),其余效果不显著。可见与辛伐他汀比较,补肾软坚方药在调节SOD和NO水平方面具有一定优势。
表3-7 在不同时间点各组SOD、MDA、NO、ox-LDL水平变化(正常对照组n=6,其他组n=10)
3.NF-κB阳性表达面积比较 正常对照组血管壁见少量NF-κB阳性表达,胞核内见少量不均匀的黄褐色沉淀物,阳性染色面积与内膜面积比是0.012±0.006。模型组血管壁平滑肌细胞、内皮细胞的胞核有较多表达,在胞质内也有少量阳性表达,阳性染色面积与内膜面积比是0.162±0.046(P<0.01)。辛伐他汀组与补肾软坚组在内皮细胞和平滑肌细胞有少量表达,阳性染色面积与内膜面积比分别是0.107±0.049、0.111±0.038,均低于模型组,有统计学差异(P<0.01),给药组间无统计学差异。
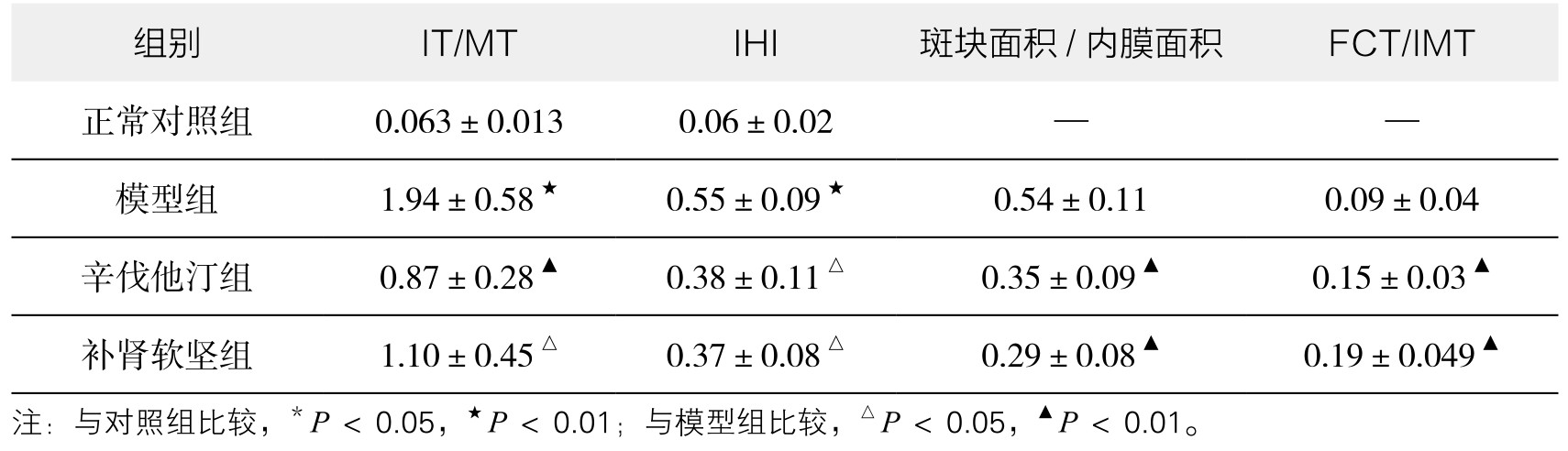
4.各组IT/MT、IHI、斑块面积与内膜面积比、纤维帽厚度 如表3-8所示,IMT的比较给药组斑块面积与内膜面积比、IT/MT、内膜增生指数低于模型组、FCT/IMT高于模型组(P<0.05或P<0.01)。给药组之间无统计学差异。
表3-8 各组IT/MT、IHI、斑块面积/内膜面积、FCT/IMT比较(%)(x±s,n=10)
(三)讨论
氧化应激与AS的发生密切相关,贯穿了AS的全过程。NF-κB的异常激活是引起炎症或氧化损伤的关键步骤,因而控制NF-κB的异常激活是治疗AS的重要策略。本实验AS兔模型的动脉壁组织NF-κB呈高表达,补肾软坚方药对其表现出明显抑制作用,与对照药辛伐他汀作用相当,两者之间无统计学意义。
在AS的发病过程中,SOD清除氧自由基的能力降低,导致氧自由基大量蓄积,破坏细胞膜的生物功能,导致细胞损伤老化;氧化应激作用增强,MDA等毒性物质产生增多,修饰LDL形成ox-LDL。ox-LDL激活炎性因子引起内皮损伤,中断NO的受体后信号传递,直接降解和灭活NO,引起局部血管收缩,血管平滑肌细胞(VSMC)增殖和血小板黏附聚集;加之被氧化的脂质沉积于动脉壁并被巨噬细胞吞噬形成泡沫细胞,使脂核增大,内膜增厚,从而使纤维帽变薄,加快AS的发病进程。可见,体内过氧化产物是影响斑块面积、内膜和纤维帽厚度的重要因素之一。本实验结果显示,AS兔模型病理分析显示内膜增厚、纤维帽变薄;体内存在着明显的脂质过氧化损伤,内皮功能紊乱。血脂水平上升,ox-LDL、MDA血清含量呈时间依赖性增加,SOD血清含量呈时间依赖性降低,NO呈现上升-降低-再上升的波浪形。在造模因素干预后,机体保护性反应致使NO含量稍有增加;随着干预因素对机体的不断刺激,至6周时NO水平低于正常对照组水平;至10周时,远远超过正常对照组水平。在生理状态下,NO可防止内皮损害,体现其保护作用。病理情况下,NO过高会对机体产生负面影响,可产生细胞毒素、致癌等病理作用。NO毒性作用机制主要为:NO作用于铁蛋白,影响细胞呼吸及能量代谢,参与过氧化脂质的形成;加速过氧亚硝基阴离子(ONOO-)及羟自由基(·OH)等氧化剂的生成,引起细胞损害,致使细胞死亡。所以,10周时过高的NO水平不仅对机体没有保护作用,反而加重了脂质过氧化对机体的损伤。
影响斑块不稳定的另一重要因素是纤维帽厚度,本实验兔AS模型主动脉内膜明显增厚、斑块面积增大、纤维帽变薄,增加了斑块的不稳定性。而补肾软坚方药可防止纤维帽变薄,控制斑块发展,从而有效保护动脉壁。此保护作用可能与抗脂质过氧化有关。实验结果显示,补肾软坚方药可减少MDA和ox-LDL的生成,增强SOD活力,清除氧自由基,减轻脂质过氧化损伤,延缓ox-LDL对组织的损伤,从始动环节抑制动脉粥样硬化斑块的形成;而且能够调节NO水平,使之维持在一定范围内,改善内皮功能状态;下调氧自由基激活转录调控因子NF-kB及相关炎症因子的表达,从而在保护血管内皮细胞中起重要作用。尤其在升高SOD和NO水平方面,补肾软坚方药优于辛伐他汀,可见补肾软坚方药在提高机体保护性因素方面具有一定优势;其祛邪扶正兼顾,通过加强机体正气,提高HDL、SOD和NO水平,来抵抗邪气,降低血脂水平,抗脂质过氧化,从而实现抗AS、稳定AS斑块的作用。这与中医对本病的病因病机认识及以此制定的治疗法则是一致的。
中医对本病病因病机的认识是虚、瘀、毒。虚即脾肾两虚,瘀即血瘀,毒即痰毒和热毒。脂质过氧化形成的氧化物可能是痰毒血瘀的物质基础。因此,通过“益肾健脾、软坚散结”疗法,运用具有健脾益肾、涤痰降浊、活血散结之功效的补肾软坚方药,不仅可以使各种血管活性物质在体内的表达及比例正常,而且可以使内皮功能得以恢复,以此达到抗氧化、保护血管内皮、稳定AS斑块的作用。
