补肾软坚方药对动脉粥样硬化模型辅助性T淋巴细胞亚群的干预研究
近年来的研究表明,动脉粥样硬化(AS)是一种自身免疫性疾病,固有免疫与适应性免疫均参与AS的起始与进展,T细胞作为适应性免疫的重要组成部分在其中发挥重要作用。斑块中大多数T细胞为CD4+T细胞,其中辅助性T细胞(helper Tlymphocyte,Th)如Th1、Th2、Th17等均为其重要成分。补肾软坚方药是国医大师阮士怡教授研制的院内制剂,其剂型稳定,质控符合天津市食品药品监督管理局医疗机构制剂标准(TJZB-Z2008110052),临床应用30余年,其治疗动脉粥样硬化性疾病疗效肯定。团队的前期研究表明其对AS模型也具有良好的效果,但其抗AS的机制是否与免疫机制相关尚不清楚。故本研究采用高脂饲料喂养法复制AS兔模型,观察补肾软坚方药对AS模型兔辅助性T淋巴细胞亚群Th1、Th2、Th17水平的影响。
(一)材料与方法
1.实验动物 清洁级健康成年雄性新西兰大白兔24只,体重(2.2±0.2)kg。
2.主要试剂和药品 苏木素-伊红(HE)染色试剂盒,TC试剂盒,TG试剂盒,HDL-C试剂盒,LDL-C试剂盒,T-bet、GATA3、维甲酸相关孤儿受体γ t抗体(RORγ t)的Q-PCR,干扰素-γ(IFN-γ)酶联免疫检测试剂盒,IL-4酶联免疫检测试剂盒,IL-17酶联免疫检测试剂盒。补肾软坚方药,阿托伐他汀钙片。
3.方法
(1)实验分组及干预方法 所有动物予普通饲料适应性喂养1周后,测定体重和血脂,排除饮食异常者,稳定血脂水平和代谢状况。随机分为空白对照组、模型组、补肾软坚方药组(以下简称为补肾软坚组)、阿托伐他汀组,每组6只。空白对照组给予普通饲料喂养直至实验结束,模型组、阿托伐他汀组、补肾软坚组每天给予高脂饲料喂养直至实验结束。空白对照组,每只兔予普通饲料100g/d,并定时予生理盐水灌胃。模型组,每只兔予高脂饲料100g/d,并定时予生理盐水灌胃。阿托伐他汀组,每只兔予高脂饲料100g/d,并定时按5mg/kg·d灌胃,1次/日。补肾软坚组,每只兔予高脂饲料100g/d,并定时按1g/kg·d灌胃,2次/日。
(2)病理组织及标本的采集与保存 12周末将各组实验兔取材,术前12h禁食,自由饮水,活动不受限制。用3%戊巴比妥钠(1mL/kg)经耳缘静脉注射麻醉,新西兰兔取仰卧位固定于手术操作台上,手术器械消毒备用,手术按外科无菌原则操作。分别抽取心腔动脉血并离心取上清液,解剖取出胸主动脉、脾脏保存。
(3)血脂水平检测 用全自动生化分析仪进行血脂水平(总胆固醇TC、总甘油三酯TG、低密度脂蛋白LDL-C、高密度脂蛋白HDL-C)检测。
(4)主动脉病理形态学观察 将胸主动脉进行石蜡切片,行苏木精染色和伊红染色,于光镜下观察。
(5)内中膜面积比测量 运用Image-pro plus 6.0软件测量并计算内中膜面积比以衡量血管增生情况。内中膜面积比(100%)=新生内膜面积/中膜面积,其中,新生内膜面积(Neointimal area,NIA)=内弹力板围绕面积(Internal elastic laminal area,IELA)-管腔面积(Lumen area,LA);中膜面积(Media area,MA)=外弹力板围绕面积(External elastic laminal area,EELA)-内弹力板围绕面积。
(6)数据检测 分别对脾脏组织T-bet、GATA3、RORγt mRNA水平检测,血浆IFN-γ、IL-4、IL-17水平检测。
4.统计学方法 实验数据统计分析采用SPSS 17.0统计软件,计量资料以均值±标准差(x±s)表示,多组之间的比较采用单因素方差分析,两两比较采用LSD检验,P<0.05为差异具有显著性,P<0.01为差异非常显著。
(二)结果
1.一般情况 实验期间,每组动物每周称取体重1次,观察动物一般情况。空白对照组动物精神佳,毛色光泽度高,捕捉反应敏捷,粪便粒大松软,舌淡红,纳食可,体重随时间变化呈增长趋势;模型组高脂肪喂养后开始出现精神状态差,目光呆滞,捕捉反应迟钝,活动较前减少,眼睛见脂肪沉淀,粪便粒小粘连,舌暗红,纳食可,少数动物出现腹胀、腹泻等症状,需少量而多次投喂。
2.主动脉形态学观察结果
(1)各组兔主动脉内膜标本大体形态学观察 空白对照组主动脉内膜光滑完整、色泽红润、无脂质沉积;模型组主动脉内膜呈瓷白色,可见黄色不规则隆起斑块或黄白色条纹;阿托伐他汀组主动脉内膜可见油脂状物质,表面凹凸不平,突出管腔,较模型组病变程度减轻;补肾软坚组主动脉内膜可见油脂状物质,表面凹凸不平,突出管腔,较模型组病变程度减轻。
(2)各组兔主动脉HE病理形态学改变 本实验通过高脂喂养的方法建立新西兰兔AS模型,12周末进行兔主动脉内膜HE病理形态学观察。空白对照组可见内皮光滑完整,单层紧贴弹力板,中层平滑肌细胞排列整齐,呈梭形或椭圆形,胞浆嗜酸性红染,无泡沫细胞及脂质沉积;模型组可见内膜增生明显,管腔明显变窄,大量泡沫细胞堆积,伴大量巨噬细胞、淋巴细胞等浸润,脂质沉积;阿托伐他汀组可见内膜增生明显,可见脂质沉积,伴大量脂滴及巨噬细胞、淋巴细胞等浸润,与模型组比较,病变程度减轻;补肾软坚组可见内膜增生明显,可见脂质沉积,伴大量脂滴及巨噬细胞、淋巴细胞等浸润,与模型组比较,病变程度减轻。
(3)各组兔主动脉内中膜面积比 如表3-31所示,与空白对照组比较,模型组主动脉内中膜面积比明显增大(P<0.01);与模型组比较,阿托伐他汀组主动脉内中膜面积比明显减低(P<0.01),补肾软坚组主动脉内中膜面积比减低(P<0.05)。
表3-31 各组实验兔主动脉内中膜面积比(x±s,n=6)

3.血脂水平的表达 与空白对照组比较,模型组TC、TG、HDL-C、LDL-C水平均明显升高(P<0.01);与模型组比较,阿托伐他汀组TC、TG、LDL-C水平均明显下降,HDL-C水平明显升高(P<0.01);与模型组比较,补肾软坚组TC、TG、HDL-C、LDL-C差异不显著(P>0.05)。(见表3-32)
表3-32 各组实验兔血清血脂水平mmol/L(x±s,n=6)
4.脾脏中T-bet、GATA3、RORγt mRNA水平的表达 通过紫外透射仪观察琼脂糖凝胶上PCR产物电泳结果并经凝胶成像系统(UVP)拍照。图片结果采用UVP凝胶成像系统配套Vision Works LS软件进行半定量分析,结果见表3-33。
表3-33 脾脏中T-bet、GATA3、RORγ t mRNA表达水平(x±s,n=6)
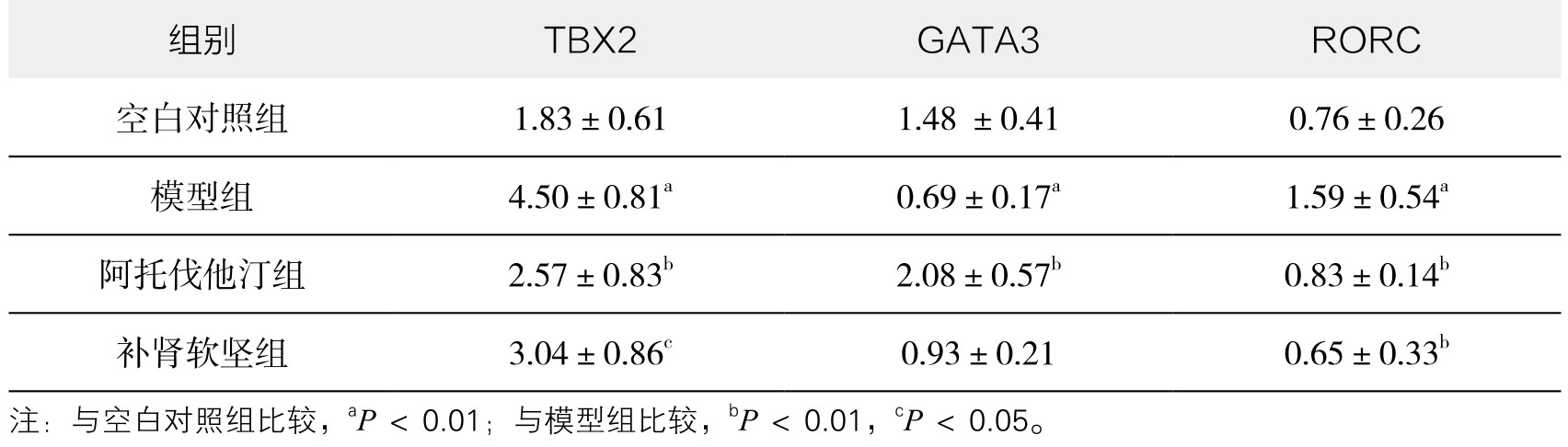
通过单因素方差分析及LSD两两分析,与空白对照组比较,模型组脾脏中T-bet mRNA水平显著升高(P<0.01);与模型组比较,阿托伐他汀组脾脏中T-bet mRNA水平显著降低(P<0.01);与模型组比较,补肾软坚组脾脏中T-bet mRNA水平降低(P<0.05);阿托伐他汀组与补肾软坚组脾脏中T-bet mRNA水平比较,差异无统计学意义。(见图3-62)
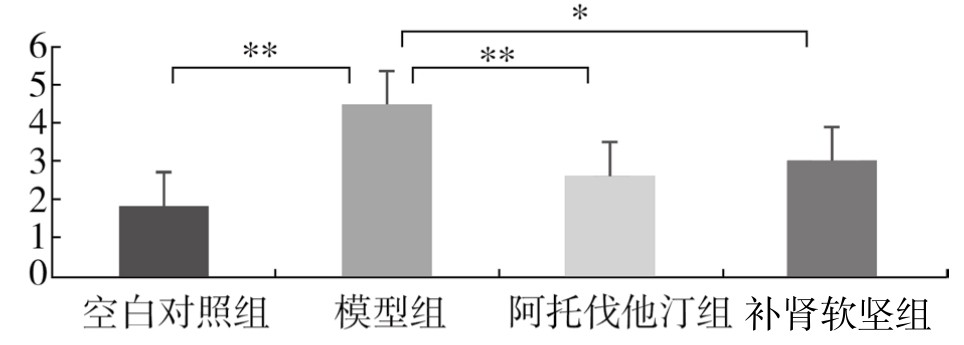
图3-62 各组实验兔脾脏T-bet mRNA水平比较
注:*P<0.05,**P<0.01。
与空白对照组比较,模型组脾脏中GATA3 mRNA 水平显著降低(P<0.01);与模型组比较,阿托伐他汀组脾脏中GATA3 mRNA水平显著升高(P<0.01);模型组与补肾软坚组、阿托伐他汀组与补肾软坚组脾脏中GATA3 mRNA水平比较,差异均无统计学意义。(见图3-63)
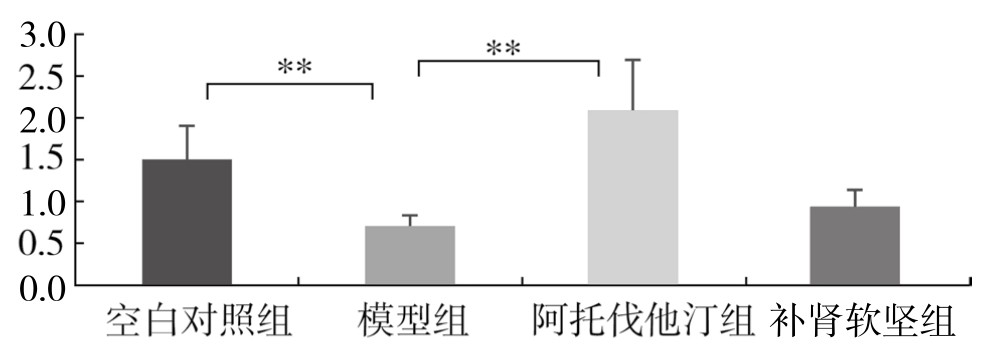
图3-63 各组实验兔脾脏GATA3 mRNA水平比较
注:**P<0.01。
与空白对照组比较,模型组脾脏中RORγ t mRNA水平明显升高(P<0.01);与模型组比较,阿托伐他汀组脾脏中RORγ t mRNA水平明显降低(P<0.01);与模型组比较,补肾软坚组脾脏中RORγ t mRNA水平明显降低(P<0.01);阿托伐他汀组与补肾软坚组脾脏中RORγ t mRNA水平比较,差异不显著。(见图3-64)
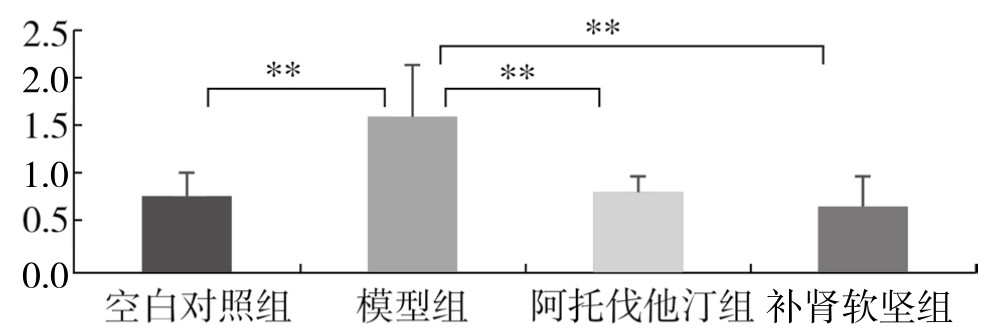
图3-64 各组实验兔脾脏RORγ t mRNA水平比较
注:**P<0.01。
5.血浆IFN-γ、IL-4、IL-17 mRNA表达水平 饲养12周后,各组实验兔血浆IFN-γ、IL-4、IL-17水平结果见表3-34。
表3-34 各组实验兔血浆 IFN-γ 、IL-4、IL-17 水平(x±s,n=6)
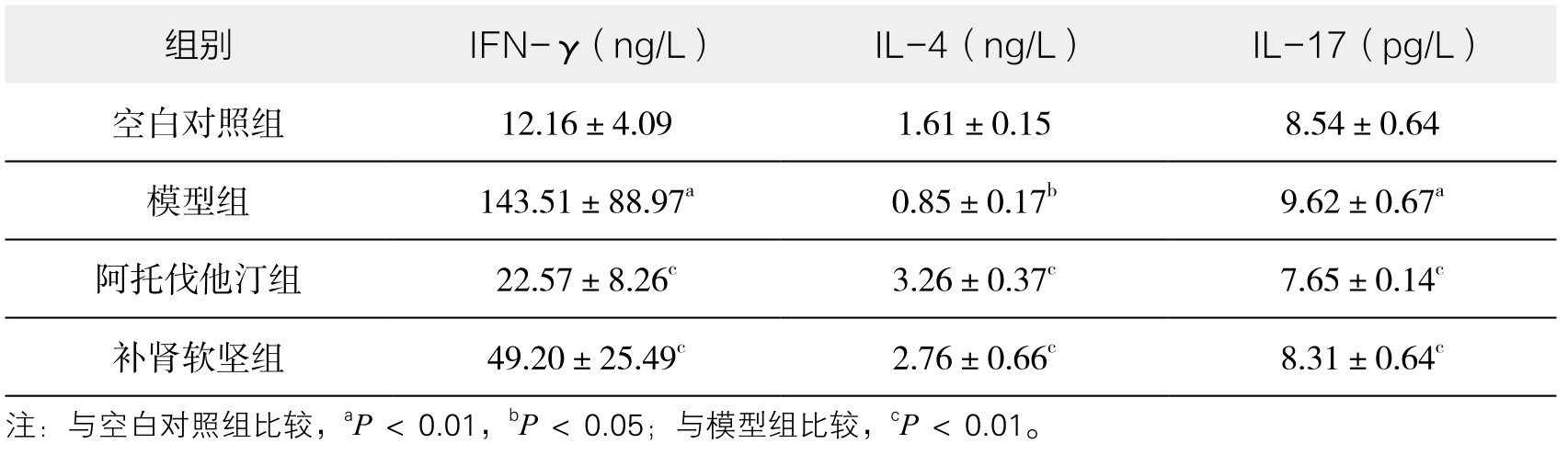
通过单因素方差分析及LSD两两分析,与空白对照组比较,模型组血浆中IFN-γ水平明显升高(P<0.01);与模型组比较,阿托伐他汀组血浆中IFN-γ水平明显降低(P<0.01);与模型组比较,补肾软坚组血浆中IFN-γ水平明显降低(P<0.01);阿托伐他汀组与补肾软坚组血浆中IFN-γ水平比较,差异不显著。(见图3-65)
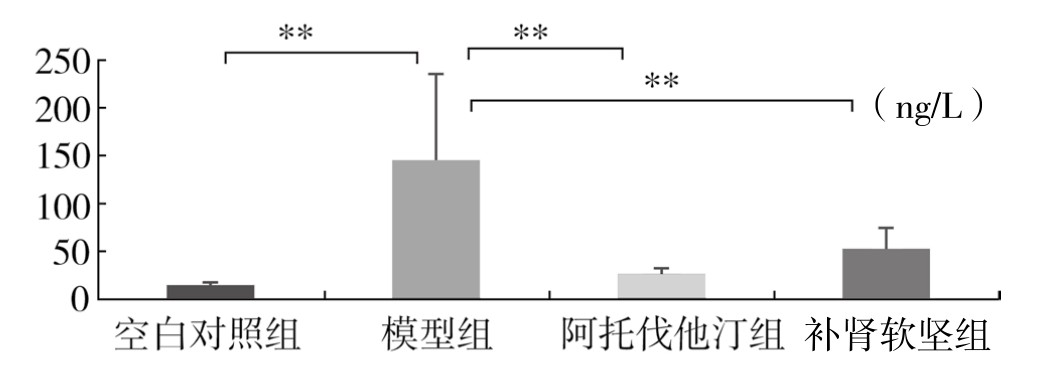
图3-65 各组实验兔血浆IFN-γ水平比较
注:**P<0.01。
与空白对照组比较,模型组血浆中 IL-4 水平降低(P<0.05);与模型组比较,阿托伐他汀组血浆中 IL-4 水平明显升高(P<0.01);与模型组比较,补肾软坚组血浆中IL-4水平明显升高(P<0.01);阿托伐他汀组与补肾软坚组血浆中 IL-4 水平比较,差异不显著。(见图 3-66)

图 3-66 各组实验兔血浆IL-4水平比较
注:*P<0.05,**P<0.01。
与空白对照组比较,模型组血浆中IL-17水平升高(P<0.01);与模型组比较,阿托伐他汀组血浆中IL-17水平明显降低(P<0.01);与模型组比较,补肾软坚组血浆中IL-17水平明显降低(P<0.01);阿托伐他汀组与补肾软坚组血浆中IL-17水平比较,差异不显著。(见图3-67)
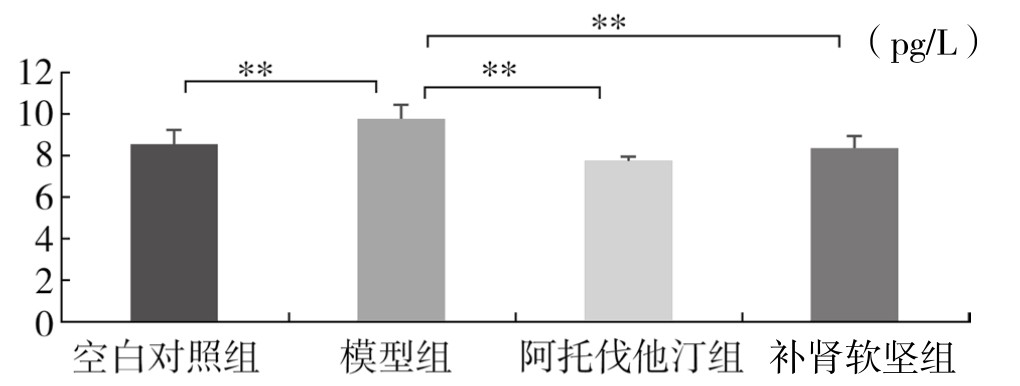
图3-67 各组实验兔血浆IL-17水平比较
注:*P<0.05,**P<0.01。
(三)讨论
AS作为心脑血管疾病的共同病理基础,其预防及治疗的相关研究一直是心血管病研究的重点与热点。在过去的近二十年中,炎症作为AS过程中的重要角色已得到专家们的普遍认可。近年来,大量报道显示免疫细胞是AS病理过程的直接参与者,固有免疫和适应性免疫能在AS中引发炎症,而T细胞在AS病变进展中起着关键作用。新近研究显示,在人体和动物模型AS斑块中大多数T细胞是CD4+T细胞,其中辅助性T淋巴细胞亚群(Th)为其主要成分,Th细胞作为一种重要的免疫调节细胞在免疫系统中发挥重要作用,能迅速分裂并分泌相关细胞因子。根据所产生的细胞因子和效应细胞的生物功能特征,传统上辅助性T淋巴细胞亚群主要分为Th1、Th2和新发现的T淋巴细胞亚群Th17。Th1与Th2细胞之间关系失衡、Th17细胞激活能促进AS斑块的炎症反应并造成斑块不稳定。
T细胞检测多运用流式细胞术,但结合本实验具体情况、实验物种及实验条件限制,未选择流式细胞术作为检测T细胞水平的方法,仅运用Q-PCR法对脾脏中Th1、Th2、Th17各自相关转录因子T-bet、GATA3、RORγ t进行检测,并运用ELISA法对血浆中Th1、Th2、Th17各自相关效应因子IFN-γ 、IL-4、IL-17进行检测。本实验研究结果显示,阿托伐他汀组与补肾软坚组在脾脏中T-bet mRNA水平均较模型组降低;阿托伐他汀组在脾脏中GATA3 mRNA水平较模型组升高,而补肾软坚组与模型组差异不显著;阿托伐他汀组与补肾软坚组在脾脏中RORγ t mRNA水平均较模型组明显降低。此外,阿托伐他汀组与补肾软坚组在血浆中IFN-γ 水平均较模型组降低,IL-4水平均较模型组明显升高,IL-17水平均较模型组明显降低。综上所述,我们推测补肾软坚方药可能通过调控Th1、Th17表达影响AS进程。
