补肾软坚方药调节脾Th1干预ApoE-/-小鼠动脉粥样硬化的机制研究
动脉粥样硬化是中老年人普遍存在的一种病变,也是多种心脑血管疾病发生的病理基础,目前的普遍观点认为AS是一种“炎症免疫性疾病”。脾脏是机体重要的免疫器官,是机体细胞免疫和体液免疫中心。最近研究证实,AS是Th1占主导的自身免疫状态。而对于临床治疗AS有效的补肾软坚方药,本团队从炎症、细胞凋亡、氧化应激及抗硝基化等多个角度进行了研究,发现补肾软坚方药在早期可通过对抗炎症、内质网应激等来对抗AS的发展。以补肾软坚方药为干预手段,以脾Th1适应性免疫为切入点,探讨补肾软坚方药是否通过调节脾Th1适应性免疫来抑制AS的发生发展,从而为中医药治疗AS提供新思路及实验依据。
(一)材料与方法
1.实验动物 6周龄雄性C57BL/6J野生型小鼠24只,体质量(23.27±1.31)g;6周龄雄性ApoE-/-小鼠(C57BL/6J背景)72只,体质量(22.63±1.40)g。
2.主要试剂与药品 辛伐他汀片,补肾软坚方药,甘油三酯(TG)测试盒,高密度脂蛋白胆固醇(HDL-C)测试盒,总胆固醇(T-CHO)测试盒,低密度脂蛋白胆固醇(LDL-C)测试盒,AngⅡ酶联免疫检测试剂盒,Trizol溶液,cDNA第一链合成试剂盒,SYBR Green试剂盒,DNA/RNA共提取试剂盒。
3.方法
(1)分组给药 将24只C57BL/6J野生型小鼠作为对照组,72只ApoE-/-小鼠随机分为模型组、补肾软坚组、辛伐他汀组,每组24只。对照组予以普通饮食,其余三组高脂饮食喂养,补肾软坚组同时以补肾软坚方药(2340mg·kg-1·d-1)0.2mL灌胃给药,辛伐他汀组予辛伐他汀(2.6mg·kg-1·d-1)等量灌胃给药,其余两组等量蒸馏水灌胃。
(2)取材 分别于第4周、8周、12周三个时间点各组取8只小鼠处死,取血并摘取主动脉,称重后置于中性福尔马林中固定备用。取脾脏组织,于4℃生理盐水中冲洗,滤纸吸干,称重后迅速置于液氮中冻存。取材完毕,迅速将血清和主动脉、脾脏组织转移至-80℃冰箱保存备用,选取12周主动脉和脾脏组织进行RNA检测。
4.标本检测项目
(1)酶联免疫吸附法(ELISA)检测Ang Ⅱ的表达 使用Ang Ⅱ ELISA试剂盒检测,按说明书进行操作。对血清中血管紧张素Ⅱ(Ang Ⅱ)的含量进行检测。采用摘眼球取血法,血液于室温放置30min后,3000r/min离心15min,收集上层血清转移至离心管中,置于-80℃冰箱保存备用。
(2)RT-qPCR检测脾脏组织GM-CSF、主动脉组织T-bet、IFN-γ基因表达Trizol试剂盒提取脾脏组织总RNA,紫外分光光度仪测mRNA的含量、纯度,用逆转录试剂盒转录成cDNA,以GAPDH为内参,以扩增片段与GAPDH的灰度比值表示产物多少,进行半定量。95℃变性15s,60℃退火/延伸1min,40个循环。目的基因及内参基因引物序列见表3-35。
表3-35 目的基因及内参基因引物序列

根据RT-qPCR原始检测结果,采用2-ΔΔCt法进行数据的相对定量分析,ΔΔCt=(待测样品目的基因平均Ct值-待测样品内参基因平均Ct值)-(对照样品目的基因平均Ct值-对照样品内参基因平均Ct值)。
5.统计学方法 计量资料数据均以x±s表示,多组间比较采用单因素方差分析(One way-ANOVA)。运用IBM SPSS Statistics 22软件进行数据处理,P<0.05为差异有统计学意义。
(二)结果
1.小鼠脾重量和脾指数 实验表明各个时间点,模型组脾重量、脾指数均高于正常组。用补肾软坚方药干预后,脾重量和脾指数都较模型组降低,在第12周时有统计学意义。辛伐他汀干预在第4周、12周时有统计学意义;第8周时有降低趋势,无统计学意义。提示补肾软坚方药可能在一定程度上干预脾免疫来对抗AS病变形成,第12周时效果优于第4周、8周。因此,在之后的Th1适应性免疫通路的探讨中选取第12周这一时间点。(见表3-36、表3-37,图3-68、图3-69及附录图3-70)
表3-36 各组小鼠脾重量变化情况(mg,x±s,n=8)
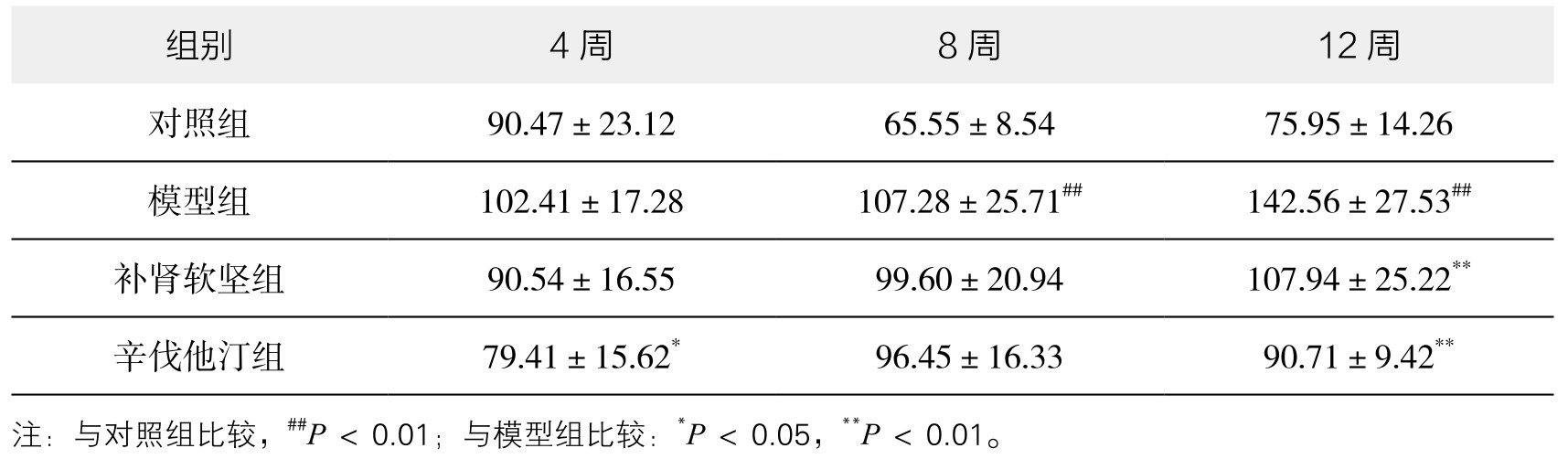
表3-37 各组小鼠脾指数变化情况(mg/g,x±s,n=8)
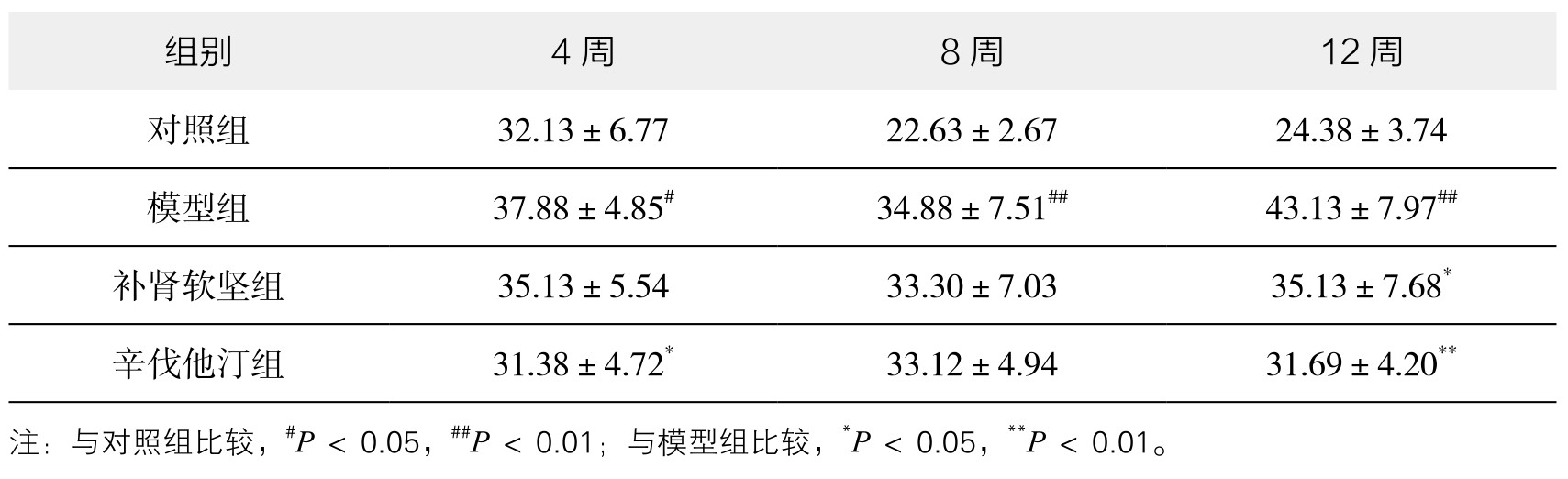

图3-68 各组小鼠脾重量变化情况
注:与对照组比较,##P<0.01;与模型组比较,*P<0.05,**P<0.01。
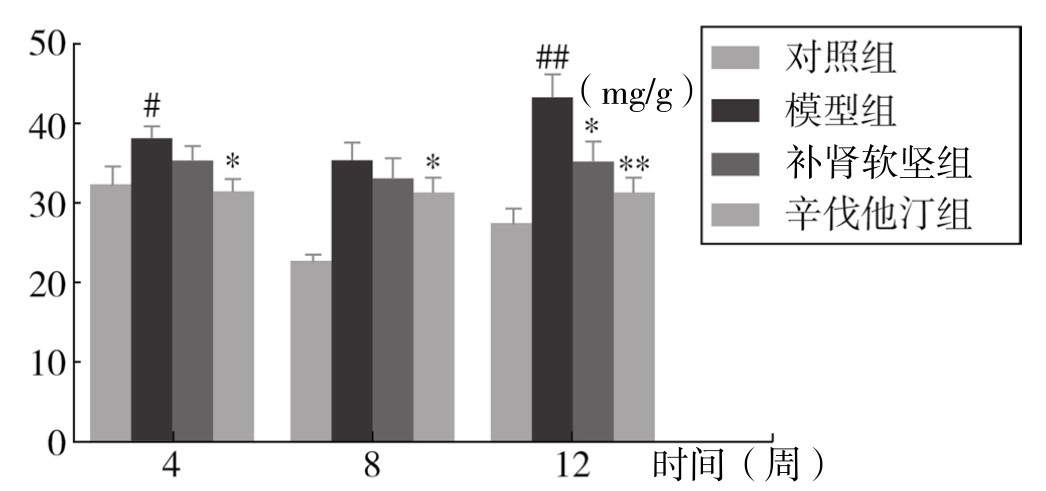
图3-69 各组小鼠脾指数变化情况
注:与对照组比较,#P<0.05,##P<0.01;与模型组比较,*P<0.05,**P<0.01。
2.AngⅡ的表达 模型组AngⅡ浓度在第4周、8周、12周呈现递增的形式。在第8周时辛伐他汀组AngⅡ数值低于模型组,具有统计学意义(P<0.05)。随着药物干预时间的增加,从第8周开始,补肾软坚方药降低AngⅡ的作用开始显效,第12周时有统计学意义。提示补肾软坚方药对AS的干预作用主要是通过降低AngⅡ浓度。(见表3-38,图3-71)
表3-38 各组小鼠血清 AngⅡ浓度变化情况(ng/L,x±s,n=8)
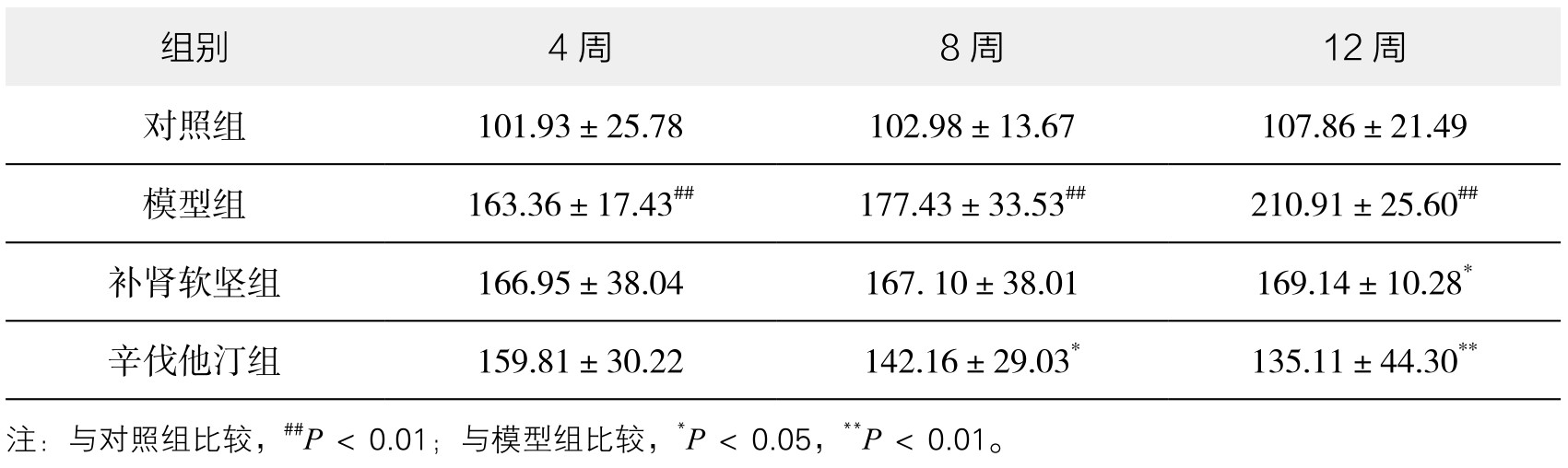
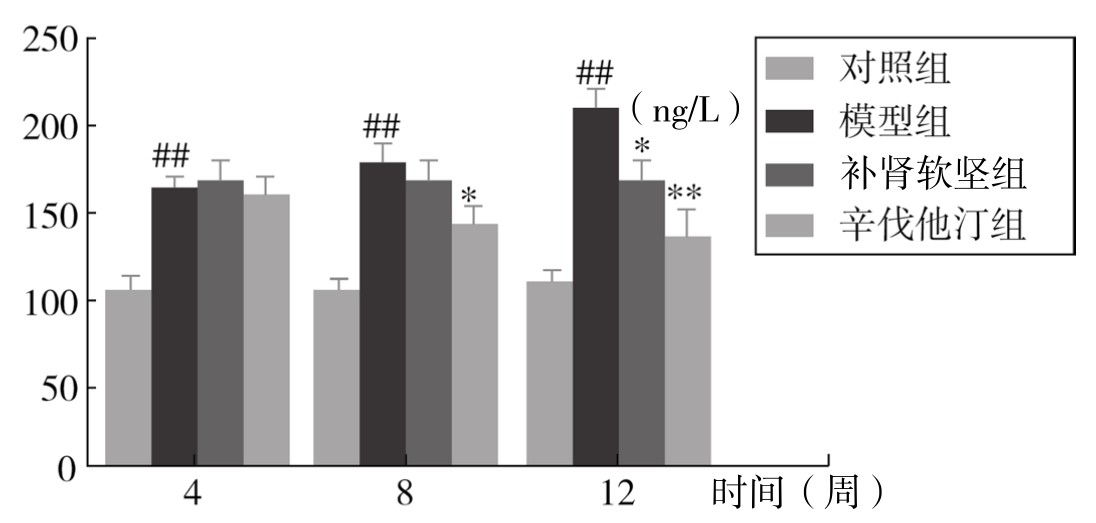
图3-71 各组小鼠血清AngⅡ浓度
注:与对照组比较,##P<0.01;与模型组比较,*P<0.05,**P<0.01。
3.脾GM-CSF mRNA,主动脉T-bet、IFN-γ mRNA的表达 从表3-39、表3-40可以看出,与对照组比较,模型组及给药组脾中GM-CSF mRNA及主动脉T-bet、IFN-γ mRNA的表达均升高。补肾软坚方药干预后,GM-CSF、T-bet、IFN-γ mRNA的表达都有一定程度降低。初步表明补肾软坚方药可能通过影响脾Th1免疫途径而影响AS病变程度,首先降低脾中GM-CSF的产生,影响IRA B细胞对树突状细胞的作用,进而导致Th1细胞的减少,分泌IFN-γ的作用减弱,减轻病变程度。(见图3-72、图3-73和图3-74)
表3-39 各组小鼠脾组织GM-CSF mRNA相对表达水平(x±s,n=6)

表3-40 各组小鼠主动脉组织T-bet、IFN-γ mRNA相对表达水平(x±s,n=6)
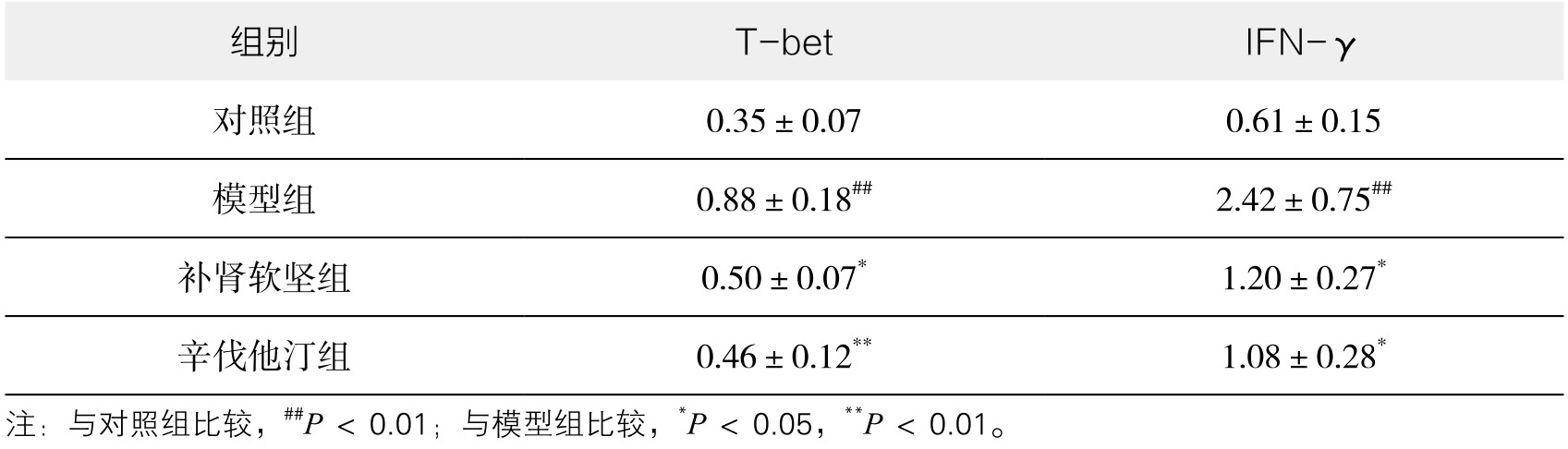
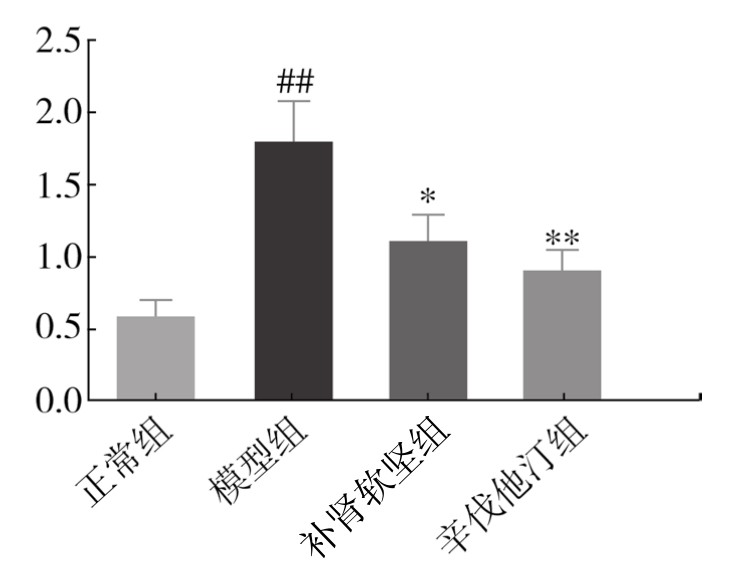
图3-72 各组小鼠脾脏组织GM-CSF mRNA相对表达水平
注:与对照组比较,##P<0.01;与模型组比较,*P<0.05,**P<0.01。
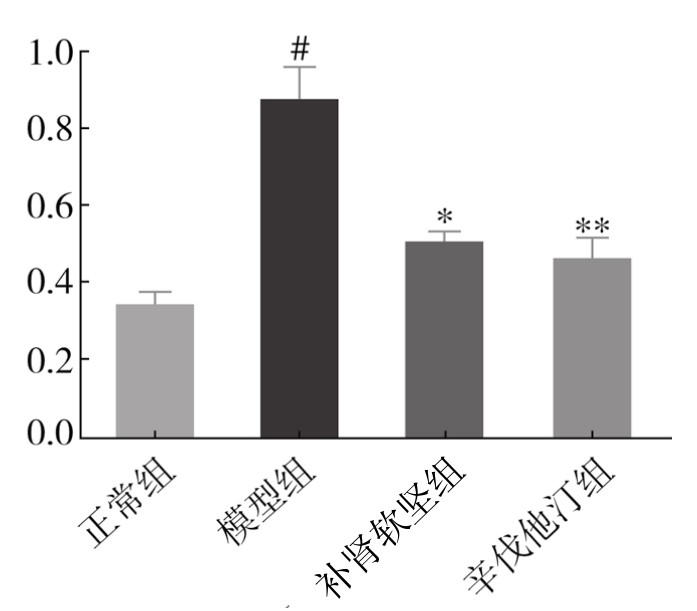
图3-73 各组小鼠主动脉组织T-bet mRNA相对表达水平
注:与对照组比较,##P<0.01;与模型组比较,*P<0.05,**P<0.01。

图3-74 各组小鼠主动脉组织 IFN-γ mRNA 相对表达水平
注:与对照组比较,##P<0.01;与模型组比较,*P<0.05。
(三)讨论
固有免疫与适应性免疫均参与AS的起始与进展,T细胞作为适应性免疫的重要组成部分在其中发挥重要作用。有研究发现,ApoE-/-小鼠脾中CD8+、CD25+T细胞对免疫信号起抑制作用,转录CD8+、CD25+T细胞到ApoE-/-小鼠能抑制脾CD4+T细胞增殖,减少AS病变。
本实验运用Real-time PCR法对脾脏中GM-CSF及主动脉中Th1转录因子T-bet和效应因子IFN-γ的mRNA表达情况进行检测。结果显示,ApoE-/-小鼠高脂饮食饲养后,脾中GM-CSF mRNA及主动脉T-bet、IFN-γmRNA的表达均升高。补肾软坚方药干预后,GM-CSF、T-bet、IFN-γmRNA的表达都有一定程度降低。初步表明补肾软坚方药可能是通过影响脾Th1免疫途径而影响AS病变程度,首先降低脾中GM-CSF的产生,影响IRA B细胞对树突状细胞的作用,进而导致Th1细胞减少,分泌IFN-γ的作用减弱,减轻病变程度,从一个较新的角度阐释了补肾软坚方药治疗AS的药理机制。
