补肾软坚方药对实验性动脉粥样硬化家兔HO-1 mRNA及其相关通路的影响
动脉粥样硬化(AS)的发病机制复杂,氧化应激机制是其中的一个中间环节,活性氧(ROS)过量生成,就会对机体造成氧化损伤。越来越多的证据表明氧化应激参与并促进AS的发生、发展,在AS病程中发挥重要作用。随着AS氧化应激机制研究的深入,抗氧化治疗在AS相关疾病的临床治疗中的作用也逐步彰显。补肾软坚方药立法于“益肾健脾,软坚散结”,临床应用广泛,对AS病变疗效明确,对实验性动脉粥样硬化也具有较好的治疗作用,然而补肾软坚方药抑制AS发生、发展过程的机制尚未完全阐明。本实验观察补肾软坚方药对动脉粥样硬化氧化应激作用的影响,从对血红素氧合酶-1(haem oxygenase-1,HO-1)及其对HO-1/CO-cGMP调控角度入手,探讨补肾软坚方药对AS的干预机制。
(一)材料与方法
1.实验动物 普通级雄性日本大耳白兔56只〔北京市维通利华实验动物中心,许可证编号SCXK(京)2007-0001,防疫合格证号:20060038〕,体重(2.2±0.2)kg。
2.药物和试剂 补肾软坚方药(主要药物组成:党参、丹参、杜仲、桑寄生、龟甲、淫羊藿、何首乌、石菖蒲、茯苓、砂仁、夏枯草、海藻等,0.5g/片,60片/瓶,天津中医药大学第一附属医院制剂,批号:071105);辛伐他汀(40mg/片,5片/盒,Meck sharp&Dohme Ltd.U.K生产,杭州默沙东制药有限公司分装,批号:07283)。实时荧光定量PCR(Real-time quantitative Polymerase Chain Reaction,简称Real Time PCR)试剂盒购于美国Invitrogen公司,批号:100008919;环氧合酶-2(cyclooxygenase-2,COX-2)、一氧化碳血红素(Carboxyhemoglobin,HbCO)、环磷酸鸟苷(cyclic Guanosine Monophosphate,cGMP)等ELISA试剂盒购于美国R&D systems公司;羊HO-1多克隆抗体(sc-7695)、驴抗羊FITC-IgG(sc-2024)均购于SANTA CRUZ公司;HO-1引物:上游:5’ TTGGCTGG CTTCCTTACC 3’,下游:5’ GGCTCCTTCCTCCTTTCC 3’(扩增片段为77bp);PPAR引物:上游:5’ AATGCCCGTGAAGA3’,下游:5’ AAGCGATAGGACAAACT3’(扩增片段为89 bp);GAPDH引物:上游:5’ CATC ATCCCTGCCTCCAC 3’,下游:5’ TGCCTGCTT CACCACCTT 3’(扩增片段为181bp),均由北京千汇博联生物科技有限公司合成。
3.主要实验仪器 实时定量PCR仪(Rotor-Gene RG-3000,德国QIAGEN),微量恒温器(绍兴市卫星医疗设备制造有限公司HW - 8C),OLYMPUS-BX40生物显微镜(BX40,日本奥林巴斯公司),HMIAS-2000高清晰度彩色病理图像分析系统(武汉同济医科大学千屏影像工程公司)。
4.方法
(1)模型制备 动物模型:同第三章第一节。自第8周开始给药,给药16周后(第24周),用3%戊巴比妥钠(30mg/mL/kg)麻醉,将动物固定于手术台,在无菌条件下获取主动脉,生理盐水冲洗后,置于组织冻存管,液氮保存备用,余新鲜组织置于-80℃冰箱保存。(见图3-9)
图3-9 动脉粥样硬化家兔模型建立示意图
注:Ii为免疫损伤时间点;Bi为球囊拉伤时间点;*为采血时间点。
(2)分组与给药 所有动物适应性喂养1周后,随机分成正常组8只、实验组48只。自第8周时,实验组随机分为模型组、模型+补肾软坚组、模型+辛伐他汀组,以下简称正常组(Normal Group,NOR)、模型组(Cholesterol Group,CHOL)、补肾软坚组(BSKSH Group,BSKS)、辛伐他汀组(Simvastatin Group,SIMVA);实验兔每日药物剂量按等效临床剂量和体表面积公式计算得出:辛伐他汀5mg/kg,每日1次;补肾软坚方药1g/kg,每日2次,每克以蒸馏水5mL溶解饲喂。正常组同时饲喂等剂量蒸馏水。
(3)病理标本的留取及检测 24周末取材,用3%戊巴比妥钠(30mg/mL/kg)麻醉后将动物固定于手术台,取出主动脉血管组织,沿纵轴用眼科剪剪开,用生理盐水轻轻冲洗后置于10%中性福尔马林固定;然后以主动脉弓、胸主动脉、腹主动脉改刀,石蜡包埋,切片,每个部位切3张片子,HE染色,光镜观察病理改变,各组选10张片子进行图像分析。
(4)免疫荧光技术检测HO-1蛋白水平 石蜡切片经过热修复后,羊HO-1多克隆抗体(1:1000)4℃孵育过夜;0.01 mol/L PBS漂洗3次后,FITC-IgG标记的驴抗羊二抗(1:800)室温下孵育4h,封片。用不加一抗、只有二抗和Hoechst孵育的切片作为阴性对照。在Olympus BX51荧光显微镜下观察免疫组化结果,并使用Olympus DP70数码相机采图,用Image-Pro Plusv 6.0图像软件分析结果。
(5)血清学指标检测 各组分别于给药前、给药后8周、12周、16周采血,采血前禁食12h,然后经耳缘静脉抽取空腹血3mL,静置1h后3000r/min离心10min,取血清-80℃冻存待用。HbCO、cGMP、COX-2采用ELISA方法检测,步骤严格按照说明书进行。
(6)荧光实时定量PCR法检测 每个标本均进行HO-1 mRNA和内参GAPDH基因的荧光定量PCR。总反应体积10μL,反应体系为:5μL SYBR GreenMix-Plus,上下游引物各0.5μL(10pmol/μL),2μL cDNA,加ddH2O至反应总体积10μL。反应条件:95℃,5min;95℃,30s;59℃,30s。共进行40个循环,57℃~96℃绘制熔解曲线。
5.统计学方法 利用比较CT法计算各样本mRNA的表达情况,依据公式ΔCt =Ct目的基因-Ct内参基因,分别计算各组的ΔCt值,各样本mRNA的相对表达量,以2-ΔCt、2-ΔΔCt表示各组间的相对表达率,其中ΔΔCt=ΔCt目的基因-ΔCt校正样本基因。数据统计采用PASW Statistics 18.0统计软件,计量资料以s表示,多组间比较采用One-way ANOVA检验,显著性水平为P<0.05,非显著性水平为P<0.01。
(二)结果
1.病理形态学观察 正常组主动脉内皮细胞完整,单层紧贴内弹力板,中层平滑肌细胞排列整齐,呈长椭圆形。模型组主动脉见有典型粥样斑块形成,斑块表面有纤维组织覆盖,形成典型的“纤维帽”,且纤维帽较薄;内膜明显增厚,内皮部分脱落、不完整,内皮下见脂质浸润,脂核面积大,大量泡沫细胞及炎性细胞浸润,中膜平滑肌增殖并迁移于内膜,弹力板不连续,弹力纤维断裂溶解,有大量胶原纤维生成。辛伐组内膜增厚,有少量泡沫细胞形成,内皮完整,中膜平滑肌增殖,部分向内膜移行,弹力板尚完整。补肾软坚组内膜增厚,可见若干泡沫细胞,内皮完整,中膜平滑肌增殖,排列尚规则。(见附录,图3-10)
2.家兔主动脉HO-1荧光面积比较 对照组血管壁见少量HO-1阳性表达;模型组血管外膜成纤维细胞、平滑肌细胞及斑块边缘有大量绿色荧光区域,在胞质内也有少量荧光阳性表达;补肾软坚组和辛伐他汀组绿色荧光区域均明显增加。(见附录,图3-11)
3.各组HbCO、cGMP、COX-2水平比较 与正常组比较,模型组cGMP水平在给药前、给药后第8、12、16周均明显降低,在补肾软坚方药干预8周后,cGMP水平逐渐升高,补肾软坚组和辛伐他汀组在第12、16周时,与正常组同期比较,差异有显著性(P<0.05,P<0.01);模型组在给药前、第8周,COX-2活性高于同期正常组(P<0.05),但在第12、16周时,各组均没有明显差异(P>0.05);补肾软坚组、辛伐他汀组第8、12、16周时,与同期模型组比较,HbCO水平明显低于模型组(P<0.01)。(见图3-12)
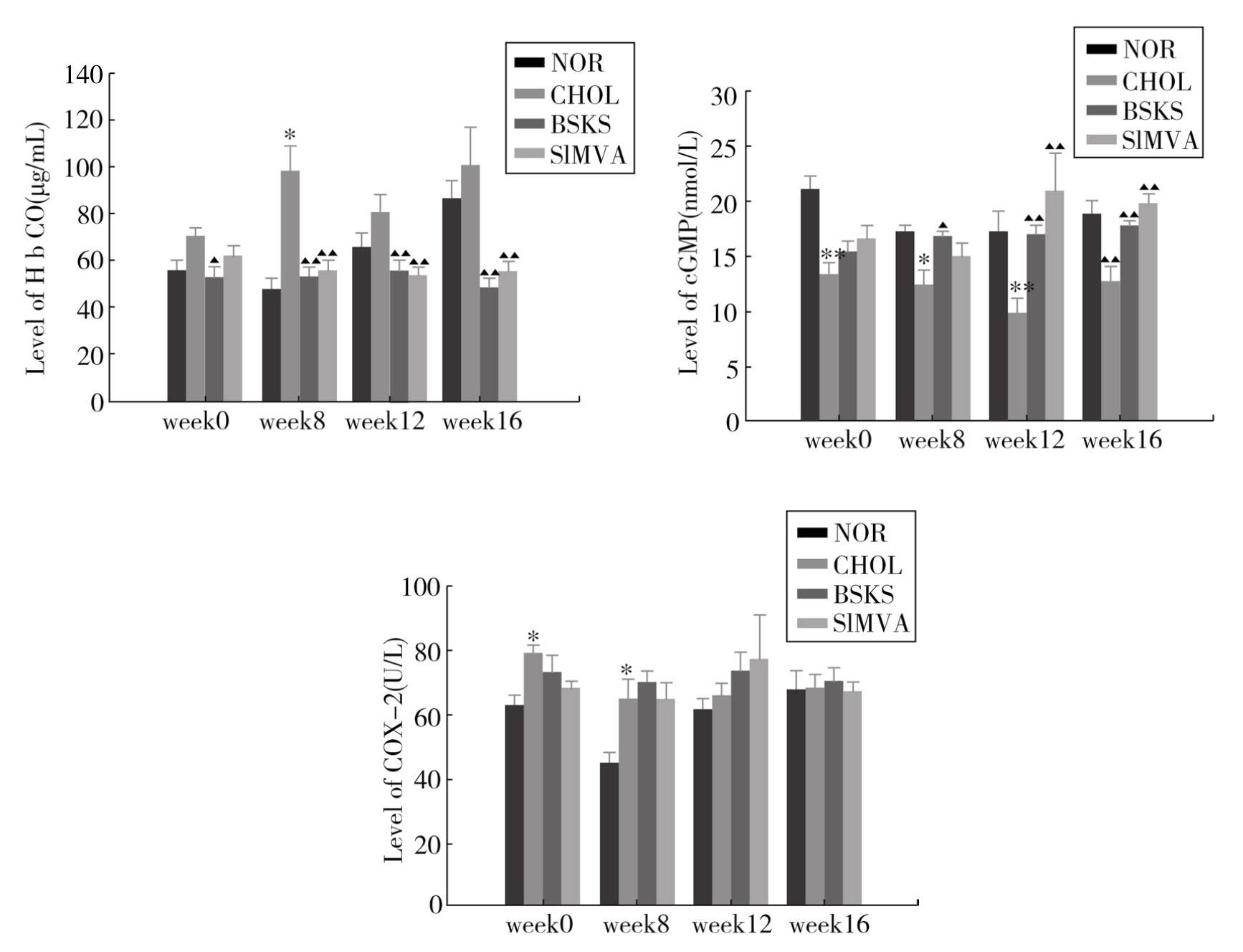
图3-12 各组主动脉HbCO、cGMP、COX-2水平比较
注:各组家兔给药前(week0),给药后第8周(week8)、12周(week12)、16周(week16)时cGMP、HbCO水平及COX-2酶活力。
NOR:正常组;CHOL:模型组;BSKS:补肾软坚组;SIMVA:辛伐他汀组。与正常组比较,*P<0.05,**P<0.01;与模型组比较,▲P<0.05,▲▲P<0.01。
4.家兔主动脉HO-1 mRNA与PPARα mRNA基因表达 家兔正常组主动脉HO-1 mRNA基因在仅有少量表达,模型组HO-1 mRNA表达增加,经补肾软坚方药干预后HO-1 mRNA表达明显升高,差异具有显著的统计学意义(P<0.05),辛伐他汀也有类似于补肾软坚方药的抗氧化效应;PPARα mRNA各组之间没有显著的统计学意义,但家兔动脉粥样硬化病变后,PPARα mRNA水平升高,而经补肾软坚方药与辛伐他汀片干预后,均有下降的趋势。(见图3-13)
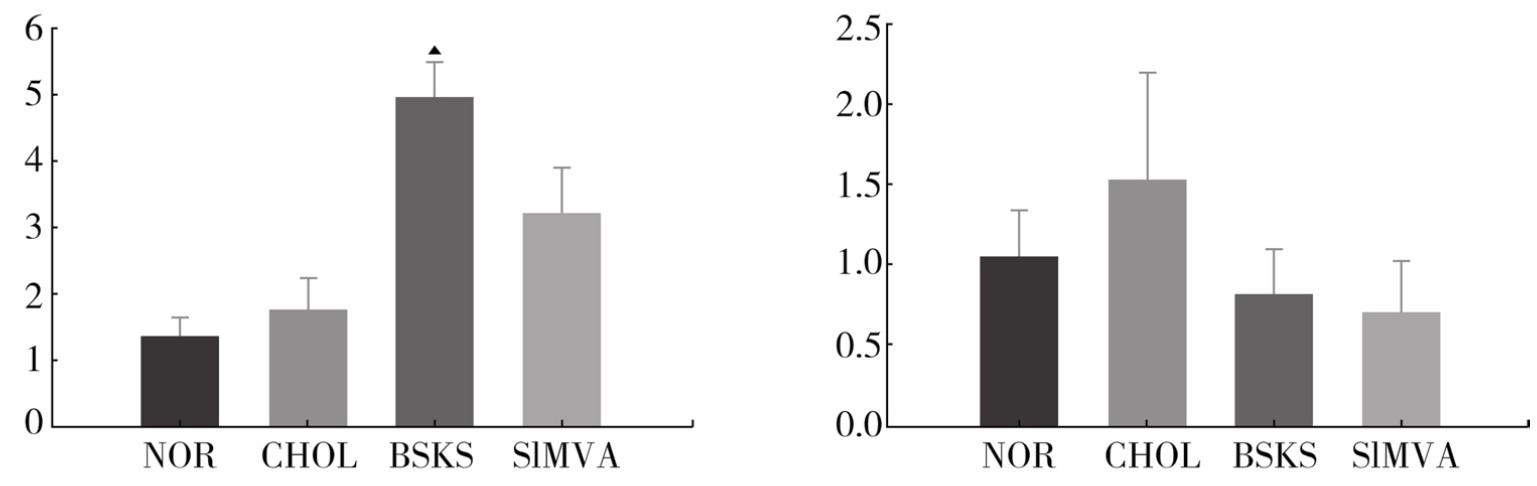
图3-13 家兔主动脉HO-1 mRNA与PPARα mRNA基因表达水平比较
注:补肾软坚方药组(BSKS),辛伐他汀组(SIMVA)。与模型组比较,▲P<0.05;与正常组比较,*P<0.05。
(三)讨论
血红素氧合酶(HO)是热休克蛋白家族中的一个成员,是一种体内广泛存在的抗氧化防御酶,HO-1是HO的一种同工酶。HO-1分解产物的抗氧化和细胞保护作用及其本身的可诱导性,使得HO-1具有独特的抗氧化生理特性,并在AS的防治中起到重要作用。
前期研究显示,补肾软坚方药在动脉粥样硬化所致脑损伤中具有重要的抗氧化作用。本次研究发现,家兔正常组主动脉HO-1 mRNA基因仅有少量表达,模型组HO-1 mRNA表达增加,经补肾软坚方药干预后HO-1 mRNA表达明显升高。研究提示,补肾软坚方药可能含有类似HO-1诱导剂的成分,能诱导HO-1在体内的表达增高,加速血红素的分解代谢,减轻血红素的细胞毒性作用,使CO和胆红素的生成增多,有效缓解氧化应激对机体的损伤,抑制AS的形成和发展。
HO-1抑制炎性细胞因子和化学因子的分泌主要是通过CO的作用实现的,CO主要通过间接介导cGMP生成增多发挥抗氧化、保护血管内皮细胞及心肌细胞作用。本研究结果显示,模型组动物HbCO水平明显升高,经补肾软坚方药干预后,HbCO水平明显下降,而cGMP水平显著升高,可能是由于补肾软坚方药促进CO介导cGMP生成增多,增加细胞内cGMP浓度,减少了内皮细胞的过氧化损伤。有研究表明,COX-2的选择性抑制剂NS-398促进了经炎症刺激后血管内皮细胞中HO-1 mRNA的表达,有效减少内皮细胞的应激损伤。本研究发现,家兔经高脂饲喂、球囊拉伤及免疫损伤后,机体处于应激状态,COX-2活性明显升高,补肾软坚方药干预后COX-2活性有降低的趋势,但与同期对照组比较,差异没有显著性;同时,免疫组织化学法发现,模型组血管壁有大量MMP-9棕黄色阳性区域,而补肾软坚方药组和辛伐他汀组内皮细胞和平滑肌细胞仅有少量棕黄色阳性沉淀物。
补肾软坚方药和辛伐他汀均可提高机体的抗氧化能力,延缓动脉粥样硬化发生、发展。本次研究也提示补肾软坚方药通过激活HO-1/CO-cGMP路径中关键因子的表达是其抗氧化应激作用的机理,也是其抗AS的机制之一。
