补肾软坚方药从PPARγ/NF-κB信号通路调控巨噬细胞极化的机制
AS是冠心病的病理基础,阮士怡教授在“益肾健脾、软坚散结”法干预AS的基础上研制了补肾软坚方药,前期实验表明补肾软坚方药可通过抗脂质过氧化、抑制炎症反应、保护血管内皮等机制抗AS。本部分主要探讨补肾软坚方药是否通过调控巨噬细胞极化发挥抗AS的作用,为AS的治疗提供新的靶点,为补肾软坚方药的临床疗效提供新的机制。补肾软坚方药抑制M1型巨噬细胞极化,促进M2型巨噬细胞极化,并抑制促炎的细胞因子TNF-α分泌,促进抗炎细胞因子IL-10的分泌,其起效的机制是什么?本部分进一步探讨补肾软坚方药调控巨噬细胞极化的机制。
(一)材料与方法
1.细胞株 小鼠RAW264.7巨噬细胞株购自国家实验细胞资源共享平台(China Infrastrcture of Cell Line Resource)。
2.主要试剂 凯基核蛋白提取试剂盒、BCA蛋白定量试剂盒、4×SDS-Loading Buffer(含 DTT)、0.45μm PVDF膜、彩色预染高分子蛋白质分子量标准、兔抗β-actin多克隆抗体、兔抗PCNA多克隆抗体、兔抗PPARγ多克隆抗体、兔抗NF-κB p65单克隆抗体、兔抗IKBα单克隆抗体、HRP-goat anti-rabbit IgG、ECL发光试剂盒。
3.方法
(1)RAW264.7细胞的体外培养 同第四章第六节。
(2)药物干预及分组 配制LPS,制备补肾软坚方药含药血清,GW9662备用。分组为:正常对照组;LPS模型组;LPS+补肾软坚方药干预组、LPS+补肾软坚方药+PPARγ抑制剂GW9662干预组(以下依次简称为对照组、模型组、补肾软坚组和GW9662组)。分别予药物干预。
(3)细胞核蛋白提取 各组细胞加药干预12h后收集细胞,4℃ 500g离心3min,弃去培养液,预冷的PBS洗涤2遍;弃去上清液,估测细胞压积。按细胞压积:BufferA=1∶1.5,加入预冷的Buffer A(使用前每毫升Buffer A 加入1μL DTT,5μL 100m MPMSF,1μL蛋白酶抑制剂),最大转速涡旋震荡15s,放置冰上10~15min;加入总体积的1/20体积的Buffer B,快速震荡混匀,放置冰上1min后,4℃16000rpm,离心5min。收集上清液至新的离心管中,即为胞浆蛋白。在离心沉淀物(细胞核)中加入100μL预冷的Buffer C(使用前每毫升Buffer C加入1μL DTT,5μL 100m MPMSF,1μL蛋白酶抑制剂),最大转速涡旋震荡15s,放置冰上30min,每隔10min涡旋剧烈震荡15s;4℃16000rpm,离心10min,尽快将上清液转入预冷的洁净微量离心管,即得核蛋白;上述提取的胞浆蛋白和核蛋白进行蛋白定量。
(4)Western blotting检测相关蛋白 将提取的胞浆蛋白和核蛋白做BCA蛋白定量及SDS-PAGE电泳实验,得各组细胞IKBα、NF-κB、PPARγ的蛋白条带。
4.统计学方法 用Image-Pro Plus 6.0软件计算各组蛋白条带的灰度值。标准化蛋白相对表达倍数值=(实验组目的蛋白条带灰度值÷该组内参蛋白条带灰度值)÷(对照组目的蛋白条带灰度值÷对照组内参蛋白条带灰度值)。将各次实验计算得出的标准化蛋白相对表达倍数值用SPSS 17.0软件进行分析,数据以均数±标准差(x±s)表示,组间比较采用单因素方差分析,以P<0.05为差异有显著性。
(二)结果
1.补肾软坚方药对LPS诱导的巨噬细胞质蛋白IKBα表达的影响 同对照组相比,模型组浆蛋白IKBα表达明显升高,差异有显著性(P<0.05)。同模型组相比,补肾软坚组抑制IKBα的表达,差异有显著性(P<0.05)。与补肾软坚组相比,GW9662组上调IKBα的表达,差异有显著性(P<0.05)。(见图4-23)
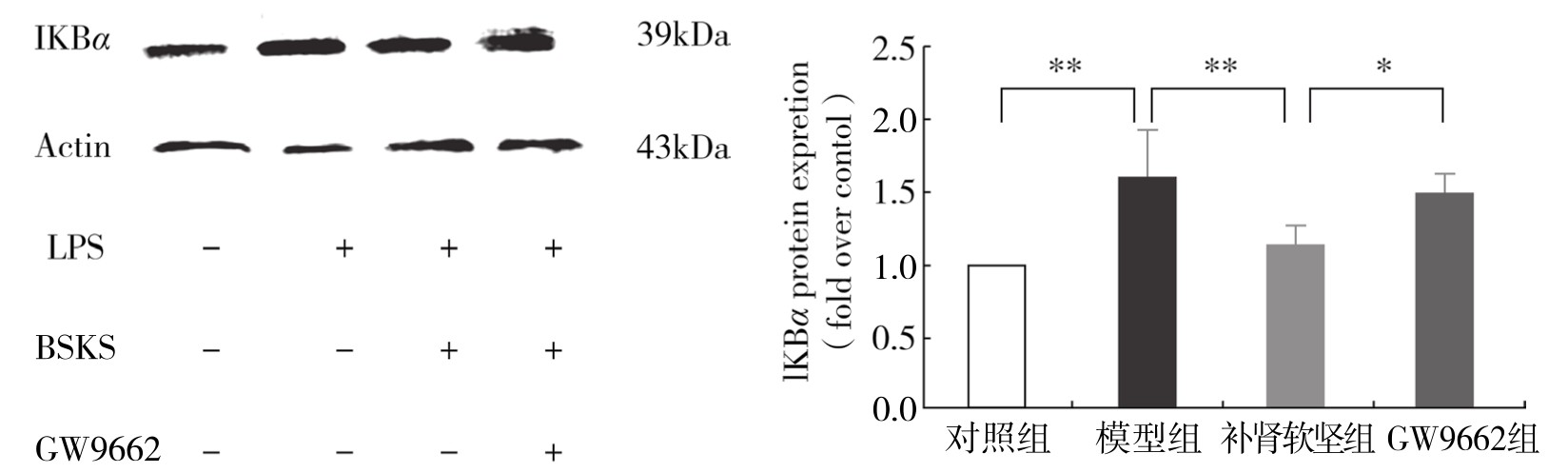
图4-23 不同组处理 RAW264.7 IKB-α蛋白相对表达量
注:*P<0.05;**P<0.01。
2.补肾软坚方药对LPS诱导的巨噬细胞核蛋白 NF-κB 表达的影响 同对照组相比,模型组浆蛋白核蛋白NF-κB表达明显升高,差异有显著性(P<0.05)。同模型组相比,补肾软坚组抑制NF-κB的表达,差异有显著性(P<0.05)。与补肾软坚组相比,GW9662组上调NF-κB的表达,差异有显著性(P<0.05)。(见图4-24)
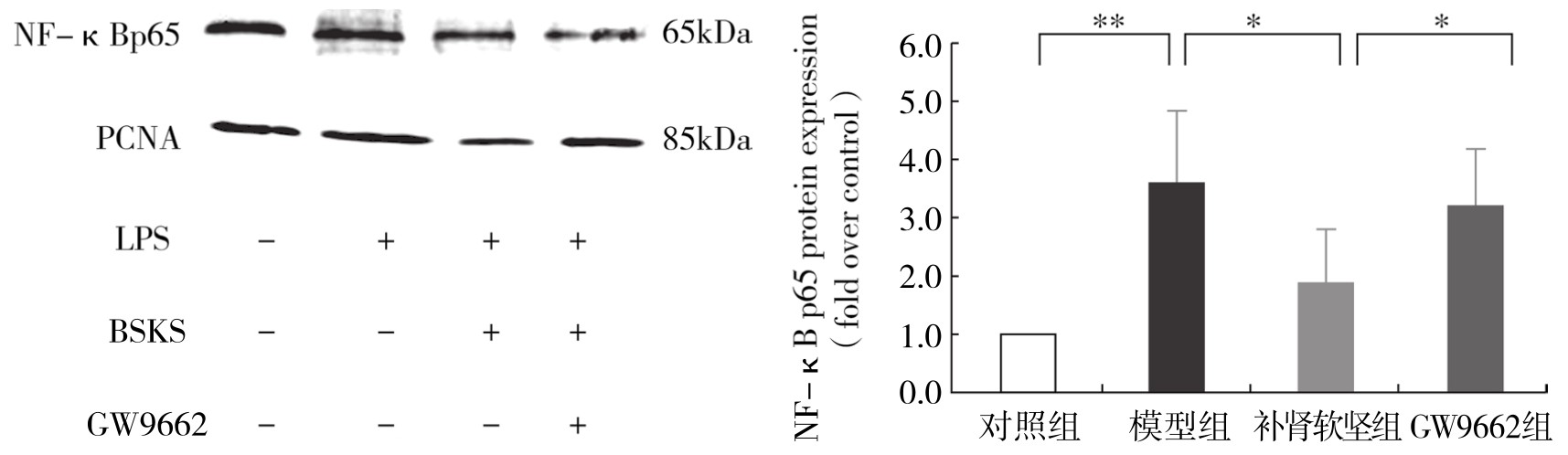
图4-24 不同组处理 RAW264.7 NF-κB 蛋白相对表达量
注:*P<0.05;**P<0.01。
3.补肾软坚方药对巨噬细胞核蛋白PPARγ表达的影响 同对照组相比,模型组核蛋白PPARγ表达升高,差异无显著性(P>0.05)。与模型组相比,补肾软坚组核蛋白PPARγ的表达显著升高,差异有显著性(P<0.05)。与补肾软坚组相比,GW9662抑制核蛋白PPARγ的表达,差异有显著性(P<0.05)。(见图4-25)
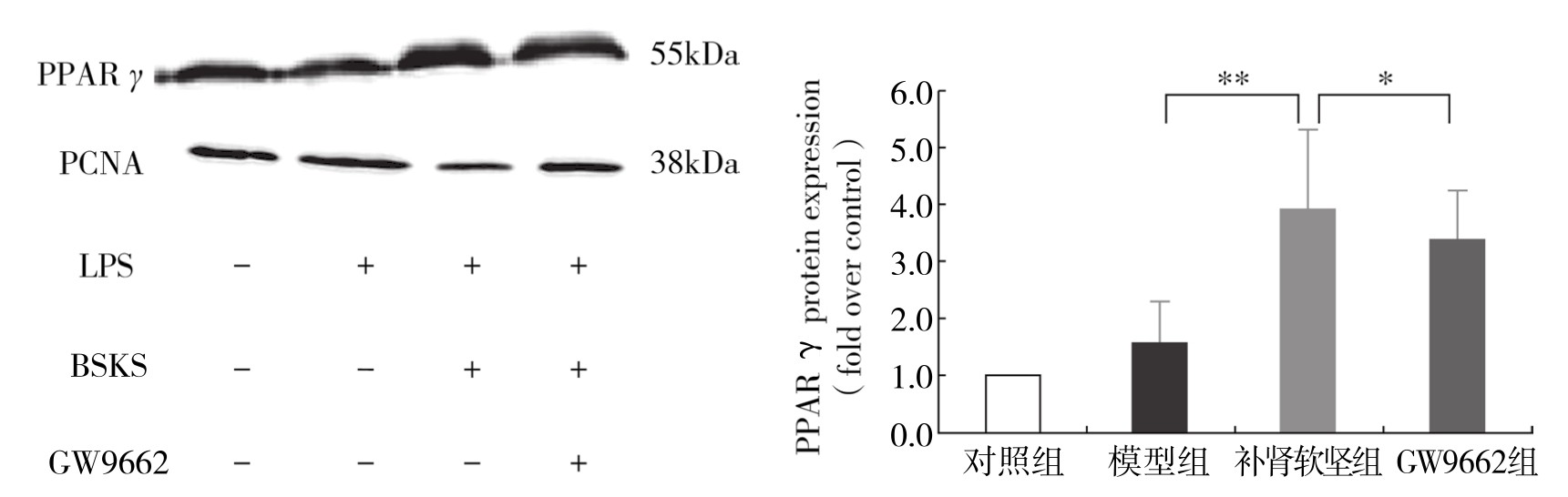
图4-25 不同组处理 RAW264.7 PPARγ蛋白相对表达量
注:*P<0.05;**P<0.01。
(三)结论
AS多见于中老年患者,阮士怡教授认为肾为先天之本,肾气不足则精不能化气,气不能化精,血运不畅,脏腑功能紊乱,可产生血瘀、痰浊等致病因素,形成痰瘀互结之证,故认为脾肾亏虚、痰瘀互结为AS主要病机。针对AS的病因病机特点,阮士怡教授提出脾肾为AS发生发展的关键,治疗以“益肾健脾、软坚散结”为基本法则,“益肾健脾”提高人体的正气,以治其本;“软坚散结”行气化痰活血,以治其标。而且在“益肾健脾、软坚散结”治法基础上,研制出了中药制剂补肾软坚方药。
AS作为一种慢性炎症性疾病,多种免疫细胞参与了该病理过程的进展。其中,巨噬细胞为最具代表性的炎症细胞。近年来,在体内AS斑块组织中发现了不同表型的巨噬细胞,即经典激活的Ml亚型和替代活化的M2亚型,二者之间平衡失调造成的炎症状态可能是影响斑块稳定性的一个主要因素。AS整个过程都有M1/M2细胞的参与,M1/M2型巨噬细胞的极性改变是AS过程中炎症调控的关键机制之一。本实验针对M1/M2极化设计相关通路及因子实验。实验结果表明:LPS 1μg/mL刺激巨噬细胞可激活NF-κB信号通路,可导致NF-κB通路相关蛋白浆蛋白IKBα、核蛋白NF-κB表达明显升高。补肾软坚方药抑制浆蛋白IKBα、核蛋白NF-κB的表达,促进核蛋白PPARγ的表达,说明补肾软坚方药可能通过抑制NF-κB通路抑制巨噬细胞M1型极化,激活PPARγ促进巨噬细胞M2型极化。GW9662上调浆蛋白IKBα、核蛋白NF-κB的表达,抑制核蛋白PPARγ的表达,从而消除补肾软坚方药的抗炎作用。说明补肾软坚方药可能通过激活PPAR-γ抑制NF-κB对巨噬细胞的极化产生调节作用。
