补肾软坚方药从IRE1α-TXNIP/NLRP3通路干预动脉粥样硬化小鼠肺免疫反应的研究
动脉粥样硬化(AS)是一种常见疾病,常累及心脑血管而导致严重后果。近年来,越来越多的研究发现肺损伤与AS具有相关性,即肺部炎症反应加重AS发生发展。以慢性阻塞性肺疾病(Chronic Obstructive Pulmonary Disease,COPD)为例,COPD的患者增加了患AS的风险,相关动物实验和临床研究都补充性地显示了系统炎症和氧化应激在联系COPD和AS之间的突出作用,证明慢性系统炎症是连接COPD和AS最重要的结点。本研究以ApoE-/-小鼠喂养高脂饮食建立动脉粥样硬化模型。选取动脉粥样硬化形成过程中的不同时间点,应用补肾软坚方药为干预手段,研究其干预动脉粥样硬化小鼠肺免疫反应的效应,并从ERS介导的炎性体激活途径初步探讨可能的机制,为补肾软坚方药临床用药提供实验依据。
(一)材料与方法
1.实验动物 6周龄雄性C57BL/6J野生型小鼠24只,(23.27±1.31)g;6周龄雄性ApoE-/-小鼠(C57BL/6J背景)96只,(22.63±1.40)g。
2.主要试剂与药品 辛伐他汀片,补肾软坚方药,即用型SABC-POD(兔IgG)试剂盒,兔多抗NLRP3(ab214185),兔多抗TXNIP(ab188865),兔多抗IRE1(ab48187),兔多抗IL-1beta(ab9722),4-苯基丁酸(4-PBA)。
3.方法
(1)分组给药 实验动物1周的普通饮食适应期后,排除饮食异常者。将24只C57BL/6J野生型小鼠作为对照组,96只ApoE-/-小鼠随机分为模型组、补肾软坚组、辛伐他汀组、4-PBA组,每组24只。对照组普通饲料饮食,同时每只小鼠每天灌胃等量蒸馏水。余4组高脂饮食,模型组灌胃等量蒸馏水,辛伐他汀组予辛伐他汀(2.6mg·kg-1·d-1)灌胃给药0.2mL,补肾软坚组予补肾软坚方药(2340 mg·kg-1·d-1)灌胃给药0.2mL,4-PBA组给予4-PBA(500 mg·kg-1·d-1)灌胃给药0.2mL。
(2)取材 各组小鼠于灌胃第4周、8周、12周后分别称体重,摘眼球取血,室温放置30min后,3000r/min离心15min,收集上层血清,于-80℃保存,后固定。心脏灌注取主动脉及右肺,于4℃生理盐水中洗去血液,滤纸吸干,置于中性福尔马林中固定以备动脉及右肺形态学观察。选取第12周小鼠的右肺组织进行石蜡切片及免疫组化检测。
(3)病理学检查 动脉及右肺置于中性福尔马林中固定,常规石蜡包埋,行5μm厚石蜡切片及HE染色。取左肺上叶洗去血液后,OCT包埋,行10μm厚冰冻切片及油红O染色观察肺组织脂质浸润情况。
(4)免疫组化法观察肺组织IRE1、TXNIP、NLRP3、IL-1β蛋白的表达 石蜡切片脱蜡至水,30%H2O2室温10min,PBS洗涤3次,柠檬酸钠热修复,滴加5%BSA封闭液,室温20min,滴加一抗(IRE1按1∶200稀释;TXNIP按1∶200稀释;NLRP3按1∶200稀释;IL-1β按1∶500稀释),4℃过夜,PBS洗涤3次,滴加二抗,滴加辣根过氧化物酶(HRP)羊抗兔IgG-Biotin,室温孵育30min,PBS洗涤,滴加试剂SABC,20min,PBS冲洗,DAB显色,苏木素复染,脱水封片,光镜下观察。
4.统计学方法 免疫组化结果采用Image-Pro Plus 6.0软件进行分析,使用阳性细胞率分析法。计量资料数据均以x±s示,多组间比较采用单因素方差分析(One wayANOVA),各组间两两比较采用q检验。运用IBM SPSS Statistics 22软件进行数据处理,P<0.05为差异有显著性。
(二)结果
1.IRE1α、TXNIP、NLRP3和IL-1β蛋白表达情况 如表3-41所示,与对照组相比,模型组肺组织IRE1α、TXNIP、NLRP3和IL-1β蛋白表达明显增加(P<0.01);辛伐他汀可降低4种蛋白表达水平(P<0.05或P<0.01);补肾软坚方药可降低IRE1α、TXNIP水平(P<0.05);4-PBA可显著降低IRE1α和NLRP3水平(P<0.01)。初步提示补肾软坚方药可能是通过干预IRE1α-TXNIP/NLRP3通路相关分子表达,进而改善AS伴随的肺炎症反应的发生发展。(见附录,图3-75,图3-77,图3-79及图3-81;见图3-76,图3-78,图3-80及图3-82)
表3-41 各组蛋白阳性细胞率情况(%,x±s,n=8)
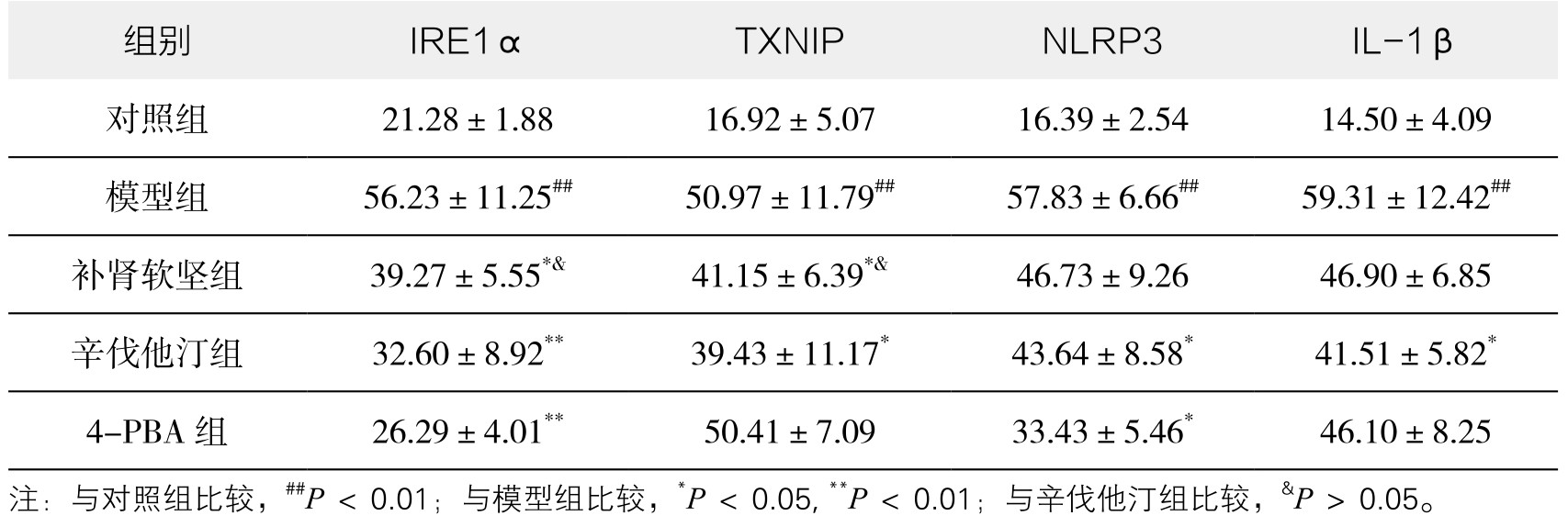
图3-76 各组小鼠肺组织IRE1α蛋白相对表达水平
注:与对照组比较,##P<0.01;与模型组比较,*P<0.05,**P<0.01;与辛伐他汀组比较,&P>0.05。

图3-78 各组小鼠肺组织TXNIP蛋白相对表达水平
注:与对照组比较,##P<0.01 ;与模型组比较,*P<0.05;与辛伐他汀组比较,&P>0.05。
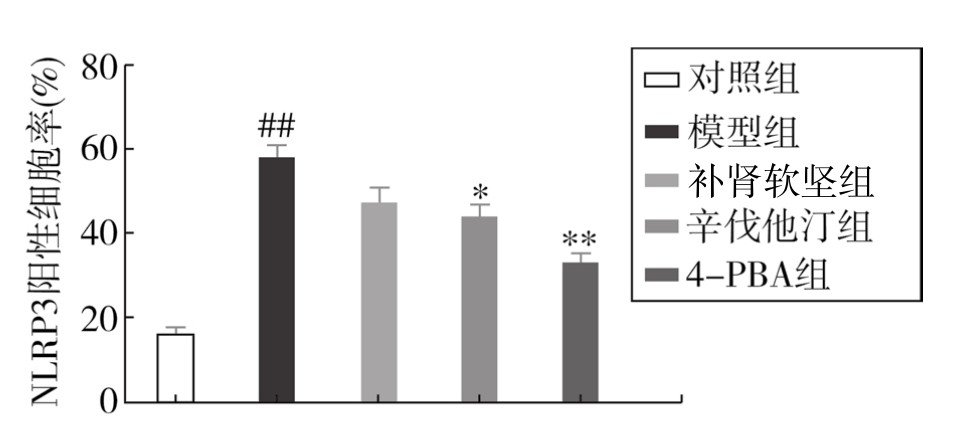
图3-80 各组小鼠肺组织NLRP3蛋白相对表达水平
注:与对照组比较,##P<0.01;与模型组比较,*P<0.05,**P<0.01。
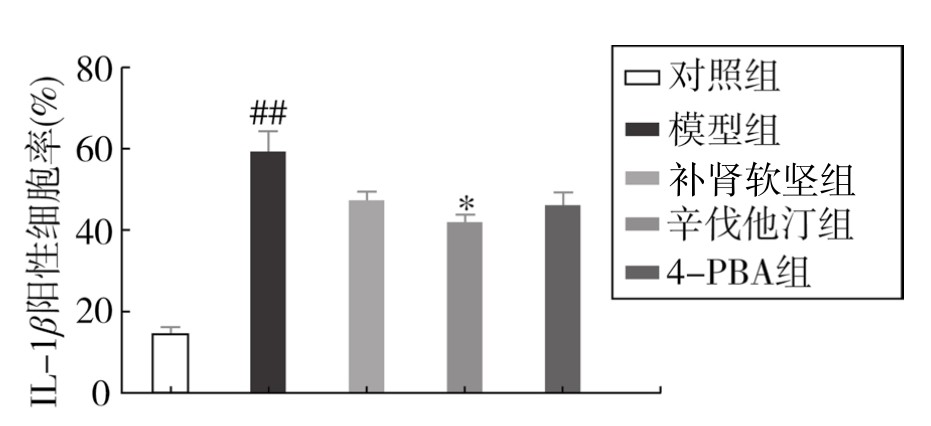
图3-82 各组小鼠肺组织IL-1β蛋白相对表达水平
注:与对照组比较,##P<0.01;与模型组比较,*P<0.05。
2.主动脉及肺组织形态学改变 HE染色可发现,在第4周、8周、12周各时间点与对照组比较,模型组主动脉窦和肺组织病理改变明显,且随着时间的延长病变进一步加重,呈现时间依赖性。补肾软坚方药、辛伐他汀及4-PBA均对病变具有改善作用。油红染色可观察到在第4周、8周、12周各时间点与对照组比较,模型组肺组织有大量脂滴沉积,且随着时间点的增加,脂质蓄积进一步加重。辛伐他汀对病变具有较为明显的改善作用。(见附录,图3-83,图3-84,图3-85)
(三)讨论
TXNIP是将氧化应激和炎症联系起来的重要连接点。在ROS作用下,TXNIP从硫氧还蛋白(Thioredoxin,Trx)解离,并与NLRP3结合,导致NLRP3炎性体活化,引起IL-1β和IL-18的成熟化和释放,其中IL-1β和IL-18在急性肺损伤(ALI)发生发展的过程中具有重要作用。LPS在激活TXNIP和TXNIP/NLRP3的交互作用下诱发肺部氧化应激并产生ROS。有研究显示,TXNIP/NLRP3炎性体激活对于高脂喂养的大鼠内皮细胞炎症和细胞死亡具有重要作用。TXNIP不仅与氧化应激条件下激活炎性体密切相关,而且也是一个连接ERS和炎症的重要分子结点。TXNIP可以被ERS的蛋白激酶样内质网激酶(PKR-like ER kinase,PERK)和IRE1通路诱导,引起IL-1β mRNA转录,激活NLRP3炎性体产生IL-1β,并且调节ERS相关的β细胞死亡,4-PBA作为ERS经典的抑制剂可以有效降低UPR主要传感蛋白IRE1α的表达。此外,研究人员发现ERS诱导产生ROS通过TXNIP激活了NLRP3炎性体,导致IL-1β解离和分泌。总之,多项研究结果提示ERS在炎性体激活中具有影响,且TXNIP在ERS介导的上调和诱导IL-1β成熟化过程中具有重要的作用。Lerner等人发现IRE1α亢进通过减少miR-17水平,增加了TXNIP mRNA稳定性,进而激活NLRP3炎性体,导致caspase-1解离和IL-1β分泌。
研究发现,高脂喂养的ApoE-/-小鼠肺组织会发生明显的ERS反应,其标志物IRE1α表达显著增加,同时TXNIP、NLRP3和IL-1β表达亦显著增加,提示IRE1α-TXNIP/NLRP3信号通路及IL-1β在肺组织中的表达增加可能是AS伴随的肺炎症反应机制。其中补肾软坚方药、辛伐他汀和4-PBA药物干预可以在不同程度上减少上述蛋白的表达,从而缓解炎症反应发生。本研究结果提示补肾软坚方药可以有效降低ERS的传感蛋白IRE1α、连接氧化应激和炎症的重要节点分子TXNIP的表达,并对NLPR3炎性体相关分子蛋白NLRP3及IL-1β具有一定降低作用,这与团队前期研究结果相符合,初步提示补肾软坚方药可以减少ERS过度导致炎性体激活带来的危害。
