补肾软坚方药对动脉粥样硬化家兔海马氧化应激的影响
氧化应激是指活性氧(ROS)的生成速率大于清除速率而在体内蓄积的状态。中医学之“痰证”与活性氧代谢有关,活性氧与体内大分子结合形成过氧化物,过氧化物作为新的致病因素引起人体的广泛损害。补肾软坚方药立法于“健脾益肾、软坚散结”,临床应用广泛,对动脉粥样硬化病变疗效明确,对动脉粥样硬化也具有较好的治疗作用。然而,动脉粥样硬化是全身多系统病变,补肾软坚方药对AS后脑血管的影响研究较少。本研究在成熟的AS模型基础上,探讨补肾软坚方药对兔AS病变后海马组织氧化应激的影响。
(一)材料与方法
1.实验动物 同第三章第三节实验二。
2.药物和试剂 药物:同第三章第三节实验二。Q-PCR试剂盒购自德国QIAGEN公司,批号:204143;SOD、MDA、cGMP等ELISA试剂盒均购自美国Adlitteram Diagnost公司;GSH-PxELISA试剂盒购自美国R&D公司;HO-1引物:上游:5’ TGC CGA GGG TTT TAA GCT GGT 3’,下游:5’ AGA AGG CCA TGT CCA GCT CCA 3’(扩增片段为158bp);Beta-actin 引物:上游:5’ CGC GAC ATC AAG GAG AAG CTG 3’,下游:5’ ATT GCC AAT GGG TGA TAC CTG 3’(扩增片段为129bp),均由上海生工生物技术服务有限公司合成。
3.仪器 实时定量PCR仪(Rotor-Gene RG-3000,德国QIAGEN),微量恒温器(绍兴市卫星医疗设备制造有限公司HW-8C)。
4.方法
(1)实验分组及给药 所有动物适应性喂养1周后,随机分成正常组8只、实验组48只。自第8周时,实验组随机分为模型组、模型+辛伐他汀组、模型+补肾软坚组(以下简称正常组、模型组、辛伐组、补肾组)。各给药组给药后第16周取材。给药量:辛伐他汀5mg/kg,每日1次;补肾软坚方药1g/kg,每日2次。每克以蒸馏水5mL溶解。
(2)造模方法 同第三章第一节。
(3)标本的收集及处理 第24周(即给药后第16周)取材。用3%戊巴比妥钠(30mg/mL/kg)麻醉成功后将动物固定于手术台,20mL注射器心脏取血;无菌条件下,在体获取海马并使用生理盐水冲洗后,置于组织冻存管,液氮保存备用,余新鲜脑组织置于-80℃冰箱保存。
(4)实验指标检测
①苏木精-伊红(HE)染色观察海马病理形态学改变:取新鲜海马组织,-20℃作6μm厚度冰冻切片,做苏木精-伊红(HE)染色。取各组HE染色片于光学显微镜下(400×)观察,摄像。
②酶联免疫吸附试验(ELISA)检测血清SOD、MDA含量:血清作5倍稀释后严格按照说明书加样,置入酶标仪于450nm处测各孔OD值。
③海马组织匀浆氧化酶相关指标测定:取兔海马组织100mg加入匀浆器匀浆,制作10%组织匀浆液;采用ELISA方法检测海马组织SOD、MDA及GSH-Px酶含量。
④血红素氧合酶基因表达的检测(Q-PCR法):每个标本均进行HO-1 mRNA和内参β-actin基因的荧光定量PCR。总反应体积25μL,反应体系为:12.5μL SYBR GreenMix-Plus,上下游引物各0.5μL(10pmol/μL),1μL cDNA,加ddH2O至反应总体积25μL。反应条件:94℃,4min;94℃,20s;56℃,20s;72℃,45s。共进行70个循环,57℃~96℃绘制熔解曲线。
5.统计方法 利用比较Ct法计算各样本mRNA的表达情况,依据公式ΔCt=Ct目的基因-Ct内参基因分别计算各组的ΔCt值,各样本mRNA的相对表达量以2-ΔCt表示,以2-ΔΔCt表示各组间的相对表达率,其中ΔΔCt=ΔCt目的基因-ΔCt校正样本基因。数据统计采用SPSS 11.5统计软件,计量资料以x±s表示,多组间比较采用One-way ANOVA检验,显著性水平为P<0.05,非显著性水平为P<0.01。
(二)结果
1.海马形态学观察 正常组海马组织细胞排列整齐紧密,形态正常,无变性,椎体细胞大而圆,呈均匀的染色,核仁清晰,细胞质丰富。模型组家兔海马椎体细胞排列稀疏紊乱,细胞脱失明显,甚至仅见少量的不规则细胞,细胞核体积变小,深染,呈核固缩。补肾组和辛伐组海马细胞脱失现象减轻,细胞排列较模型组整齐,形态较正常,接近正常组。(见附录,图3-14)
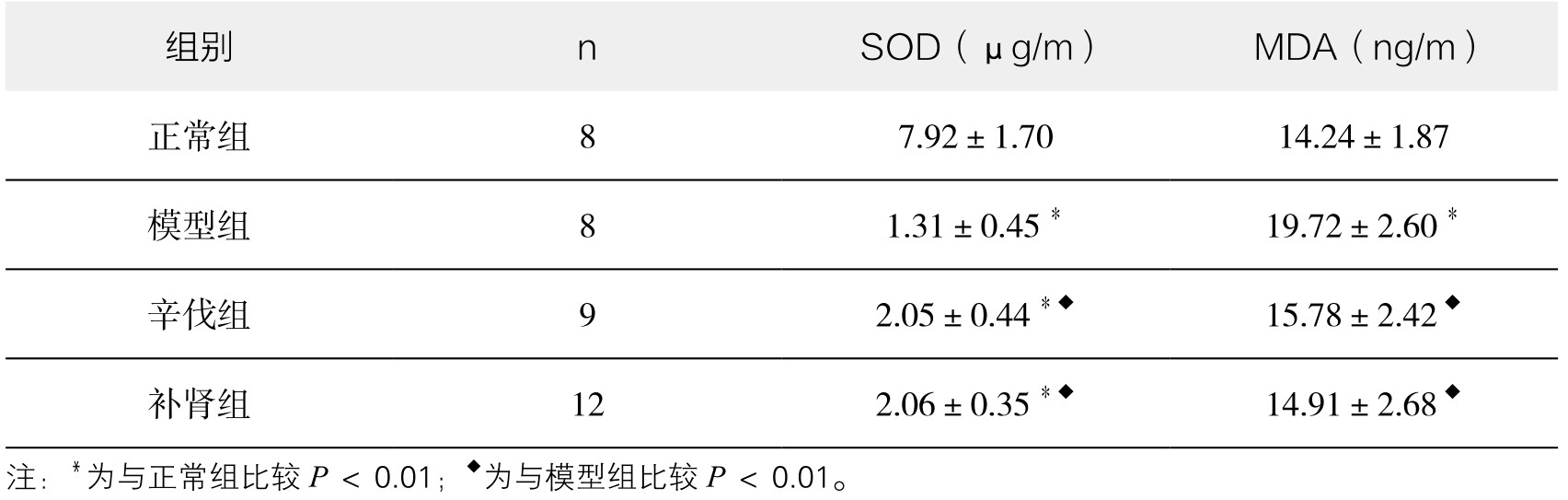
2.补肾软坚方药对血清SOD、MDA表达水平的影响 正常组兔血清SOD活性明显高于模型组和补肾组,经补肾软坚方药干预后血清SOD活性明显增高,与模型组比较差异有显著性(P<0.01);模型组兔血清MDA含量高于对照组,经补肾软坚方药干预后血清MDA含量明显降低,与模型组比较差异有显著性(P<0.01)。(见表3-9)
表3-9 各组血清SOD、MDA水平比较(x±s)
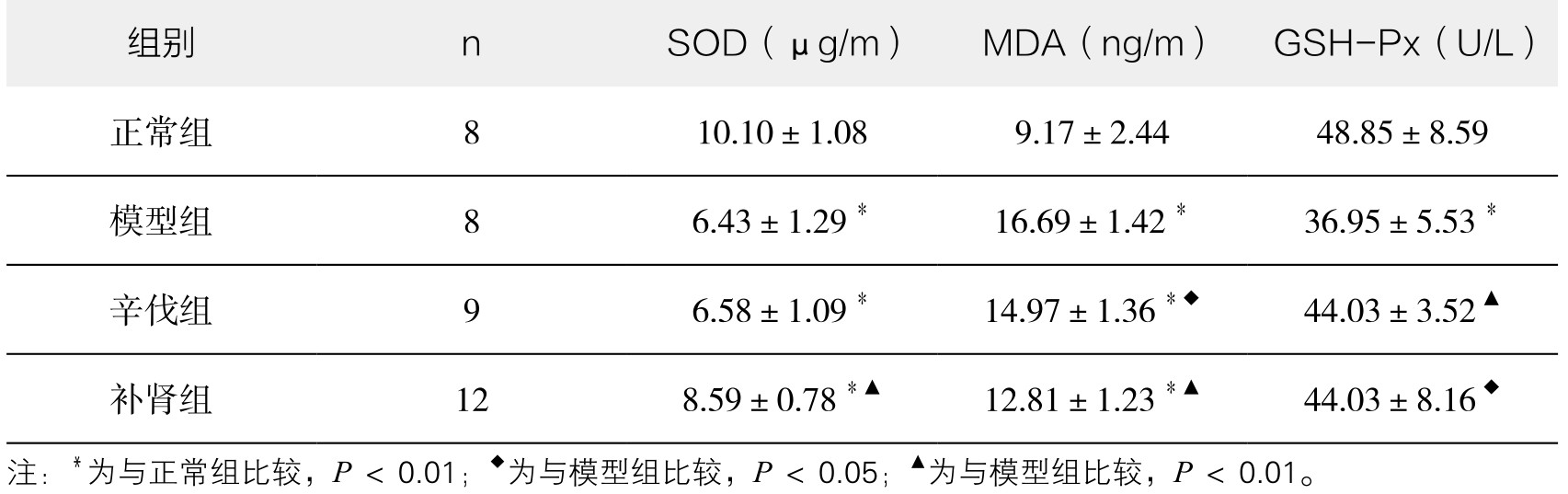
3.补肾软坚方药对海马组织SOD、MDA及GSH-Px水平的影响 模型组海马组织SOD活性显著低于对照组(P<0.01),而MDA含量显著高于对照组(P<0.01);辛伐他汀干预后海马组织SOD、MDA与模型组之间差异无显著性(P>0.05),经补肾软坚方药干预后兔海马组织SOD较模型组明显升高(P<0.05),MDA较模型组明显下降(P<0.01),与正常组相比,模型组海马组织中GSH-Px活性明显下降(P<0.01);经补肾软坚方药干预后GSH-Px活性提高(P<0.05),辛伐组GSH-Px活性明显提高(P<0.01),但补肾组和辛伐组相比差异没有显著性(P>0.05)。(见表3-10)
表3-10 各组海马组织SOD、MDA、GSH-Px水平比较(x±s)
4.补肾软坚方药对HO-1 mRNA的影响 兔海马HO-1 mRNA基因在各组均有表达,与正常组相比,模型组海马HO-1 mRNA表达差异无显著性(P>0.05),但模型组经辛伐他汀和补肾软坚方药干预后,海马HO-1 mRNA表达均明显升高,差异具有显著性(P<0.05)。(见图3-15)
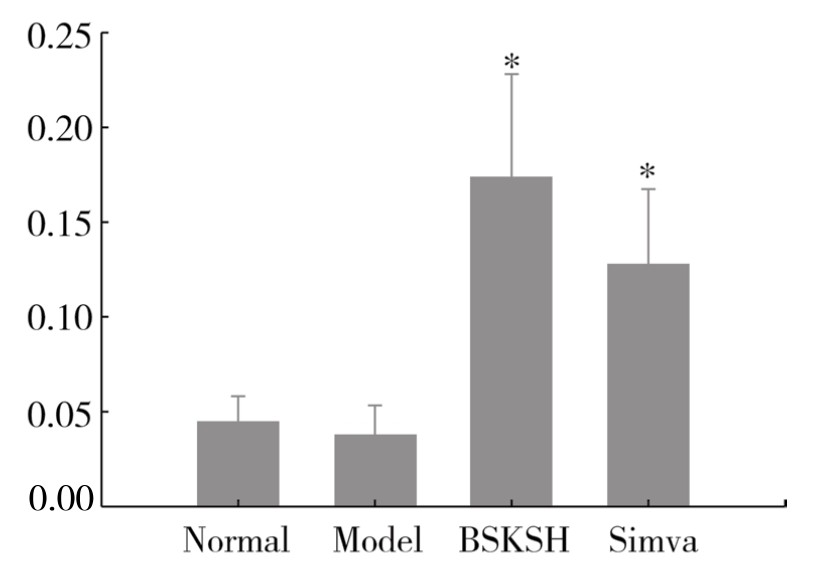
图3-15 海马组织HO-1 mRNA基因的相对表达量
注:Normal:正常组;Model:模型组;BSKSH:补肾组;Simva:辛伐组。与模型组相比,*P<0.05。
(三)讨论
脑组织对缺血缺氧等损伤非常敏感,高胆固醇血症及AS时脑组织处于缺血缺氧状态,且发生了病理形态学改变。HO-1不仅对脑神经具有直接保护作用,而且可以有效抑制脂质过氧化,清除氧自由基,对血管内皮细胞和平滑肌细胞也具有保护作用。已有研究证实,HO-1减轻了氧化应激所致的单核细胞损伤。
本研究以实时荧光定量PCR技术检测HO-1 mRNA基因的表达,结果发现,补肾软坚方药可诱导HO-1 mRNA的表达,但作用机制不明。HO-1是一种抗氧化蛋白,多数情况下由氧化应激或ox-LDL、过氧化氢等氧化剂诱导上调。还原剂姜黄素也可上调HO-1,它通过调控HO-1基因启动子区域的抗氧化效应元件而活化HO-1基因,直接上调HO-1表达水平。补肾软坚方药是否通过对抗氧化效应元件的调控直接从转录水平上升高HO-1表达水平还有待进一步的试验证明。
MDA作为氧自由基和生物膜不饱和脂肪酸发生脂质过氧化反应的代谢产物,其含量的变化可间接反映组织中氧自由基含量的变化,并间接反映细胞损伤的程度。SOD的表达水平可反应机体内抗自由基水平的高低。本研究发现正常组、补肾组兔血清SOD活性明显高于模型组(P<0.01),MDA水平比模型组明显减低(P<0.01),显示补肾软坚方药可促进血清SOD活性,降低MDA的产生,减轻氧化应激、抗脂质过氧化反应,从而保护血管内皮细胞功能,这可能是补肾软坚方药减轻动脉粥样硬化症状的机制之一。研究同样发现,模型组海马组织SOD活性表达显著低于对照组(P<0.01),而MDA表达显著高于对照组(P<0.01);辛伐他汀干预后海马组织SOD与模型组之间差异无显著性(P>0.05),但是经补肾软坚方药干预后的兔海马组织SOD较模型组明显升高(P<0.05),MDA较模型组明显下降(P<0.01)。已有实验证明,在球囊损伤的兔髂动脉局部注射SOD或过氧化氢酶基因,发现活性氧的产生明显减少,同时发现炎症细胞浸润下降,胶原合成减少,再狭窄明显减轻。
GSH-Px是机体抗氧化酶系统的一种酶,在细胞质中直接参与清除H2O2,减少羟自由基的产生,也可使脂质过氧化物分解从而减轻其毒性。本实验结果显示,与正常组相比,模型组海马组织中GSH-Px活性明显下降(P<0.01);经补肾软坚方药干预治疗后GSH-Px活性明显提高(P<0.05),辛伐组GSH-Px活性亦明显提高(P<0.01),但补肾组和辛伐组相比差异没有显著性。结果表明,补肾软坚方药可能通过抑制脂质过氧化反应、保护酶活性,降低MDA含量,进而达到保护动脉粥样硬化实验兔海马组织的作用,并从另一个侧面验证了MDA、SOD含量及GSH-Px活性的改变在动脉粥样硬化发病中的作用。
本实验结果显示,补肾软坚方药在动脉粥样硬化所致脑损伤中具有重要的抗氧化作用。其保护机制可能是通过调控HO-1 mRNA基因的表达,以及上调SOD、GSH-Px酶的活性,同时清除脂质氧化终产物MDA而实现的。
