补肾软坚方药单体TSG调控ERS-自噬途径干预血管内皮细胞凋亡的机制研究
血管内皮细胞的损伤及功能障碍是AS最早期的事件及发病的始动环节,维护血管内皮结构和功能的完整性对防治AS性疾病具有重要的意义。研究发现,在条件性敲除内皮细胞XBP1基因的小鼠的动脉血管中,自噬基因LC3β的表达低于基础水平。p-IRE1α激活的XBP1(s)mRNA与自噬基因Beclin1启动子在核苷酸-537~-755区域结合,通过Beclin1的转录调控诱导自噬小泡的形成,介导LC3β活化,触发自噬信号通路,进而根据自噬程度决定细胞生存或凋亡,影响AS进程。
既往研究已证实补肾软坚方药治疗AS性疾病疗效肯定,可以通过调节氧化应激和炎症反应来防治AS性疾病,其有效单体TSG能够通过保护血管内皮细胞来预防和保护AS发生发展。本实验观察TSG对Hcy诱导的内皮细胞凋亡及细胞凋亡率的影响,以及TSG对Hcy损伤内皮细胞IRE1-XBP1自噬途径中自噬小泡形成和GRP78、p-IRE1α、XBP1s、Beclin1、LC3β蛋白表达的影响。探讨TSG抗Hcy诱导内皮细胞凋亡的可能作用途径及相关调控机制,为AS的防治提供新的策略和治疗靶点。
(一)材料与方法
1.细胞株 EA.hy926人脐静脉细胞融合细胞株。
2.主要试剂和药品 胎牛血清(FBS)、噻唑蓝(MTT)、Hoechst33342/PI细胞凋亡与坏死检测试剂盒、Annexin V-FITC/PI细胞凋亡检测试剂盒、BCA法蛋白质浓度测定试剂盒、4×SDS蛋白上样缓冲液(含DTT)、彩色预染高分子蛋白质分子量标准品、ECL化学发光试剂盒、GRP78/BIP抗体(ab21685)、CHOP抗体(#2895)、beta-Actin抗体(bs-0061R)、羊抗兔IgG/HRP、p-IRE1α抗体(ab48187)、XBP1s抗体(#12782)、Beclin1抗体(ab21685)、LC3β抗体(L7543)、羊抗兔IgG/FITC、单丹磺酰尸胺(Mono dansyl cadaverine,MDC)、抗荧光衰减封片剂。
3.方法
(1)细胞培养 同第四章第四节。
(2)细胞分组与处理
培养细胞:取对数生长期的血管内皮细胞EA.hy926均匀接种于96孔培养板、24孔培养板、6孔培养板、25cm2培养瓶中。
同步化:待细胞贴壁并生长至融合状态后,弃去旧的培养液,D-hanks润洗2遍,用含0.5%FBS的DMEM培养基培养24h,使细胞周期同步于G0/G1期。
给药:弃去旧的培养液,D-hanks润洗2遍,各组处理方案如下:
①Control组:置换含0.5%FBS的DMEM高糖培养基继续培养48h。
②TSG组:置换含0.5%FBS和100μM TSG的DMEM高糖培养基继续培养48h。
③Hcy组:置换含0.5%FBS的DMEM高糖培养基继续培养24h后,置换含0.5%FBS和500μM Hcy的DMEM高糖培养基培养24h。
④Hcy+TSG组:置换含0.5%FBS和100μM TSG的DMEM高糖培养基培养24h后,根据实验所用培养液含量,加入相应体积Hcy母液令其终浓度为500μM,继续对细胞进行干预24h。
⑤Hcy+4-PBA组:置换含0.5%FBS和1mM 4-PBA的DMEM高糖培养基培养24h后,根据实验所用培养液含量,加入相应体积Hcy母液令其终浓度为500μM,继续对细胞进行干预24h。
(3)MTT比色法检测血管内皮细胞活力 同第四章第九节实验二。
(4)内皮细胞凋亡的形态学观察 同第四章第九节实验二。
(5)流式细胞术测定内皮细胞凋亡率 细胞接种于6孔板,校正组共4组,分别为空白对照组、阳性对照双染组、单染Annexin V-FITC组、单染PI组;实验组共5组,分别为Control组、50μM、100μM、500μM、1mM Hcy组,处理同“方法”(2)。给药干预结束后,同时处理实验组与校正组,离心、染色、进行流式细胞仪检测。
(6)MDC荧光染色检测内皮细胞自噬小泡
①给药干预结束后,弃去96孔培养板中旧的培养液,D-hanks润洗3次,2min/次。
②每孔中加入100μL MDC染色工作液,37℃培养箱中避光培养1.5h;1.5h后终止培养,小心吸弃孔内培养上清液,PBS润洗3次,5min/次。
③4%多聚甲醛室温固定细胞15min,15min后弃去固定液,PBS润洗3次,5min/次。
④将96孔培养板放于倒置荧光显微镜下,观察细胞自噬小泡变化并拍照。
(7)免疫荧光法检测内皮细胞自噬调节蛋白Beclin1的表达 处理细胞爬片、细胞固定、封闭、一抗二抗反应、复染、封片和观察。
(8)Western blotting法检测内皮细胞 ERS相关蛋白GRP78、p-IRE1α、XBP1s和自噬相关蛋白Beclin1、LC3β的表达:提取总蛋白、BCA法测定细胞总蛋白的浓度、SDS-PAGE胶的制备、电泳、凝胶转膜、蛋白质免疫印迹反应、化学发光显影及凝胶图像分析。
4.统计学方法 运用SPSS 17.0对数据进行统计学处理,计量资料数据均用均值±标准差(x±s)表示,多组间比较采用单因素方差分析。
(二)结果
1.TSG对Hcy干预下血管内皮细胞活力的影响 TSG(100μM)组与Control组血管内皮细胞活力相比较,差异无显著性(P>0.05);与Hcy组比较,Hcy+TSG(100μM)组和Hcy+4-PBA(1mM)组能够明显增加血管内皮细胞活力,差异有显著性(P<0.01);而Hcy+TSG(100μM)组与Hcy+4-PBA(1mM)组相比较,提高血管内皮细胞活力的作用相近,差异不显著(P>0.05)。说明100μM TSG可以有效提高Hcy诱导的血管内皮细胞活力下降,其作用不弱于1mM 4-PBA。实验重复3次,结果趋势相同。(见表4-13,图4-55)
表4-13 TSG对Hcy诱导的血管内皮细胞活力的影响(x±s,n=5)
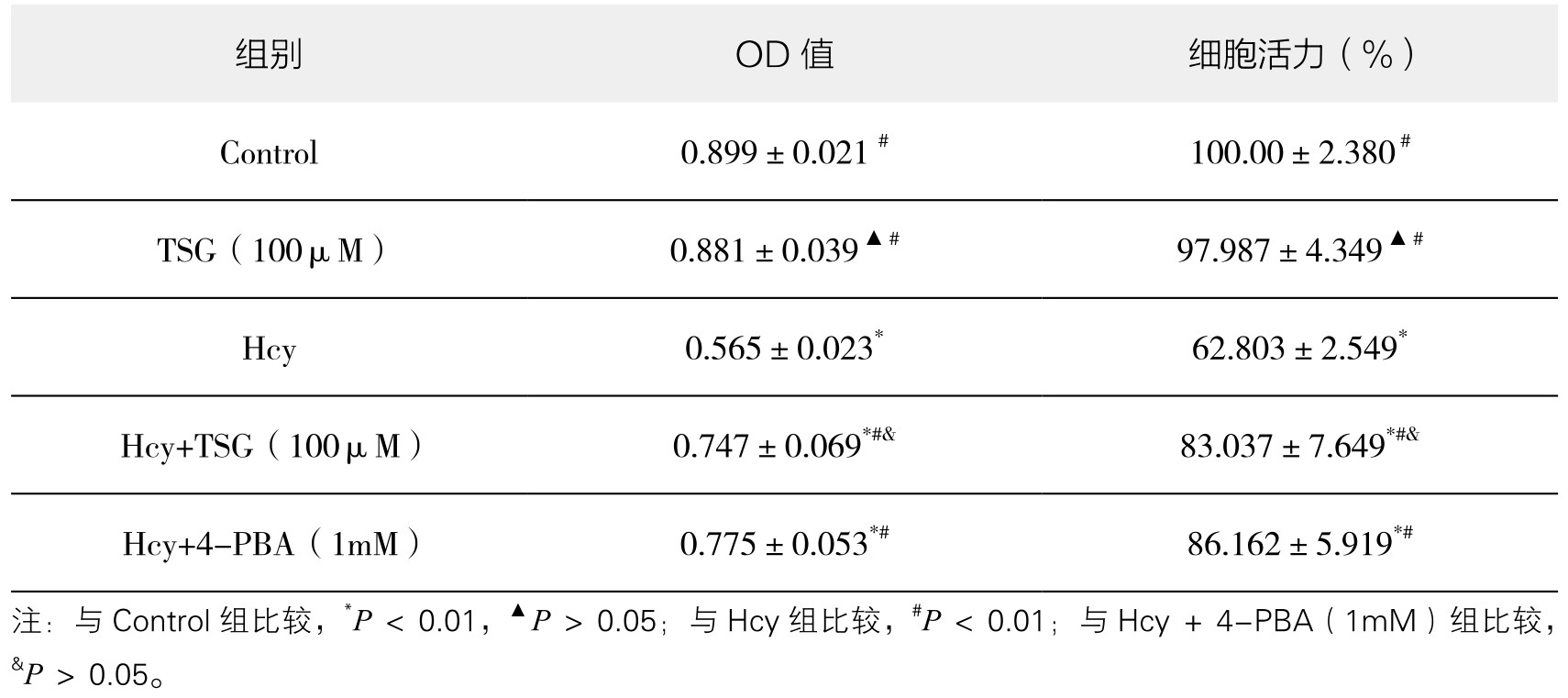
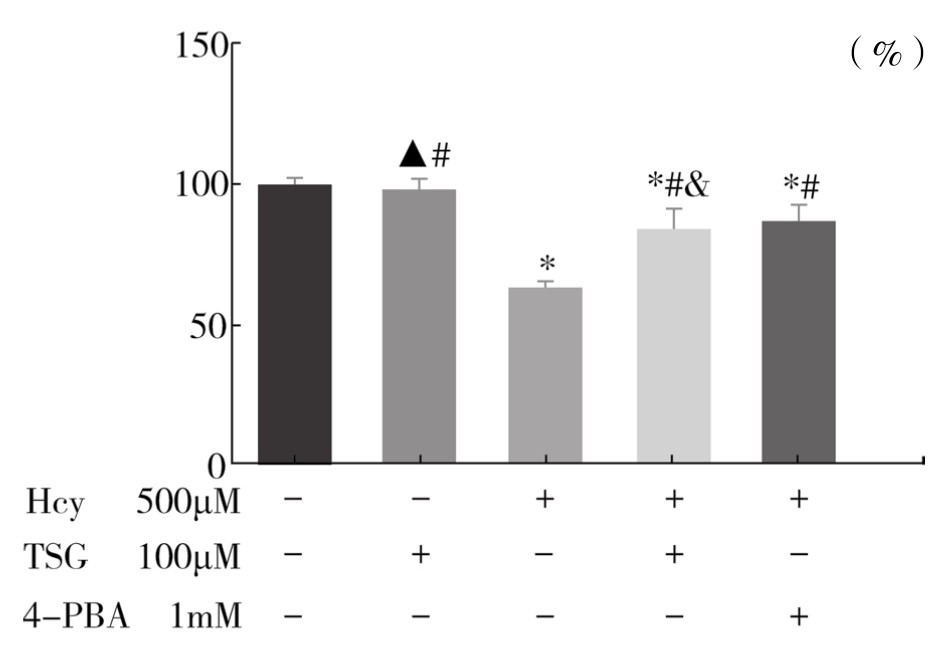
图4-55 TSG对Hcy诱导的血管内皮细胞活力的影响
注:与Control组比较,*P<0.01 ,▲P>0.05;与Hcy组比较,#P<0.01;与Hcy+4-PBA(1mM)组比较,&P>0.05。
2.TSG干预Hcy诱导的血管内皮细胞凋亡的形态学观察
(1)倒置相差显微镜下观察细胞形态 倒置相差显微镜下观察发现(见附录图4-56),与Control组相比,Hcy组细胞贴壁能力降低,细胞间空隙加大,细胞数目明显减少,细胞皱缩变圆并且胞质出现大量空泡和颗粒物。用TSG和4-PBA干预后能够明显改善Hcy造成的细胞形态损伤,细胞数和细胞密度均明显提高,细胞形态趋于规则饱满,胞质中空泡和颗粒物明显减少。提示TSG和4-PBA干预后能明显减轻Hcy诱导的内皮细胞损伤,TSG具有抑制血管内皮细胞损伤的作用。
(2)倒置荧光显微镜下以Hoechst33342/PI染色检测细胞凋亡与坏死 经Hoechst 33342/PI染色后,于倒置荧光显微镜下观察内皮细胞的凋亡情况(见附录图4-57)。用紫外线激发后,Control组的内皮细胞核呈低密度均匀蓝染,细胞核形态规则,核膜完整,而Hcy组中细胞核数目较Control组减少,细胞核出现固缩,呈致密浓染,发出高亮度蓝色荧光,可见凋亡小体。与Hcy组相比,Hcy+TSG组和Hcy+4-PBA组中细胞核数增多,呈低密度均匀蓝染的细胞核比例增加,呈高亮度蓝色致密浓染的细胞核明显减少,提示凋亡细胞减少。用绿色光激发后,Control组少量细胞核呈低密度红色荧光或大量细胞核不被PI着色,而Hcy组中部分细胞核呈现致密浓染的高亮度红色荧光,用TSG和4-PBA干预后,呈高亮度红色荧光的细胞核明显减少,提示坏死细胞减少。表明TSG和4-PBA可以明显减少Hcy诱导的内皮细胞凋亡和坏死,TSG具有抑制内皮细胞凋亡的作用。
3.TSG干预Hcy诱导的血管内皮细胞凋亡率测定 根据流式细胞仪检测结果(见表4-14,附录图4-58,图4-59),与Control组相比,Hcy组细胞存活率明显下降,细胞凋亡率明显增高,差异均具有显著性(P<0.01)。与Hcy组相比,Hcy+TSG(100μM)组和Hcy+4-PBA(1mM)组均能够明显提高细胞存活率,降低细胞早期凋亡率与总死亡率,差异均具有显著性(P<0.01)。而将Hcy+TSG(100μM)组和Hcy+4-PBA(1mM)组对内皮细胞存活率和凋亡率的影响相比较,差异不显著(P>0.05)。实验重复3次,结果趋势相同,提示TSG和4-PBA可以明显下调Hcy诱导的血管内皮细胞凋亡率,TSG具有抑制内皮细胞凋亡的作用,并且作用不弱于4-PBA。
表4-14 TSG对Hcy诱导的血管内皮细胞凋亡率的影响(%,x±s,n=3)


图4-59 TSG对Hcy诱导的血管内皮细胞凋亡率的影响
注:与Control组比较,*P<0.01;与Hcy组比较,#P<0.01;与Hcy+4-PBA 组比较,&P>0.05。
4.TSG对Hcy诱导的血管内皮细胞自噬的影响
(1)倒置荧光显微镜下以MDC染色检测细胞自噬小泡 MDC染色后,使用倒置荧光显微镜观察内皮细胞自噬小泡的情况(见附录图4-60)。通过紫外激发MDC,Control组的内皮细胞中酸性自噬小泡呈现出高亮度蓝绿色荧光,胞质形态规则,而Hcy组中细胞胞浆呈低亮度不均匀蓝绿色。与Hcy组相比,Hcy+TSG组和Hcy+4-PBA组中高亮度均匀蓝绿色荧光增多,提示细胞中自噬小泡增多。
(2)倒置荧光显微镜下观察细胞自噬调节蛋白Beclin1的表达 荧光显微镜下观察内皮细胞胞浆中自噬调节蛋白Beclin1分布变化情况(见附录图4-61)。Beclin蛋白用FITC标记,激发光为蓝色荧光,发射光为绿色荧光。用蓝色荧光激发后,Control组的内皮细胞胞浆呈致密浓染,发出高亮度绿色荧光,胞质形态规则,而Hcy组中细胞胞浆呈低亮度绿染,无完整胞质形态。与Hcy组相比,Hcy+TSG组和Hcy+4-PBA组中规则形态的细胞胞质增多,呈高亮度均匀绿染,呈低亮度绿染的不规则形态胞质明显减少,提示细胞自噬增加。通过紫外激发DAPI来观察细胞核的位置和形态变化,Control组细胞核呈均匀蓝染,而Hcy组中细胞核呈现不均匀的蓝色荧光,提示细胞受损。用TSG和4-PBA干预后,呈高亮度致密蓝染的固缩状细胞核明显减少,提示凋亡细胞减少,表明TSG和4-PBA可以提高受损内皮细胞的自噬水平和抑制细胞凋亡。
5.TSG对Hcy诱导的血管内皮细胞ERS相关蛋白GRP78、p-IRE1α、XBP1s和自噬相关蛋白Beclin1、LC3β表达的影响 如图4-62所示,与Control组比较,Hcy组ERS标志蛋白GRP78表达明显增加;与Hcy组比较,用TSG和4-PBA干预后能够明显减少Hcy诱导的GRP78蛋白表达,差异均具有显著性(P<0.01)。初步表明TSG和4-PBA可以抑制Hcy诱导的ERS发生。
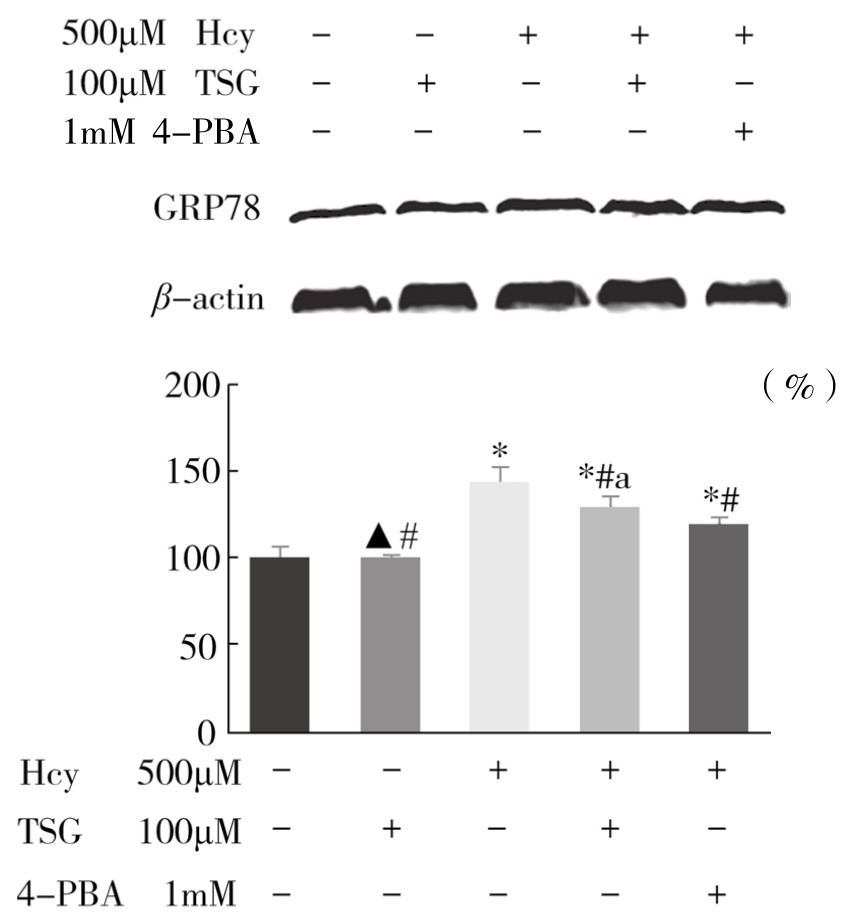
图4-62 TSG对Hcy诱导的血管内皮细胞ERS相关蛋白GRP78相对表达量的影响(x±s,n=3)
注:与Control组比较,*P<0.01,▲P>0.05;与Hcy组比较,#P<0.01;与Hcy+4-PBA(1mM)组比较,aP<0.05。
如图4-63所示,与Control组比较,Hcy组p-IRE1α、XBP1s表达增加,自噬调节蛋白Beclin1表达明显减少,差异具有显著性(P<0.05或P<0.01),与Hcy组比较,TSG和4-PBA干预组能够明显减少p-IRE1α、XBP1s蛋白表达,增加Beclin1蛋白表达,差异具有显著性(P<0.05或P<0.01)。而Hcy+TSG(100μM)组与Hcy+4-PBA(1mM)组相比较,p-IRE1α、XBP1s和Beclin1蛋白表达量相近,差异不显著(P>0.05)。如图4-64所示,与Control组比较,Hcy组自噬蛋白LC3β-II/I相对表达量减少,差异具有显著性(P<0.05)。与Hcy组比较,用TSG和4-PBA干预后能够明显提高LC3β-II/I蛋白相对表达量,差异具有显著性(P<0.01)。实验重复3次,结果趋势相同,表明TSG和4-PBA均可以抑制Hcy诱导的ERS相关蛋白GRP78、p-IRE1α、XBP1s表达,同时促进自噬相关蛋白Beclin1、LC3β-II/I表达,提示TSG可能通过ERS自噬途径抑制血管内皮细胞凋亡。
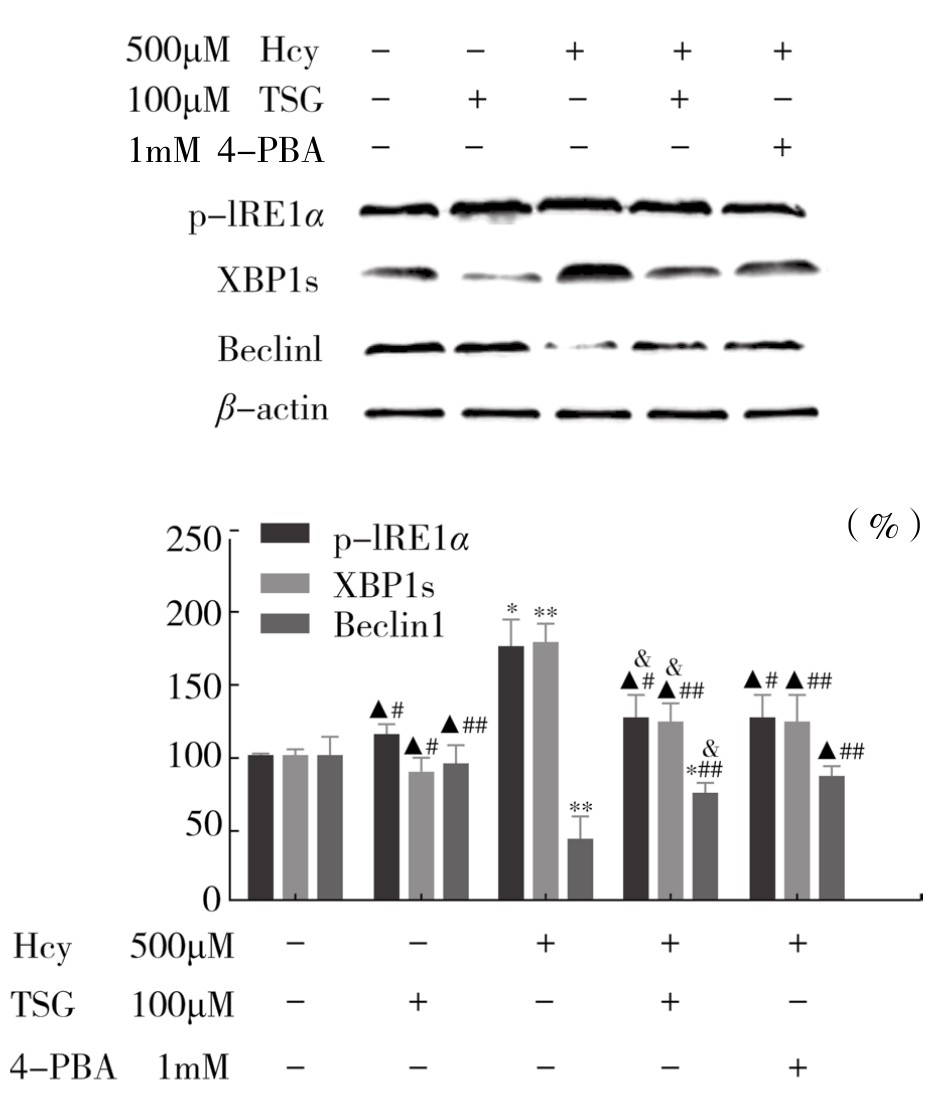
图4-63 TSG对Hcy诱导的血管内皮细胞p-IRE1α、XBP1s、Beclin1蛋白相对表达量的影响(x±s,n=3)
注:与Control组比较,*P<0.05,**P<0.01,▲P>0.05;与Hcy组比较,#P<0.05,##P<0.01;与Hcy+4-PBA(1mM)组比较,&P>0.05。
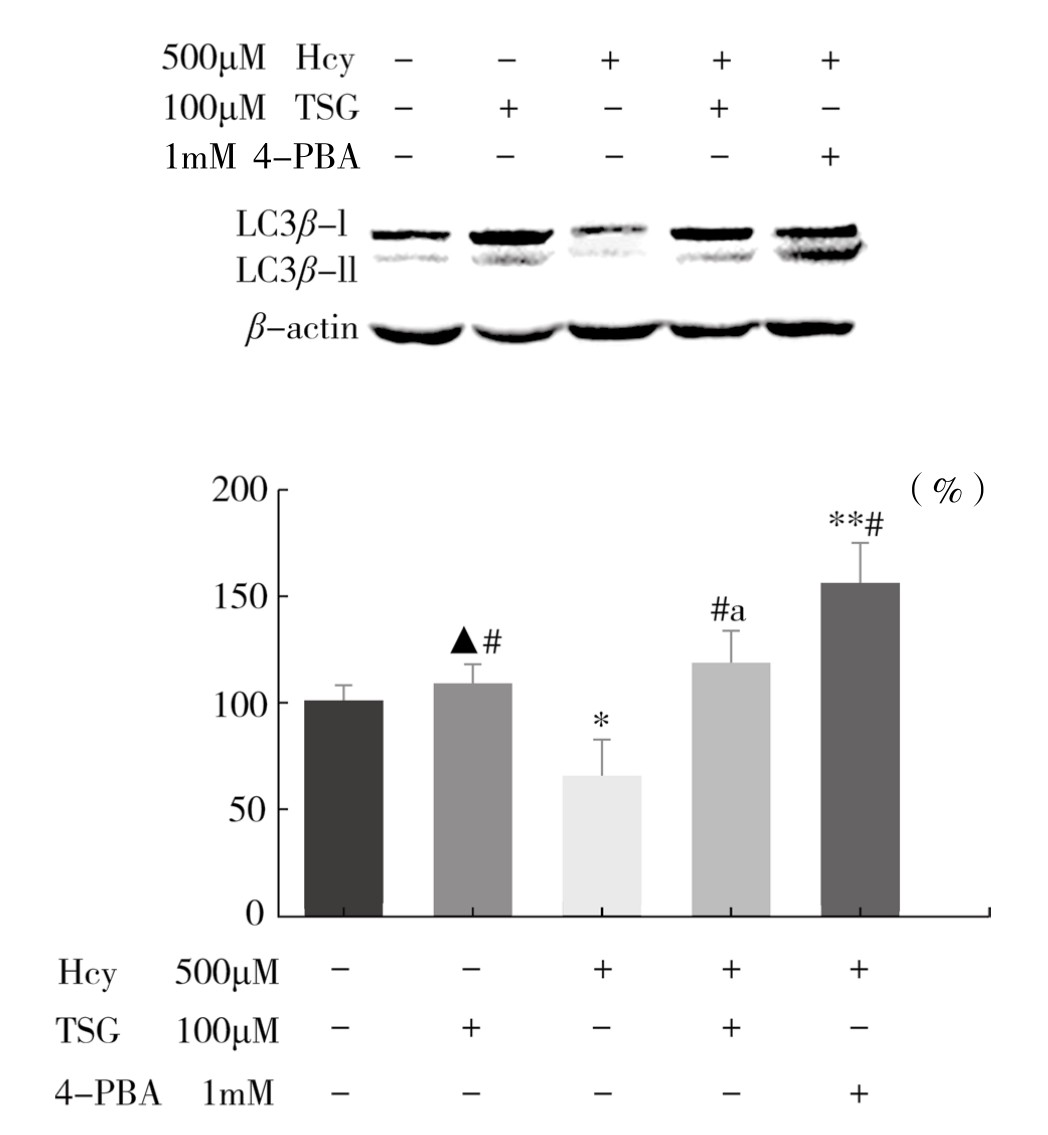
图4-64 TSG对Hcy诱导的血管内皮细胞LC3β-II/I蛋白相对表达量的影响(x±s,n=3)
注:与Control组比较,*P<0.05,**P<0.01,▲P>0.05;与Hcy组比较,#P<0.01;与Hcy+4-PBA(1mM)组比较,aP<0.05。
(三)讨论
AS是中老年人普遍存在的一种病变,其本质是人类随着衰老而发生的动脉壁退行性病理变化。从固护正气、抵御邪气的角度入手,能够提高防治AS的效果。血管内皮细胞的损伤及功能障碍是AS最早期的事件及发病的始动环节,在AS早期内皮细胞凋亡可以促进斑块形成。因此,维护血管内皮结构和功能的完整性在防治AS性疾病中具有重要的意义。运用中医药理论和方法,在AS发生早期斑块尚未完全成形之际,通过保护内皮细胞对早期AS进行干预以逆转或延缓本病的发展,以期为防治AS提供新的思路和方法。
国医大师阮士怡教授认为AS发生及斑块形成的主要病机在于“脾肾虚衰,痰浊停滞”,在此病机理论的指导下,研制了具有“益肾健脾、软坚散结”之功效的补肾软坚方药。本研究探讨了补肾软坚方药有效单体TSG抗Hcy诱导的血管内皮细胞凋亡的作用机制,初步揭示了TSG具有抗Hcy诱导的血管内皮细胞凋亡作用与IRE1-XBP1自噬途径相关。细胞根据ERS强度决定生存死亡,而这一过程与XBP1s密切相关,XBP1s途径可能存在一种“开关”机制去调控细胞存亡。细胞的凋亡与自噬是近年的研究热点,二者相互影响,由ERS引起的细胞凋亡与自噬之间存在交互作用。有研究指出,在巨噬细胞中XBP1s瞬时过表达诱导自噬,并通过下调Beclin1促进巨噬细胞增殖,但其持续过表达会导致细胞凋亡。
本研究通过培养人脐静脉内皮细胞株EA.hy926,建立Hcy诱导内皮细胞凋亡与ERS损伤模型,筛选Hcy损伤模型最佳作用浓度,结合中医“益肾健脾、软坚散结”的理论,以补肾软坚方药有效单体TSG为干预手段,以IRE1-XBP1自噬途径为切入点,在细胞层面研究TSG在防治AS保护血管内皮细胞过程中所发挥的作用。观察TSG抗Hcy诱导内皮细胞凋亡情况,以及TSG对Hcy诱导内皮细胞凋亡途径中ERS相关蛋白GRP78、p-IRE1α、XBP1s、自噬相关蛋白Beclin1、LC3β表达的影响,初步探讨了TSG抗Hcy诱导内皮细胞凋亡的作用及其机制。研究所得结论如下:
①高浓度的Hcy具有一定细胞毒性,Hcy诱导内皮细胞凋亡及ERS损伤模型最佳浓度为500μM。
②TSG具有抗Hcy诱导内皮细胞损伤的作用,能够提高受损内皮细胞的活力。
③TSG能够减少Hcy诱导内皮细胞凋亡数目,降低细胞凋亡率,表明TSG具有抑制Hcy诱导内皮细胞凋亡的作用。
④TSG能够抑制Hcy诱导的ERS相关蛋白GRP78、p-IRE1α、XBP1s表达,促进自噬相关蛋白Beclin1、LC3β-II/I表达,表明TSG可能是通过IRE1-XBP1途径影响内皮细胞自噬水平,进而调控Hcy诱导的内皮细胞凋亡。
