补肾软坚方药从PI3K/Akt/mTOR信号通路调控巨噬细胞自噬的机制
动脉粥样硬化是一种脂质代谢失衡性疾病,也是一种进程缓慢的、机制复杂的血管炎症性疾病。疾病产生初期由于炎症反应激活造成了内皮细胞损伤,单核细胞黏附于受损内皮表面,并迁移到内皮下形成巨噬细胞,巨噬细胞吞噬修饰的脂质形成泡沫细胞。随着疾病继续发展,泡沫细胞等凋亡和坏死造成了坏死脂质核心、炎症反应激活、脂质代谢异常、细胞凋亡、内质网应激和自噬。最近研究表明,巨噬细胞自噬在AS病理发生、发展的过程中扮演着不可或缺的角色。本实验建立巨噬细胞自噬模型,运用补肾软坚方药和Rapamycin预干预24h,采用蛋白质印迹法(Western blotting)检测巨噬细胞PI3K、Akt、mTOR、p-Akt、p-mTOR蛋白的表达情况,探讨补肾软坚方药调节巨噬细胞自噬的通路机制。
(一)材料与方法
1.细胞株 小鼠RAW264.7巨噬细胞株购自国家实验细胞资源共享平台(China Infrastrcture of Cell Line Resource)。
2.主要试剂 氧化低密度脂蛋白(oxLDL)、Rapamycin、补肾软坚方药、BCA蛋白定量试剂盒、0.45μmPVDF膜、BSA、彩色预染高分子蛋白质分子量标准、ECL发光试剂盒、HRP-goat anti-rabbit IgG、兔抗Akt单克隆抗体、兔抗p-Akt单克隆抗体、兔抗mTOR单克隆抗体、兔抗β-actin多克隆抗体、兔抗PCNA多克隆抗体、兔抗PI3K单克隆抗体。
3.方法
(1)巨噬细胞RAW264.7的培养 RAW264.7巨噬细胞株常规培养,DMEM中加入10%的胎牛血清和1%的双抗,置于37℃、5% CO2培养箱培养。待细胞状态良好、贴壁生长面积约90%,分瓶传代,弃去培养瓶内的原有培养液,加入D-hanks液3mL润洗两遍,加入3mL DMEM,用细胞刮刀使细胞脱壁,移入15mL离心管,1000rpm离心5min,弃上清液后加入3mL培养基重悬细胞,1∶6传入新的培养瓶,置于培养箱中培养。
(2)药物干预 细胞传代处理,用计数板细胞计数,传入六孔板,调整细胞密度为2×105个/孔,继续培养。第二天细胞贴壁后换液,分四组加药干预:正常对照组、ox-LDL组、ox-LDL+补肾软坚方药干预组、ox-LDL+补肾软坚方药+mTOR抑制剂Rapamycin干预组(以下依次简称为正常组、模型组、补肾软坚组和Rapamycin组)。
(3)Western blotting检测自噬相关蛋白 将各实验分组细胞弃细胞上清液后加入100μL裂解液反复吹打后,收集裂解液置于高速冷冻离心机中得待测样品。将待测样品做BCA蛋白定量及SDS-PAGE电泳实验,得各组细胞PI3K、Akt、p-Akt、mTOR、p-mTOR的蛋白条带。
4.统计学方法 用Image-Pro Plus 6.0软件计算各组蛋白条带的灰度值。标准化蛋白相对表达倍数值=(实验组目的蛋白条带灰度值÷该组内参蛋白条带灰度值)÷(正常组目的蛋白条带灰度值÷正常组内参蛋白条带灰度值)。将各次实验计算得出的标准化蛋白相对表达倍数值用SPSS 17.0软件进行分析,数据以均数±标准差(x±s)表示,组间比较采用单因素方差分析,以P<0.05为差异有显著性。
(二)结果
1.补肾软坚方药对巨噬细胞自噬模型PI3K蛋白表达的影响 与正常组相比,模型组PI3K蛋白的表达升高,差异有显著性(P<0.05);与模型组相比,补肾软坚组与Rapamycin组细胞PI3K蛋白的表达明显降低,差异非常显著(P<0.01)。(见图4-19)
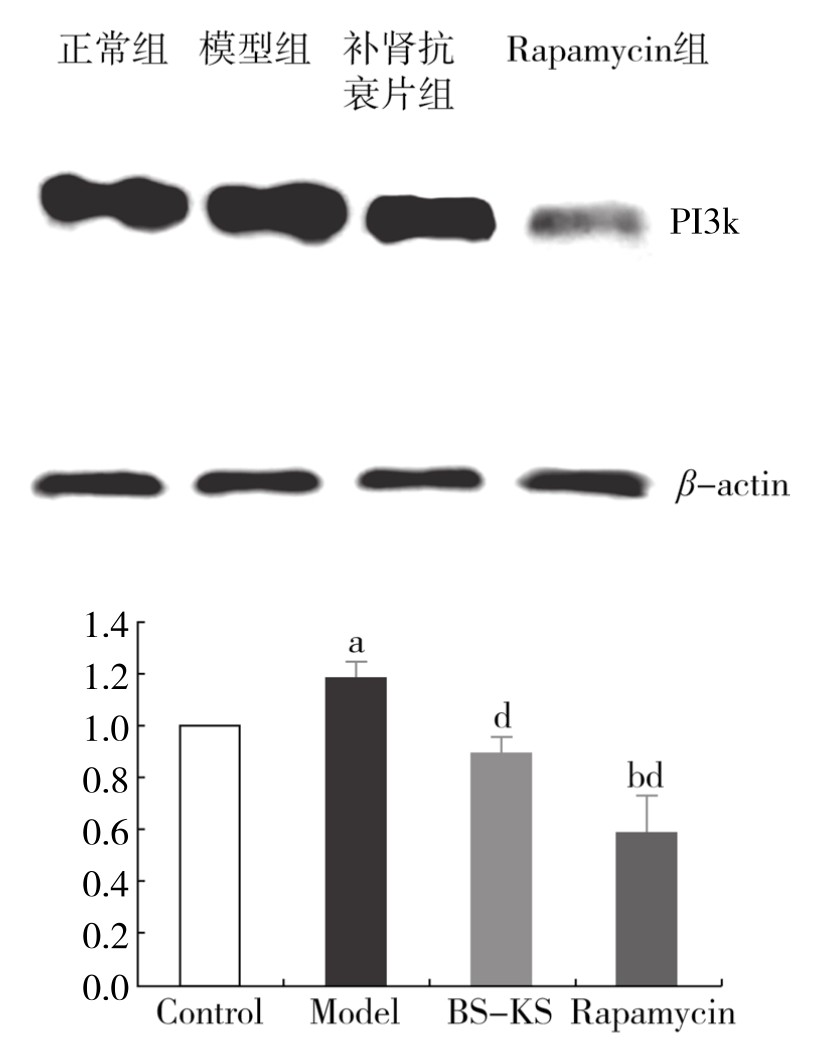
图4-19 各组巨噬细胞内PI3K蛋白表达情况
注:与正常组相比,aP<0.01,bP<0.01;与模型组相比,dP<0.01。
2.补肾软坚方药对巨噬细胞自噬模型Akt、p-Akt蛋白表达的影响 正常组、模型组、补肾软坚组与Rapamycin组间Akt蛋白表达的差异不显著。与正常组相比,模型组p-Akt蛋白的表达升高,差异有显著性(P<0.05);与模型组相比,补肾软坚组与Rapamycin组p-Akt蛋白的表达降低,差异非常显著(均为P<0.01),补肾软坚组与Rapamycin组差异不显著。(见图4-20)
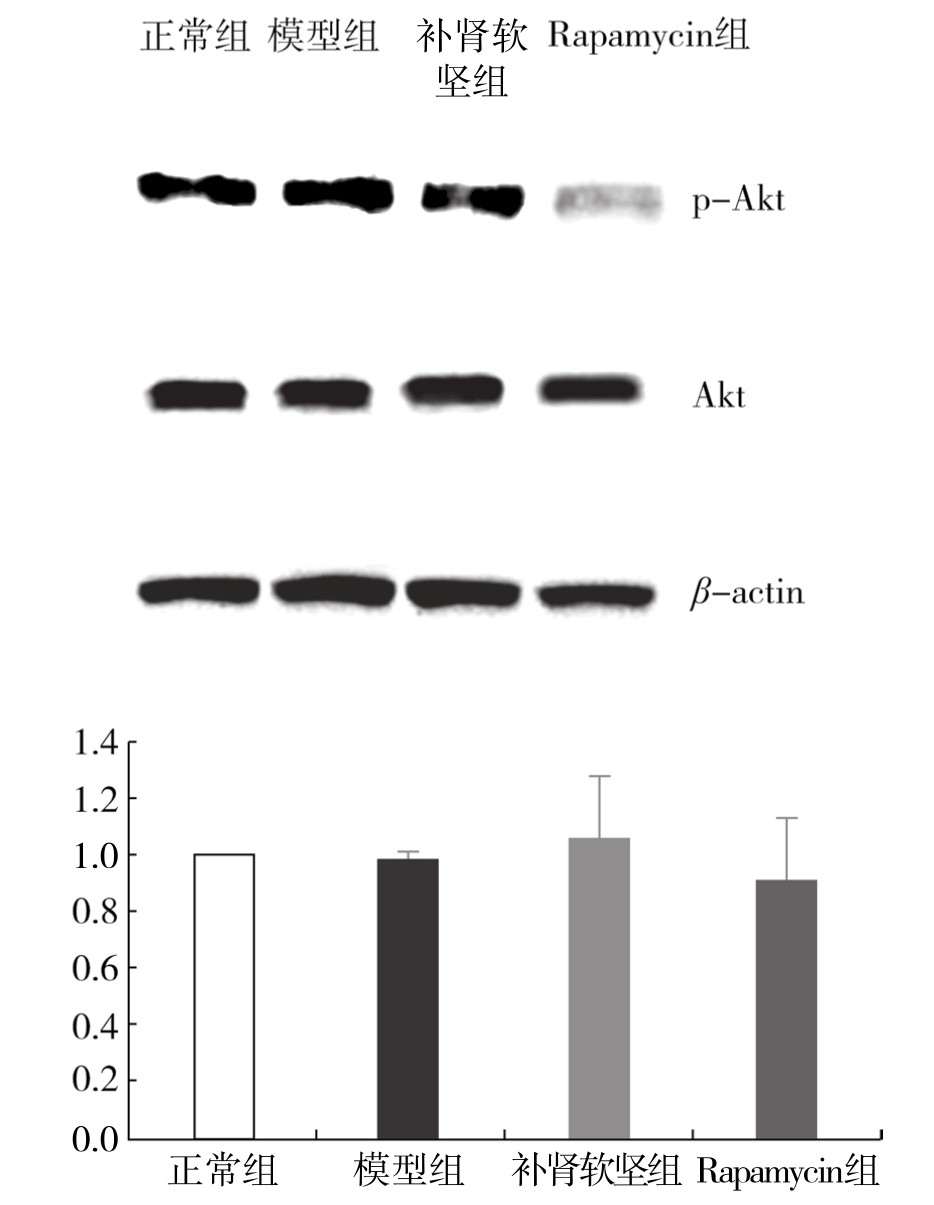
图4-20 各组巨噬细胞内p-Akt蛋白表达情况
注:与正常组相比,aP<0.05,bP<0.01;与模型组相比,dP<0.01。
3.补肾软坚方药对巨噬细胞自噬模型mTOR、p-mTOR蛋白表达的影响 与正常组相比,模型组细胞mTOR蛋白的表达降低,差异不显著;与模型组相比,补肾软坚组与Rapamycin组细胞mTOR蛋白的表达降低,差异有显著性(P<0.01)。Rapamycin组与补肾软坚组相比,差异不显著。与正常组相比,模型组细胞p-mTOR蛋白的表达升高,差异有显著性(P<0.05);与模型组相比,补肾软坚组与Rapamycin组p-mTOR蛋白的表达降低,差异有显著性(均为P<0.05)。(见图4-21、图4-22)
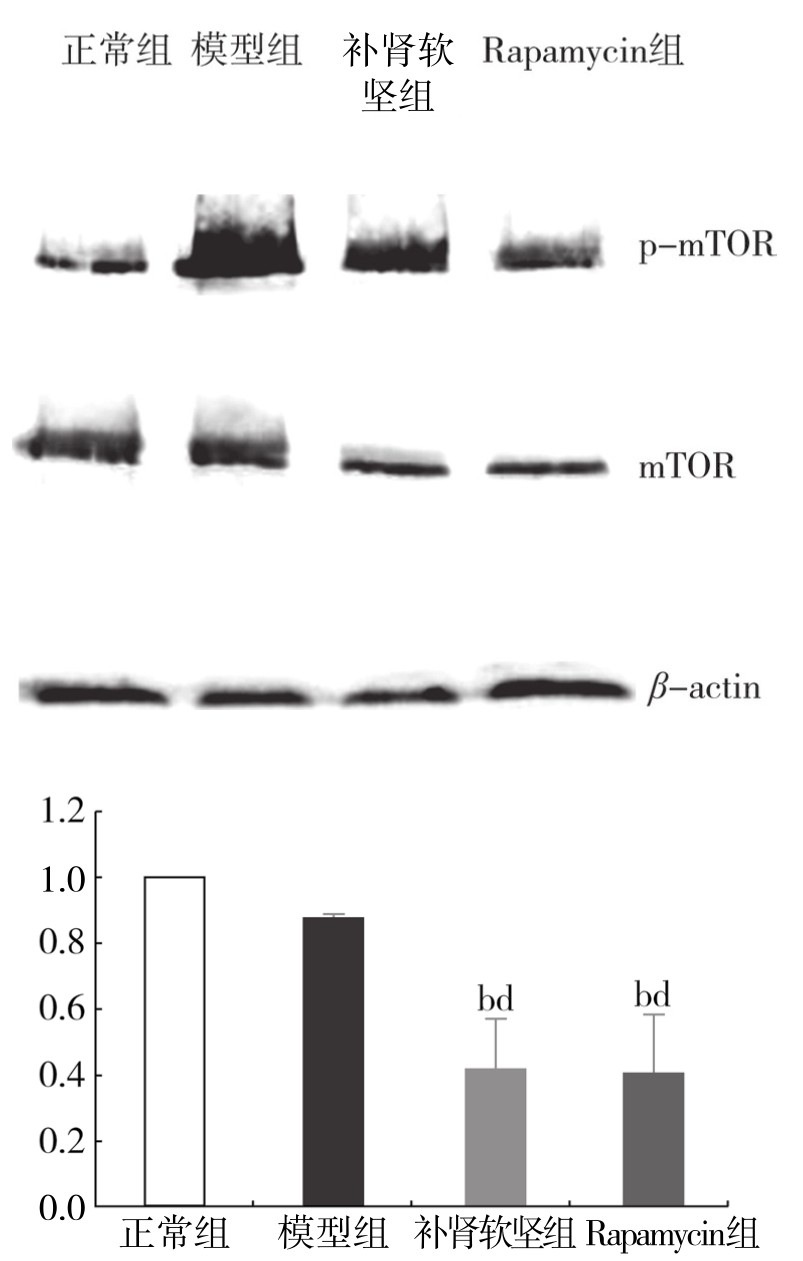
图4-21 各组巨噬细胞内mTOR蛋白表达情况
注:与正常组相比,bP<0.01;与模型组相比,dP<0.01。
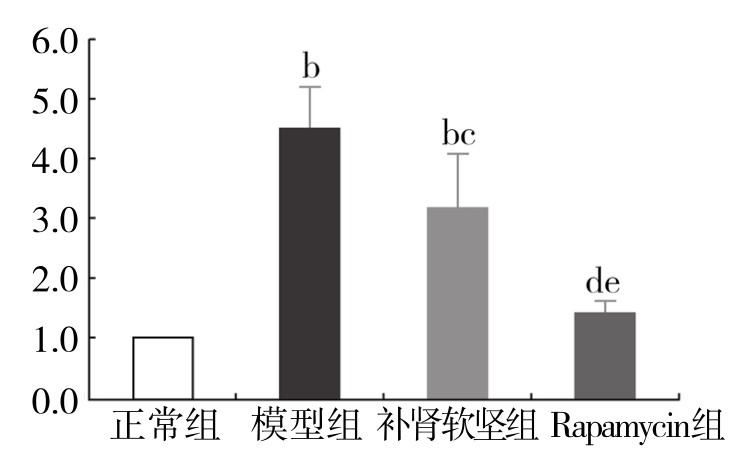
图4-22 各组巨噬细胞内 p-mTOR 蛋白表达情况
注:与正常组相比,aP<0.05,bP<0.01;与模型组相比,cP<0.05,dP<0.01;与补肾软坚组相比,eP<0.01。
(三)讨论
mTOR信号通路的激活依赖于上游信号PI3K/Akt通路的启动,其中PI3K是一类特异性磷酸化肌醇磷脂3位羟基激酶,PI3K根据其结构特点和底物特异性可分为Ⅰ、Ⅱ、Ⅲ3种类型,Ⅰ型又分为ⅠA和ⅠB两种亚型。在受到胰岛素、成纤维细胞生长因子、血管内皮生长因子、血管位蛋白Ⅰ等生长因子的刺激后,PI3KⅠA亚型便会通过细胞表面的酪氨酸蛋白激酶受体(receptor tyrosine kinases,RTK)被激活,继而激活下游的蛋白激酶B(protein kinase B,PKB),又称为Akt,Akt亦有1、2、3三种类型,其中Akt 1可以促进细胞的增殖和存活;Akt 3则有调节细胞的数目及大小的功能,这对于整条PI3K/Akt/mTOR信号通路在细胞自噬与凋亡中的角色都有着重要的意义。
本部分实验通过蛋白质印迹法观察了补肾软坚方药对PI3K/Akt/mTOR信号通路蛋白表达的影响。结果显示,ox-LDL 100μg/mL刺激巨噬细胞可激活PI3K信号通路,可导致PI3K通路相关蛋白PI3K、p-Akt、p-mTOR蛋白的表达均明显升高。补肾软坚方药能够抑制PI3K蛋白表达、抑制下游p-Akt、p-mTOR蛋白的表达,说明补肾软坚方药可能通过抑制PI3K/Akt/mTOR信号通路蛋白的表达,上调AS自噬相关蛋白的表达。Rapamycin组能够直接作用于mTOR,直接抑制mTOR和p-mTOR蛋白的表达,上调细胞自噬。各组间Akt蛋白表达无明显差异,主要是由于Akt、mTOR的磷酸化是其活化的标志,其在磷酸化后才能发挥生物学效应,而总的Akt、mTOR并不能很好反应通路被激活的情况。补肾软坚方药可能通过抑制PI3K/Akt/mTOR信号通路蛋白的表达,上调AS自噬相关蛋白的表达,抑制AS的发生发展,从一个较新的角度阐释了补肾软坚方药治疗AS的药理机制。
