补肾软坚方药干预动脉粥样硬化兔外膜损伤致内膜巨噬细胞极化的研究
动脉粥样硬化(AS)是一种常见的心血管疾病,是血管壁的退行性病变,常累及大、中动脉壁,是发达国家高疾病死亡率的重要原因。随着对动脉粥样硬化机制的不断研究发现,除了脂质代谢失衡和动脉脂质积聚,免疫炎症反应也是导致动脉粥样硬化发生和发展的主要因素,巨噬细胞在AS病理进程的各个阶段均发挥中心作用。巨噬细胞清除过量累积在新生内膜的修饰脂蛋白,吞噬脂质后定居在斑块的坏死核心旁或斑块肩部,组织中变化的微环境可诱导巨噬细胞向不同亚型极化。通过探究补肾软坚方药对巨噬细胞极化亚型分化的干预,明确其对巨噬细胞在AS病变中的作用。
(一)材料与方法
1.实验动物 清洁级健康成年雄性新西兰兔72只,体重(2.2±0.2)kg。
2.主要试剂与药品 补肾软坚方药、阿托伐他汀钙片,Arg-Ⅰ多克隆抗体、Arg-Ⅱ多克隆抗体、iNOS多克隆抗体、CD163单克隆抗体(ab111250)、HRP标记山羊抗兔IgG试剂盒、HRP标记山羊抗小鼠IgG试剂盒,RnaExTM Total RNA Isolation(GK3006),Rayscript cDNA Synthesis KIT(GK8030),AceQTM qPCR Probe Master Mix(Q112-02),Platemax(UC-500)。
3.方法
(1)造模 健康成年雄性新西兰兔,高脂饲料喂养,剔除血脂水平正常者。实验动物以 3%戊巴比妥钠(1mL/kg)经耳缘静脉注射麻醉、固定,于颈部正中切口,以胰酶消化法联合机械剥离法损伤兔一侧颈动脉外膜,对侧颈动脉行假手术处理。
(2)分组给药 造模成功者术后分为模型组(分为损伤侧与对照侧)、阿托伐他汀组、补肾软坚组,每组分为四个亚时间点(术前,术后4周、8周、12周),每个时间点6只。给药组于术后第二天给药,阿托伐他汀组给予阿托伐他汀钙片5mg/kg/d,补肾软坚组给予补肾软坚方药1g/kg,2次/d,模型组给予等量生理盐水灌胃。
(3)取材 实验动物分别于术后第1周、4周、8周、12周末麻醉,固定,心脏灌注,损伤侧留取外膜消化段3cm,对照侧留取相应血管段3cm,10%的中性福尔马林溶液固定,以备动脉形态学观察。
4.标本检测项目
(1)常规病理学检查 颈动脉置于10%中性福尔马林固定液6.5h,福尔马林50%乙醇溶液30min固定,常规脱水包埋,切片厚5μm,行HE染色。
(2)免疫组化检测颈动脉Arg-Ⅱ、iNOS,Arg-Ⅰ、CD163的表达 石蜡切片脱蜡至水,30%H202 1份与蒸馏水10份混合,室温10min,蒸馏水洗3次,微波枸橼酸热修复,滴加5%BSA封闭液,室温20min,滴加一抗(1∶100稀释),37℃ 1h,PBS洗涤3次,滴加生物素化IgG,37℃ 20min,PBS洗涤,滴加试剂SABC,37℃ 20min,PBS冲洗,DAB显色,苏木素复染,脱水封片,显微镜观察。
(3)荧光定量Q-PCR检测Arg-Ⅰ、Arg-Ⅱ的mRNA表达 采用RnaExTM试剂盒从颈动脉中提取RNA,采用逆转录试剂盒将其逆转成cDNA。每个标本均进行Arg-ⅠmRNA、Arg-ⅡmRNA和rabbit-actin的荧光定量PCR。反应条件95℃ 10min,(95℃10sec,60℃ 34sec)×40个循环。采用2-ΔΔCt相对定量计算公式,计算出各组目的基因的相对表达量。60℃~95℃绘制熔解曲线,利用比较CT法计算各样本mRNA的表达。比较CT法计算各样本mRNA的表达情况,依据公式ΔCt=Ct目的基因-Ct内参基因,分别计算各组的ΔCt值,各样本mRNA的相对表达量以2-ΔCt表示,以2-ΔΔCt表示各组间的相对表达率,其中ΔΔCt=ΔCt目的基因-ΔCt校正样本基因。目的基因及内参引物序列见表3-42。
表3-42 目的基因及内参引物序列

根据Q-PCR原始检测结果,采用2-ΔΔCt法进行数据的相对定量分析,ΔΔCt=(待测样品目的基因平均Ct值-待测样品内参基因平均Ct值)-(对照样品目的基因平均Ct值-对照样品内参基因平均Ct值)。
5.统计学方法 计量资料采用均值±标准差(x±s)表示,多组之间的比较采用单因素方差分析,两两比较采用LSD-t检验。用SPSS 17.0软件进行统计分析,P<0.05为差异有显著性,P<0.01为差异非常显著。
(二)结果
1.一般形态学改变 随着时间延长,损伤外膜逐渐恢复,伴随内膜增生程度的加重,外膜厚度逐渐增加。两给药组内膜增生程度差异较小,但阿托伐他汀组较补肾软坚组病变程度轻,与模型组比较,两给药组病变均有不同程度的减轻。(见附录,图3-86)
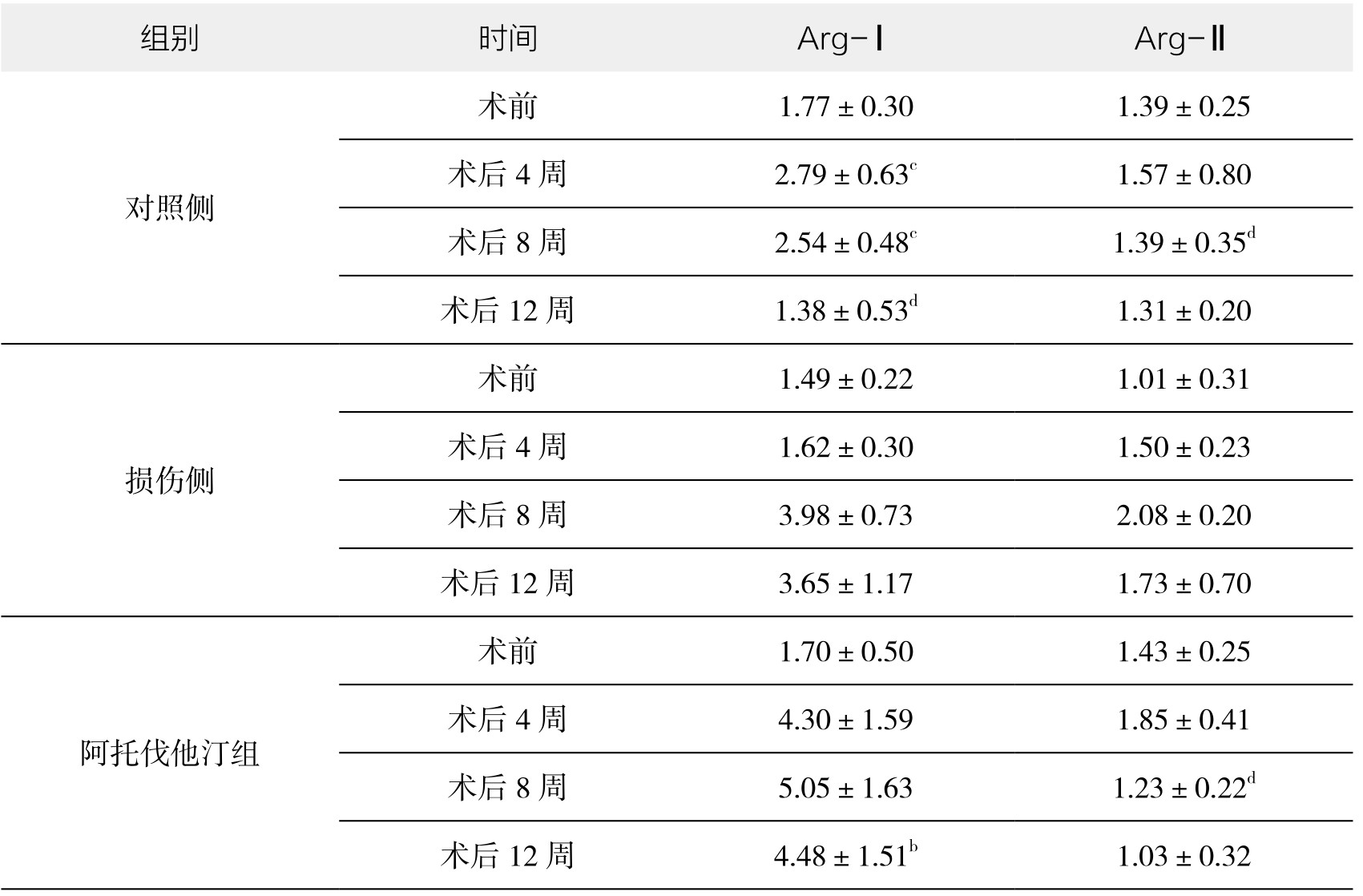
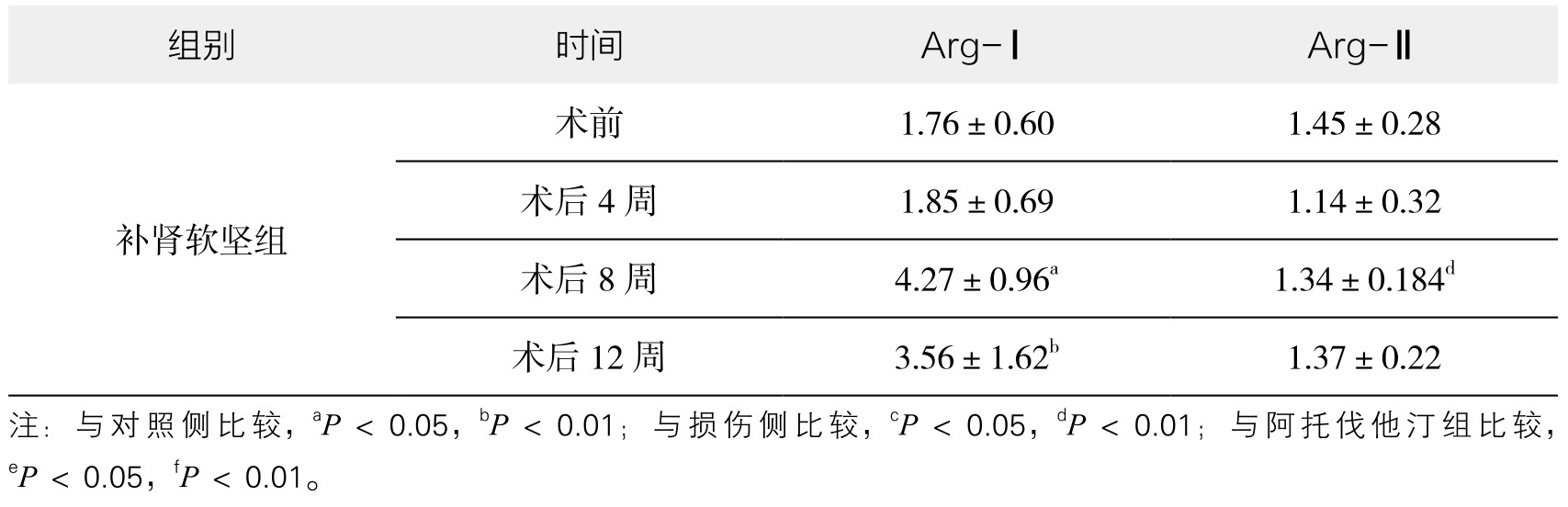
2.免疫组化结果检测Arg-Ⅰ、Arg-Ⅱ的mRNA的表达 图像分析结果表明(见附录,图3-87~图3-90,见表3-43),各组Arg-Ⅰ mRNA表达于外膜损伤术后4周均升高,但术后8周对照侧反降低,补肾软坚组Arg-Ⅰ mRNA表达高于损伤侧及对照侧。阿托伐他汀组整体表达呈增加趋势,且高于损伤侧和补肾软坚组。对照侧与损伤侧Arg-Ⅰ mRNA表达于外膜损伤术后4周均升高,但术后8周损伤侧显著升高,对照侧反降低。术后12周对照侧与损伤侧Arg-Ⅱ mRNA表达均降低,但损伤侧明显高于对照侧,可能因外膜损伤术使用胶原酶消化并机械剥离外膜组织,对动脉损伤刺激加重,造成炎症反应显著;补肾软坚组外膜损伤术后Arg-Ⅱ mRNA表达明显低于损伤侧和对照侧。
表3-43 各实验组Arg-Ⅰ、Arg-Ⅱ的mRNA表达(mmol/L,x±s,n=6)
续表
3.Q-PCR法检测Arg-Ⅰ、Arg-Ⅱ、CD163和iNOS的蛋白表达 补肾软坚组Arg-Ⅰ蛋白与CD163蛋白阳性表达均明显高于损伤侧和对照侧,差异有显著性(P<0.05),补肾软坚组Arg-Ⅱ蛋白与iNOS蛋白阳性表达均明显低于损伤侧及对照侧,差异有显著性(P<0.05)。(见附录,图3-91~图3-94)
(三)讨论
动脉粥样硬化病变过程中,巨噬细胞可极化为具有促炎效应的经典活化型巨噬细胞(M1)和抗炎效应的替代活化型巨噬细胞(M2)两种极化亚型,这种极化特性贯穿AS病变始终。通过对巨噬细胞极化特性的研究,现普遍认为组织微环境决定巨噬细胞极化的条件。细菌性产物如脂多糖(Lipopolysaccharide,LPS)、炎性细胞因子如干扰素γ(interferon-γ,IFN-γ)等可诱导巨噬细胞向M1型极化。M1型巨噬细胞具有吞噬微生物和组织破坏的能力,分泌与斑块失稳、破裂及血栓形成相关的促炎细胞因子、趋化因子、活性氧、基质金属蛋白酶类和组织因子。M1型巨噬细胞主要特点是高表达促炎因子,产生高浓度的活性氧和活性氮,促进TH1反应发生,具有强效杀菌能力。细胞因子如白介素-4(IL-4)、白介素-13(IL-13)等可以诱导巨噬细胞向M2型极化。M2型巨噬细胞具有抗炎、免疫抑制、组织修复的作用,通过清除细胞碎片和凋亡细胞降低炎症反应的发生。M2型巨噬细胞主要特点是强吞噬作用,高表达甘露糖受体和半乳糖受体,高表达白介素-10(IL-10),低表达白介素-12(IL-12)。
本研究通过在同一实验动物分别使用食饵法基础上加外膜消化法及机械剥离损伤法和单纯食饵法建立兔动脉粥样硬化模型,采用自体对照法,分别于术前及术后4周、8周和12周,观察补肾软坚方药干预AS动物模型颈动脉M1型巨噬细胞和M2型巨噬细胞的表面标记物的影响。实验结果显示,补肾软坚方药可降低外膜损伤术后颈动脉M1型巨噬细胞表面标记物的表达,同时,M2型巨噬细胞表面标记物的表达增加,且M2型巨噬细胞表面标记物表达高于M1型巨噬细胞表面标记物的表达。补肾软坚方药可能通过促进M2型巨噬细胞的极化、抑制M1型巨噬细胞极化发挥抗动脉粥样硬化的作用,从巨噬细胞极化的角度阐释了补肾软坚方药治疗AS的药理机制。
