补肾软坚方药干预动脉粥样硬化家兔胆固醇逆转运相关因子抗外膜损伤的研究
动脉粥样硬化(AS)是多种心脑血管疾病共同病理基础,其以巨噬细胞吞噬胆固醇形成泡沫细胞为发病基础,继而中膜平滑肌细胞迁移、黏附并释放细胞外基质于泡沫细胞,当泡沫细胞中的脂质成分不断蓄积形成大的脂质池,细胞外基质不断降解,纤维斑块转变为“犯罪斑块”后即导致不良心血管事件的发生。可见,要进一步降低心血管疾病的危害,必须从预防和/或逆转动脉粥样硬化开始。脂质代谢紊乱贯穿于AS发病的整个过程中,促进巨噬细胞的胆固醇流出或逆转运对预防和逆转粥样斑块具有重要意义,这也是近年来药物治疗和干预的重点目的。本研究通过高脂喂养结合外膜损伤的方法建立兔颈动脉AS模型,探索补肾软坚方药有效调控胆固醇逆转运相关因子,抑制动脉粥样硬化的发生发展机制。
(一)材料与方法
1.动物 清洁级健康成年雄性新西兰大白兔,体重(2.2±0.2)kg。
2.主要试剂 阿托伐他汀,补肾软坚方药,Ⅱ型胶原酶溶液,戊巴比妥钠,0.9%氯化钠注射液,青霉素钠(30万单位),甲醛溶液,苏木素-伊红染色试剂盒,中性树胶封片剂,二甲苯,高效切片石蜡(熔点48℃~50℃),TC试剂盒,TG试剂盒,HDL试剂盒,LDL试剂盒,ApoA1试剂盒,ApoB试剂盒。
3.方法
(1)制备颈动脉外膜损伤致粥样硬化模型 通过高脂喂养结合外膜损伤建立兔颈动脉粥样硬化模型。
(2)实验动物分组及给药 高脂(100g/d)喂养4周后,随机分为高脂模型组(等体积生理盐水,灌胃)、阿托伐他汀组(5mg/kg/d,灌胃)、补肾软坚方药组(1g/kg,2g/d,灌胃),正常对照组(以普通饮食未施以外膜损伤术的新西兰兔为对照,予等体积生理盐水灌胃)4组(以下简称为对照组、模型组、阿托伐他汀组、补肾软坚组),每组6只兔。阿托伐他汀组、补肾软坚组的给药剂量参考徐叔云教授主编的《药理实验方法学》计算,并均以生理盐水将其配置成溶液灌胃。阿托伐他汀组每日8点给药1次,补肾软坚组每日早晚间隔12小时给药2次,连续8周。
(3)标本收集处理 第16周末取材,行颈动脉HE染色,酶比色法检测血清胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C),比浊法检测载脂蛋白A1(ApoA1)及载脂蛋白B(ApoB)的水平;实时荧光定量PCR检测颈动脉壁胆固醇逆转运(Reverse Cholesterol Transport,RCT)相关因子ABCA1(ATP-Binding Cassette Transporter A1)、LXR-α(Liver X receptor)mRNA及肝脏LXR-α(Liver X receptor)mRNA含量。
(4)血清TC、TG、LDL、HDL、ApoA1、ApoB的检测 采用全自动生化分析仪检测兔血清中总胆固醇(TC)(酶比色法)、甘油三酯(TG)(酶比色法)、低密度脂蛋白胆固醇(LDL-C)(清除法)、高密度脂蛋白胆固醇(HDL-C)(清除法)、载脂蛋白A1(ApoA1)(免疫化学法)、载脂蛋白B(ApoB)(免疫化学法)。
(5)主动脉苏木素-伊红(HE)染色 将固定的颈动脉组织进行石蜡切片的制备,并进行HE染色。
4.统计学方法 采用SPSS 17.0统计软件,数据以均值±标准差(x±s)表示,多组比较采用单因素方差分析及LSD检验,P<0.05为差异有统计学意义。
(二)结果
1.动物一般情况及体重 实验期间,每天观察动物一般情况。高脂饲料喂养4周后,选取精神状态好、毛顺色泽光亮、捕捉反应灵敏、粪便大小均匀、纳食可的动物进行造模。造模术后,各组动物饮食欠佳,术后2~3天伤口恢复后,各组动物饮食恢复正常;术后未见伤口感染者。随着高脂喂养时间的延长,各组动物精神较术前欠佳,捕捉反应较术前迟钝,活动较术前减少,粪便颗粒变小、光亮,舌暗红,纳食可,实验后期眼睛可见脂肪沉淀;术后,少部分动物出现腹胀、腹泻、纳差、体重减轻,经少量多次给食后状态仍不能调整的,剔除实验。每周称量动物体重,动物体重随着时间的延长逐渐增长,但是术后1周内,体重增加不显著,分析原因,可能是手术伤口的疼痛影响了动物的食欲。(见图3-42)
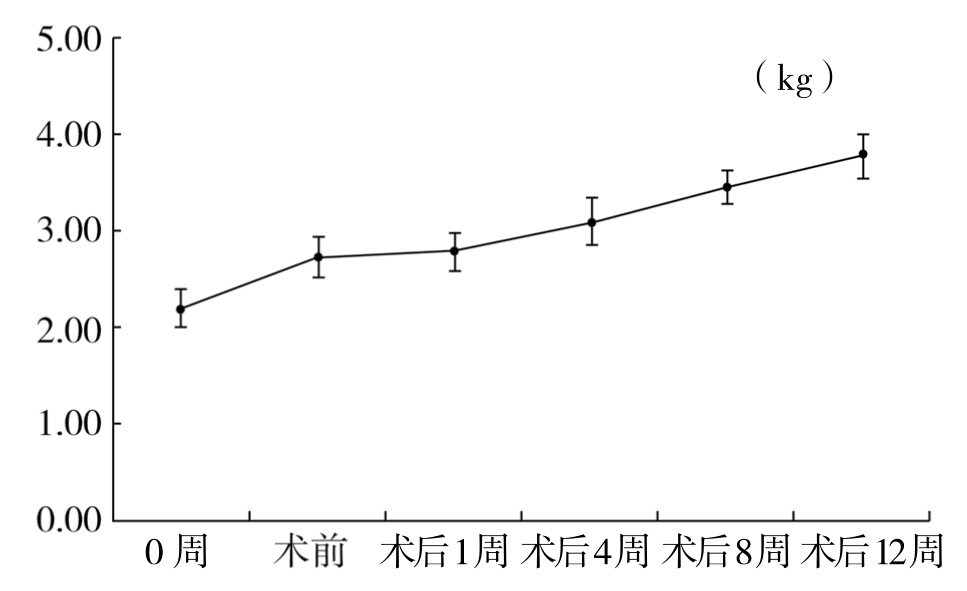
图3-42 实验动物体重变化
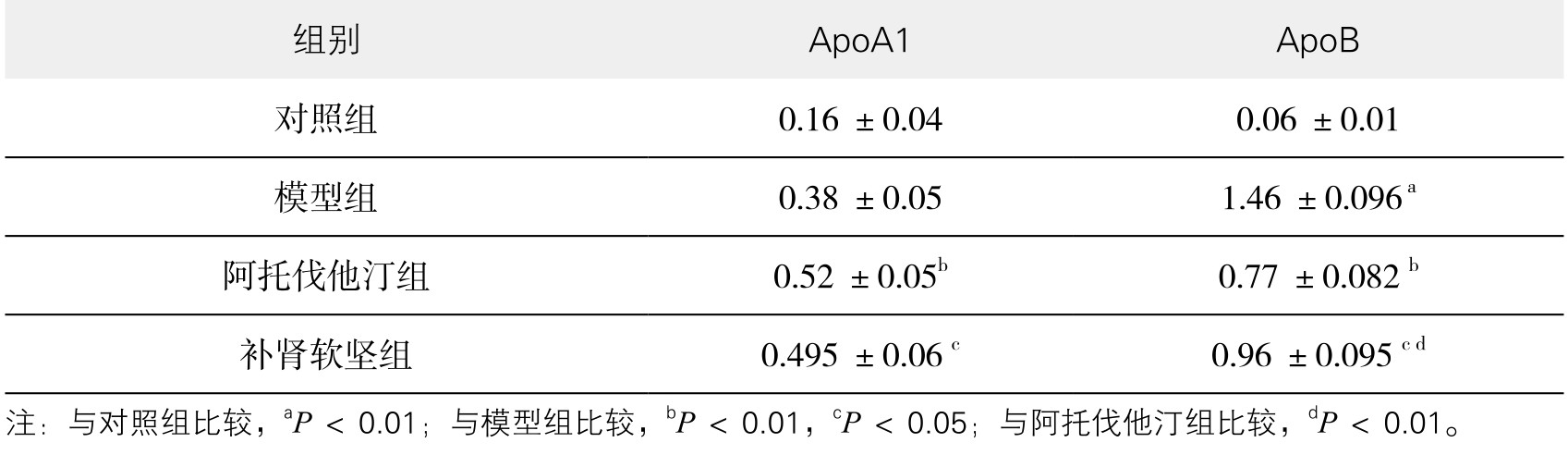
2.补肾软坚方药对颈动脉AS兔血脂的影响 如表3-29、表3-30所示,干预12周后,与对照组相比,模型组动物血脂(TC、TG)水平均明显升高(P<0.01),与模型组相比,补肾软坚组TC、TG水平降低,但无统计学意义(P>0.05),阿托伐他汀组TC、TG水平明显降低(P<0.01);与对照组相比,模型组动物LDL-C、ApoB水平明显升高(P<0.01),与模型组相比,补肾软坚组LDL-C、ApoB水平降低(P<0.05),阿托伐他汀组更为显著(P<0.01);与对照组相比,模型组HDL-C、ApoA1升高,但无统计学意义(P>0.05),与模型组相比,补肾软坚组HDL-C、ApoA1升高(P<0.05),阿托伐他汀组HDL-C、ApoA1升高的水平更为显著(P<0.01)。此外,与补肾软坚组相比,阿托伐他汀降TC、LDL-C、TG及ApoB,升高HDL-C的水平均较为显著(P<0.01),而对于升高ApoA1水平,二者相较差异不显著(P>0.05)。
表3-29 补肾软坚方药对颈动脉AS兔血清TC、TG、LDL-C、HDL-C的影响(mmol/L,x±s)
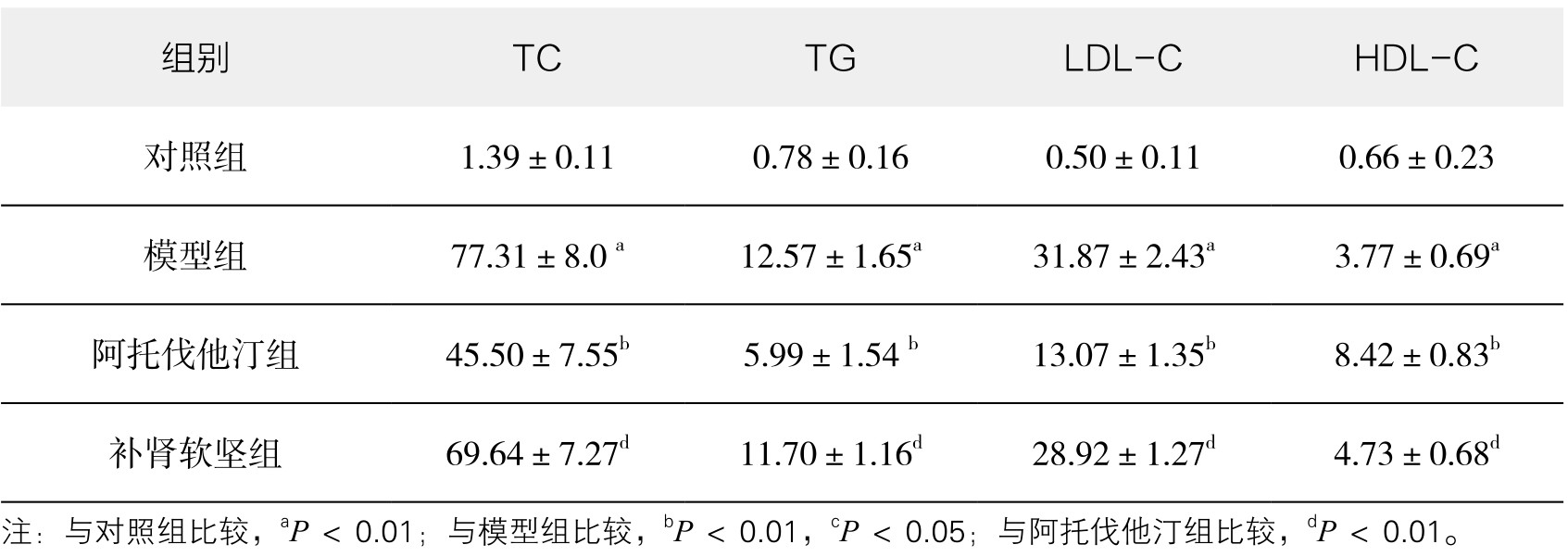
表3-30 补肾软坚方药对颈动脉AS兔血清ApoA1、ApoB的影响(g/L,x±s)
3.补肾软坚方药对兔颈动脉AS斑块的影响 HE染色后,在100倍光学显微镜下可见对照组平滑肌细胞排列整齐、紧密有序,内皮细胞层连续,内皮下未见脂质沉积;模型组颈动脉较对照组可见粥样硬化斑块突出于管腔,几乎覆盖于整个管腔表面,管腔明显变窄、大小不规则,内膜明显增厚,中膜平滑肌细胞排列紊乱,外膜损伤不完整;而药物干预12周后,阿托伐他汀组颈动脉内膜较薄且中膜平滑肌细胞排列紊乱。向内膜增生的程度较轻,斑块明显缩小变薄,补肾软坚组可见明显斑块,但厚度较模型组薄,中膜平滑肌细胞排列紊乱情况改善;HE染色结果显示补肾软坚方药能够改善AS病变程度。
“益肾健脾、软坚散结”法治疗冠心病临床疗效肯定,其代表方补肾软坚方药具有抗动脉粥样硬化作用,机制与上调胆固醇逆转运相关因子有关。
(三)讨论
本实验通过高脂喂养结合外膜损伤法建立AS兔模型,因兔是食草性动物,单一大量摄入胆固醇,只能造成AS早期的脂纹脂斑,且摄入高脂饮食时间过长则破坏其饮食结构,严重影响兔的消化吸收功能,容易出现腹泻或黄疸而导致死亡,不利于对AS的观察研究,所以选择加用另一种损伤方法,即外膜损伤加速血管病变,避免种属带来的影响因素。药物干预12周后,与对照组相比,模型组动物血脂水平均明显升高(P<0.05),其中,以TC和LDL-C、ApoB升高最为明显(P<0.001),TG、HDL-C、ApoA1也略有升高;与模型组相比,补肾软坚组LDL-C、ApoB明显降低(P<0.05),而TC、TG仅有降低趋势,但无统计学意义(P>0.05);HDL-C、ApoA1水平升高(P<0.05)。HE染色后,在100倍光学显微镜下可见补肾软坚组颈动脉较模型组斑块变薄,AS病变程度减轻。本实验结果表明,补肾软坚方药通过调控脂质代谢,发挥抗AS效应,但其效果不及阿托伐他汀。
本实验通过高脂喂养结合外膜损伤建立兔颈动脉粥样硬化模型,明确了“益肾健脾、软坚散结”法代表方补肾软坚方药对AS兔颈动脉粥样硬化的治疗效果。
