补肾软坚方药影响内皮细胞过氧化损伤的研究
血红素加氧酶-1(HO-1)是血红素降解的限速酶,能降解血红素生成Fe2+、一氧化碳(CO)和胆红素,其在多种疾病中发挥细胞保护作用。前期研究表明,补肾软坚方药介导的脑保护作用与其上调HO-1活性密切相关。因此,本实验通过建立过氧化氢(H2O2)诱导的EA.hy926细胞氧化应激损伤模型,观察补肾软坚方药对EA.hy926细胞氧化应激损伤的影响。
(一)材料与方法
1.细胞株 人脐静脉细胞融合细胞株EA.hy926(No.CRL-2922)。
2.药物及试剂 补肾软坚方药,二甲基亚砜(Dimethyl sulfoxide,D2650)、含铁血红素(Sigma-Aldrich Co.LLC.Hemin,51280),分析纯过氧化氢(H2O2),羊HO-1多克隆抗体(sc-7695)、驴抗羊FITC-IgG(sc-2024),细胞增殖与毒性检测试剂盒。
3.方法
(1)EA.hy926细胞培养 EA.hy926细胞常规培养于含10%(v/v)胎牛血清的高糖DMEM培养基,置于37℃、5%CO2培养箱中。细胞融合80%~90%时进行传代,利用细胞计数法测定细胞生长曲线,每2~3天以1∶2进行传代1次,取对数生长期细胞用于实验。
(2)含药血清的制备 同第二章第三节。
(3)EA.hy926过氧化损伤模型的建立 参照文献方法建立模型。以1×105个/孔将细胞接种于96孔板,以含10%FBS的DMEM培养24h后,换以1%FBS完全培养24h同步化后再分别以0.00mM、0.05mM、0.10mM、0.20mM、0.50mM、1.00mM、2.00mM、20.00mM H2O2干预细胞2h、6h、12h、24h;以CCK-8法测量不同浓度H2O2 10% FBS全培干预下各时间点的OD值;以出现细胞LD50的10% FBS全培H2O2终浓度和干预时间作为EA.hy926细胞氧化损伤模型建立的最佳浓度和时间。
(4)CCK-8法测定细胞增殖活力 取对数生长期的EA.hy926细胞按1×105个/mL接种于96孔板,每孔总体积200μL,均置于37℃、5% CO2培养箱中培养24h。实验分组如下:
①空白对照组(NOR):10% FBS正常培养细胞。
②实验对照组(CONTR):10%兔血清正常培养细胞。
③H2O2过氧化损伤组(MOD):EA.hy926细胞以10%兔空白血清干预24h后,再以200μM终浓度的H2O2干预12h。
④补肾软坚方药组(BSKS):EA.hy926细胞以10%补肾软坚方药含药血清干预24h后,再以200μM终浓度的H2O2干预12h。
干预完毕后,按照CCK-8试剂盒操作说明书要求,将10μL/孔CCK-8(5mg/mL)试剂加至相应实验孔中,视颜色变化情况和细胞生长情况继续孵育4h,然后每孔内加入150μL DMSO,振荡15min,将孔板置于酶标仪于490nm波长处读取吸光度(A)值,实验重复3次。
(5)荧光探针法检测氧自由基(ROS)水平 收集对数生长期EA.hy926细胞,在6孔培养板内以5×108 cells/L的密度种植,加入1mL含10% FBS的DMEM培养24h,换1mL含1% FBS的DMEM再培养12h,并以补肾软坚方药含药血清作用后,用PBS冲洗细胞3次,各孔分别加入浓度为10μm的荧光探针(DCFH-DA),37℃孵育各组细胞3h后,以Hanks液洗涤2次,每次以胰蛋白酶消化细胞2min,以Hanks液洗涤2次,加入400μL Hanks液重悬细胞,按流式细胞仪检测要求处理细胞并检测105个细胞内DCF的荧光强度(激发波长488nm,发射波长530nm),反映细胞内ROS生成量。
(6)免疫荧光法检测HO-1蛋白的表达 同第四章第三节。
4.统计学方法 实验数据以均数±标准差(x±s)表示,采用SPSS 18.0统计软件包进行统计学处理。计量资料多组间比较采用单因素方差分析,以P<0.05为差异有统计学意义。图像资料采用image J软件分析。
(二)结果
1.EA.hy926细胞的过氧化损伤 从实验结果可见,不同浓度H2O2 10% FBS全培干预下各时间点的OD值显示,长时间、高浓度H2O2的氧化作用会对细胞造成不可逆损伤,甚至死亡。CCK-8法测量不同浓度H2O2 10% FBS全培干预下各时间点的OD值显示,H2O2浓度为0.20mM干预12h时,为细胞半致死量(LD50);当H2O2浓度大于0.50mM时,几乎没有贴壁细胞。故以10%补肾软坚方药含药血清孵育24h后,再以200μmol/L H2O2干预12h可作为过氧化损伤模型。此时,细胞存活率没有明显降低,而细胞出现了明显损伤。(见附录,图4-10)
显微镜下观察不同H2O2浓度干预12h时相可见,正常EA.hy926细胞贴壁生长,呈铺路石状镶嵌排列。细胞为扁平多角形,边界清楚,胞浆丰富。H2O2损伤后,细胞形态改变成团簇状,界限不清,细胞间隙增大,某些融合部分断裂,部分区域脱落,较正常细胞有明显改变;且发现,H2O2浓度越高,脱落细胞越明显。(见附录,图4-11)
2.EA.hy926细胞的活力 CCK-8检测结果显示(见图4-12),与实验对照组相比,200μmol/L H2O2过氧化损伤组吸光度(OD)值明显下降(P<0.01);与H2O2过氧化损伤组相比,补肾软坚方药组吸光度(OD)值增大,但与H2O2过氧化损伤组比较差异没有显著性(P=0.076)。
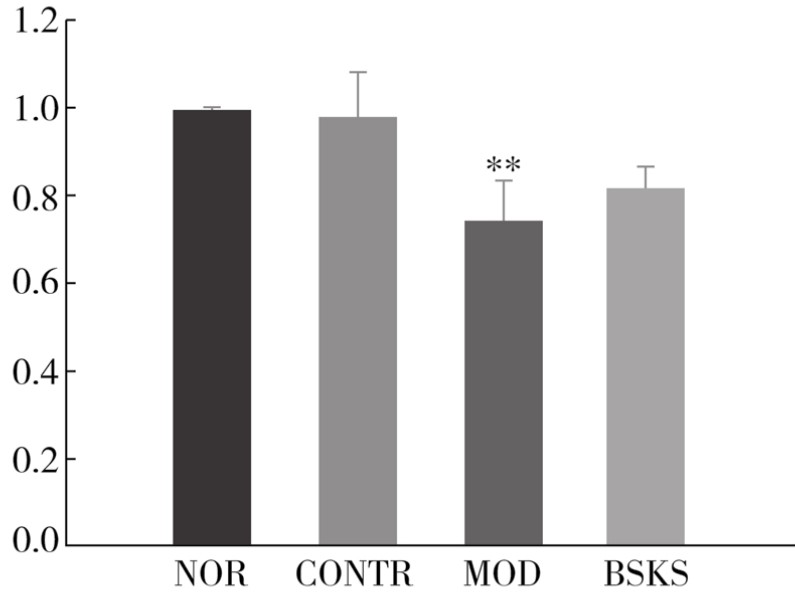
图4-12 补肾软坚方药对EA.hy926细胞活力的影响
注:空白对照组(NOR),实验对照组(CONTR),H2O2过氧化损伤组(MOD),补肾软坚方药组(BSKS)。与实验对照组(CONTR)比较,** P<0.01。
3.补肾软坚方药对EA.hy926细胞氧化应激损伤的保护作用 以10%补肾软坚方药含药血清孵育24h后,再以200μmol/L H2O2干预12h,以流式细胞术检测各组细胞的总抗氧能力。研究发现,与实验对照组相比,200μmol/L H2O2过氧化损伤组活性氧荧光强度明显升高(P<0.01);与H2O2过氧化损伤组相比,补肾软坚方药组保护组荧光强度明显减小(P<0.01)。(见附录,图4-13)
4.HO-1蛋白的表达 免疫荧光法结果发现(见附录,图4-14),空白对照组细胞内见少量HO-1阳性表达,实验对照组与H2O2过氧化损伤组没有明显差异。H2O2过氧化损伤组以200μmol/L H2O2干预12h后,大量细胞固缩为圆球状;补肾软坚方药含药血清孵育24h,再以200μmol/LH2O2干预12h时,视野内大量绿色荧光区域,在胞质内也有少量荧光阳性表达。
(三)讨论
AS的形成是一个由多因素参与的漫长复杂病理过程,氧化应激在AS的发生发展中具有重要的作用。当体内氧化/抗氧化水平失衡时,ROS增加,引起内皮细胞通透功能障碍及膜稳定性失衡,黏附分子、炎症因子等活跃表达,继而引发血管舒张功能障碍、血管重构等级联效应。HO是热休克蛋白家族中的一个成员,是一种体内广泛存在的抗氧化防御酶,HO-1是HO的一种同工酶。HO-1分解产物的抗氧化和细胞保护作用及其本身的可诱导性使得HO-1具有独特的抗氧化生理特性,并在AS的防治中发挥重要作用。在多种心血管疾病如心肌梗死、心肌缺血再灌注损伤和心力衰竭的研究中,采用药理学方法或基因方法促使HO-1蛋白表达增加能抑制心肌细胞损伤。曾有研究表明,芍药苷可通过激活Nrf-2/HO-1通路保护伽马辐射诱导的EA.hy926内皮细胞氧化应激损伤。
本研究发现,补肾软坚方药能够阻抑H2O2诱导的EA.hy926细胞活力下降,通过流式细胞术Anne-xin-V FITC/PI染色和ROS活性检测,发现补肾软坚方药能够显著抑制H2O2诱导的EA.hy926细胞过氧化损伤,补肾软坚方药的这种细胞保护效应可能由HO-1相关信号通路介导,并通过维持细胞抗氧化防御系统和活性氧之间的平衡状态调控氧化应激。
