补肾软坚方药干预动脉粥样硬化家兔血管内膜增生及血管外周脂肪组织炎症
AS是在动脉内膜受损的基础上,由于脂质和复合糖类沉积,继发纤维组织增生,导致动脉壁增厚、变硬和管腔缩小,进而影响组织供血的动脉硬化性疾病。动脉粥样硬化是一种严重危害人类健康的血管慢性炎症性病变,具有经典的炎症变性、渗出及增生特点。动脉粥样硬化内膜增生是多种原因引起血管狭窄、管壁增厚的病理反应过程,包括白细胞的黏附和聚集、血小板的聚集和激活、血管平滑肌细胞的增生和迁移、细胞外基质的溶解和重构。而细胞因子MMP在其病理过程中起了不可替代的作用。另外,积累在血管结构周围的脂肪组织称为PVAT,它围绕着除脑血管系统以外几乎所有血管外部,尤其是冠状动脉和主动脉。现在越来越多的研究表明,PVAT是肥胖相关心血管疾病(包括AS)的重要危险因素。本实验建立动脉粥样硬化兔内膜增生模型,探讨补肾软坚方药抗内膜增生、抗AS的作用机制及干预PVAT组织炎症的作用。以下分两个实验进行验证和探讨。
实验一 补肾软坚方药对血管内膜增生及PVAT脂肪细胞影响的观察
(一)材料与方法
1.动物 清洁级健康成年雄性新西兰大白兔,体重(2.2±0.2)kg。
2.主要试剂和药品 阿托伐他汀钙片,补肾软坚方药,戊巴比妥钠,油红O,TC试剂盒,TG试剂盒,HDL-L试剂盒,LDL-L试剂盒,苏木素-伊红染色试剂盒。
3.方法
(1)动物饲养及分组 选择清洁级健康成年雄性新西兰大白兔随机分为对照组、模型组、阿托伐他汀组、补肾软坚方药组(以下简称为补肾软坚组)。自第4周末开始,补肾软坚组、阿托伐他汀组新西兰兔分别给予补肾软坚方药和阿托伐他汀钙片,对照组、模型组新西兰兔给予等量生理盐水。
(2)动物一般情况观察 观察各组动物的皮毛颜色、光泽度,精神状态,呼吸快慢,饮食、粪便情况,体重变化,活动情况等。剔除那些体重下降或进食不佳者。
(3)标本收集处理 第12周末,检测血清TC、TG、HDL-C、LDL-C水平。留取带有血管外周脂肪包裹的胸主动脉,一部分进行HE染色,观察血管及PVAT病理变化,并计算中内膜厚度比;一部分进行免疫组化染色,检测其瘦素蛋白、TNF-α蛋白、MMP-9蛋白的表达情况。
4.统计学分析 实验所得数据均以平均数±标准差(x±s)表示,并采用SPSS 18.0统计软件对数据处理分析。多组比较采用单因素方差分析及LSD检验,P<0.05为差异有统计学意义。
(二)结果
1.动物饲养情况 实验中,对照组新西兰兔状态良好,毛色光泽,反应灵敏,进食及活动正常。模型组、阿托伐他汀组、补肾软坚组体重均逐渐增加,反应迟缓。剔除食欲减退严重、体重下降及血脂不稳定的新西兰兔。最终每组各6只新西兰兔。
2.血脂检测结果 与对照组相比,模型组TC、TG、LDL-C明显降低,HDL-C明显升高,差异非常显著(P<0.01)。与模型组相比,阿托伐他汀组TC、TG、LDL-C明显降低,HDL-C明显升高,差异非常显著(P<0.01);补肾软坚组TC、TG、LDL-C有所降低,HDL-C有所升高,差异无显著性(P>0.05)。(见表3-17,图3-20)
表3-17 各组新西兰兔血脂比较(x±s)(单位:mmol/L)
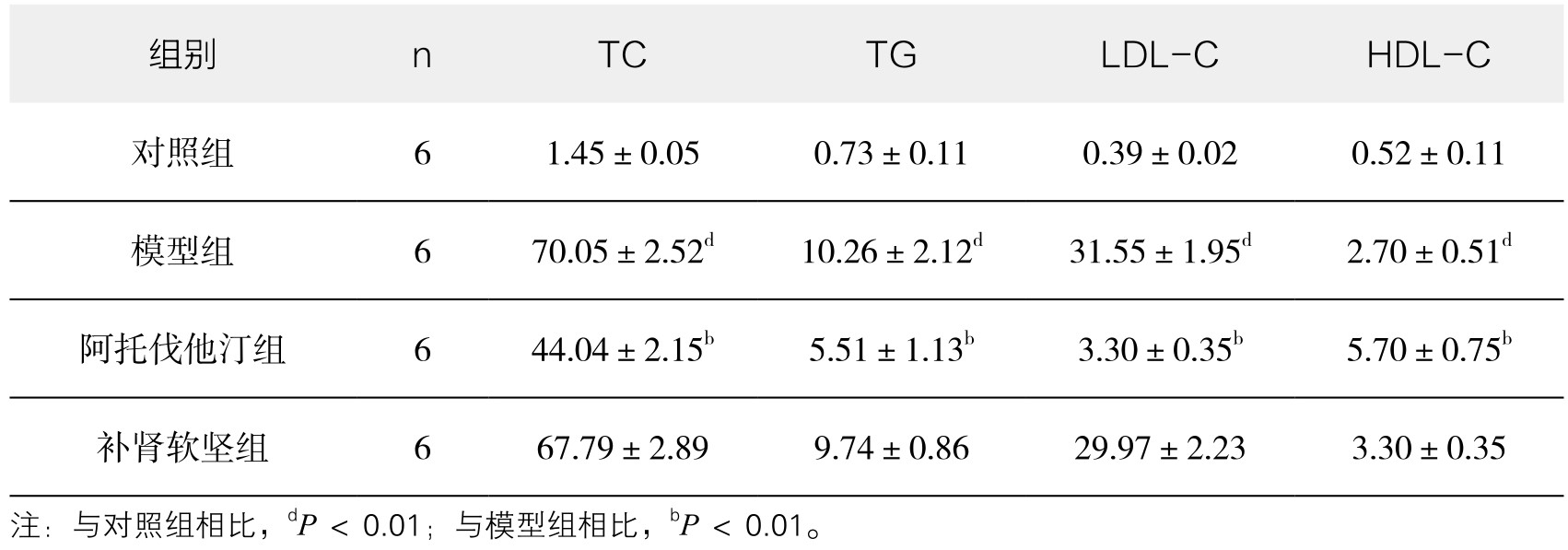

图3-20 各组新西兰兔血脂比较
注:与对照组相比,dP<0.01;与模型组相比,dP<0.01。
3.HE染色结果 对照组主动脉无明显异常,内膜光滑,内皮连续完整,中膜平滑肌排列规则整齐。模型组可见内皮不连续甚至缺失,内膜明显增厚,大量泡沫细胞堆积在整个管腔内部,向管腔内凸起,大量平滑肌细胞移行至内膜下或可见泡沫细胞及脂质沉积于内膜下形成脂质核心。与模型组相比,阿托伐他汀组内膜增生明显减轻,管腔表面有小面积泡沫细胞聚集,中膜平滑肌细胞排列紊乱,未见明显增殖和迁移。与模型组相比,补肾软坚组内膜轻度增厚,管腔表面泡沫细胞聚集面积减小,中膜平滑肌细胞排列紊乱,未见明显增殖和迁移。
4.内膜增生程度观察结果 与对照组相比,模型组中内膜厚度比增大,内膜明显增生,差异非常显著(P<0.01)。与模型组相比,阿托伐他汀组中内膜厚度比明显下降,内膜增生程度下降,差异非常显著(P<0.01);补肾软坚组中内膜厚度比下降,内膜增生程度下降,差异有显著性(P<0.05)。(见表3-18,图3-21)
表3-18 各组新西兰兔胸主动脉内膜增生程度比较(x±s)

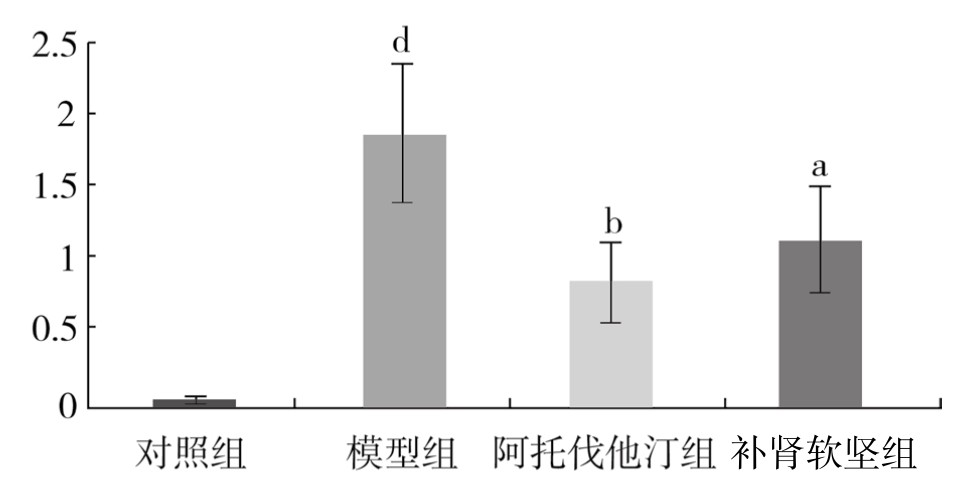
图3-21 各组新西兰兔胸主动脉内膜增生程度比较
注:与对照组相比,dP<0.01;与模型组相比,aP<0.05,bP<0.01。
5.PVAT脂肪细胞观察结果 镜下观察可见,对照组PVAT由大量群集的单泡脂肪细胞构成,呈蜂窝状结构,空泡状排列规则,细胞质、细胞核位于细胞一侧。脂肪细胞直径从小到大依次是:对照组、阿托伐他汀组、补肾软坚组、模型组。与对照组相比,模型组脂肪细胞直径增大,差异有显著性(P<0.05)。与模型组相比,阿托伐他汀组、补肾软坚组细胞直径减小,差异无显著性(P>0.05)。(见表3-19,图3-22)
表3-19 各组新西兰兔PVAT脂肪细胞直径比较(x±s)(单位:μm)
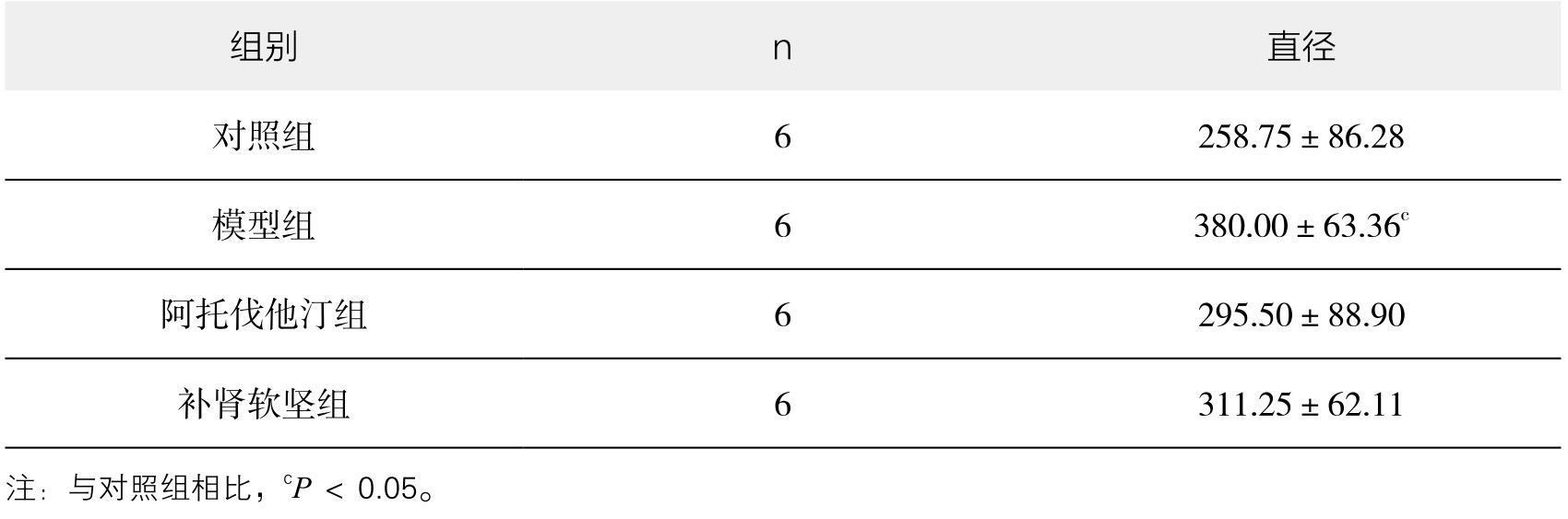
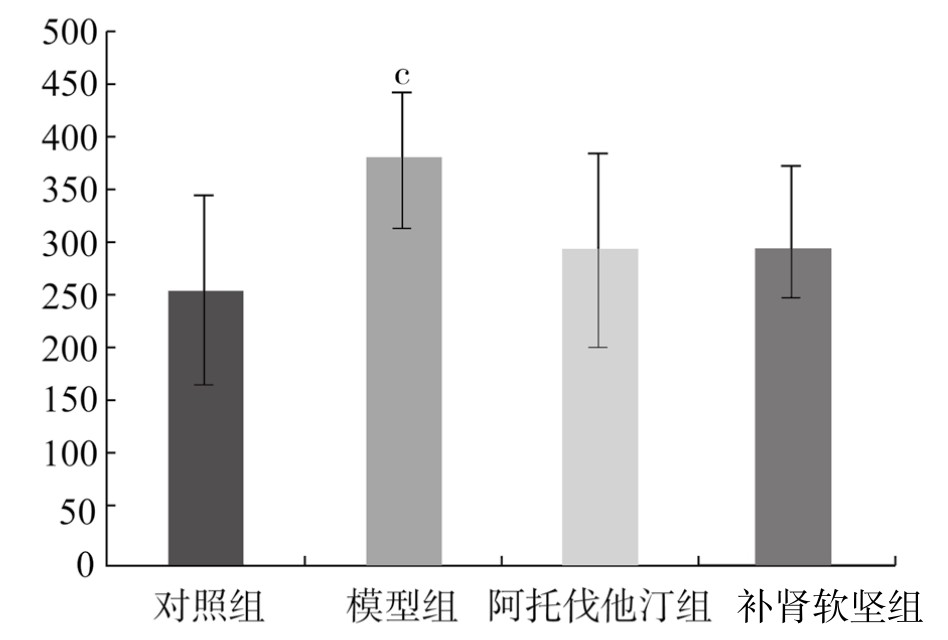
图3-22 各组新西兰兔PVAT脂肪细胞直径
注:与对照组相比,cP<0.05。
(三)讨论
本实验表明补肾软坚方药在调节血脂、内膜增生程度、PVAT脂肪细胞大小方面均起作用。其能够在一定程度上降低血清TC、TG、LDL-C水平,升高HDL-C水平,并减少内膜泡沫细胞聚集和平滑肌增殖、迁移,从而改善内膜的增生程度;并在一定程度上改善PVAT炎性浸润状况,减小脂肪细胞的直径,从而改善其增生、肥大。本实验结果阐明了补肾软坚方药能够改善PVAT脂肪细胞形态及内膜增生,具有抗AS作用。
实验二 补肾软坚方药对AS兔血管及PVAT炎症的影响
(一)材料与方法
1.动物 同第三章第四节论题二之实验一。
2.主要试剂和药品 TNF-αAntibody,Leptin Antibody,MMP-9 Antibody,Goat anti Mouse IgG(H+L)-HRP,Goat anti Rabbit IgG(H+L)-HRP,DAB显色试剂盒(AR1022)。
3.方法 免疫组化染色检测TNF-α蛋白、瘦素蛋白、MMP-9蛋白表达:将组织切片、脱蜡至水、灭活、修复、封闭、孵育一抗、孵育生物素化二抗、孵育SABC、DAB显色、复染。在镜下观察,有黄褐色颗粒表达的为阳性表达。在10×10倍显微镜下,自上而下、自左而右取5个互不重叠的视野。采用Image Pro Plus图像分析软件统计胸主动脉内膜中阳性染色面积占内膜面积百分数及PVAT组织阳性染色面积,均取其平均值。
4.统计学方法 实验所得数据均以平均数±标准差(x±s)表示,并采用SPSS 18.0统计软件对数据处理分析。多组比较采用单因素方差分析及LSD检验,P<0.05为差异有统计学意义。
(二)结果
1.免疫组化染色检测TNF-α蛋白表达结果 对照组血管组织内未见黄褐色颗粒表达。模型组增生的内膜中可见大量深褐色颗粒表达。与对照组相比,模型组阳性颗粒表达面积明显增加,差异非常显著(P<0.01)。与模型组相比,阿托伐他汀组阳性颗粒表达面积减小,差异有显著性(P<0.05);补肾软坚组阳性颗粒表达面积减小,差异有显著性(P<0.05)。(见表3-20,图3-23)
表3-20 各组新西兰兔胸主动脉TNF-α蛋白表达情况(x±s)(单位:%)
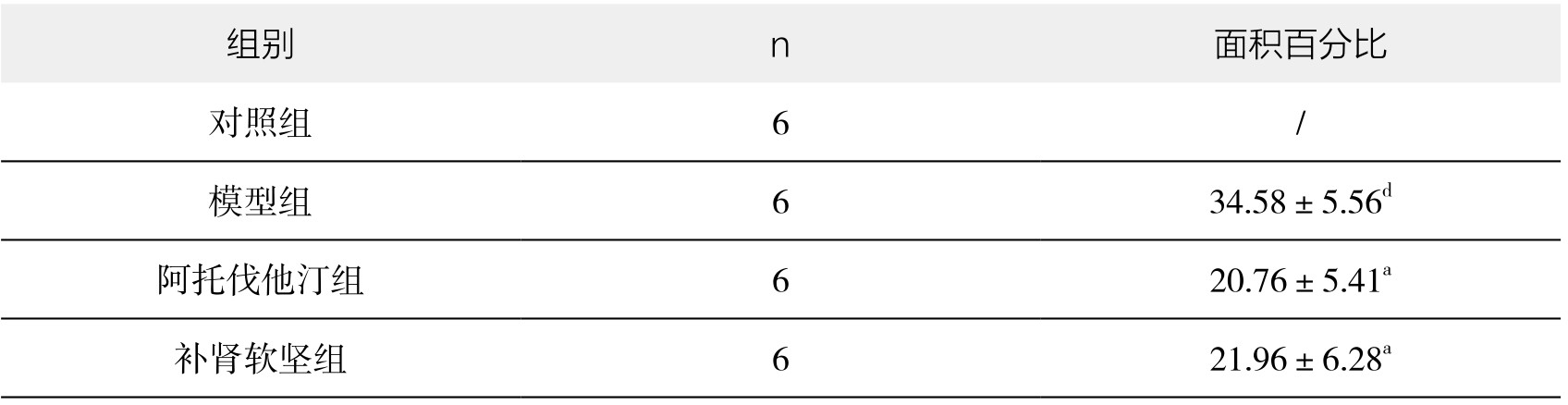
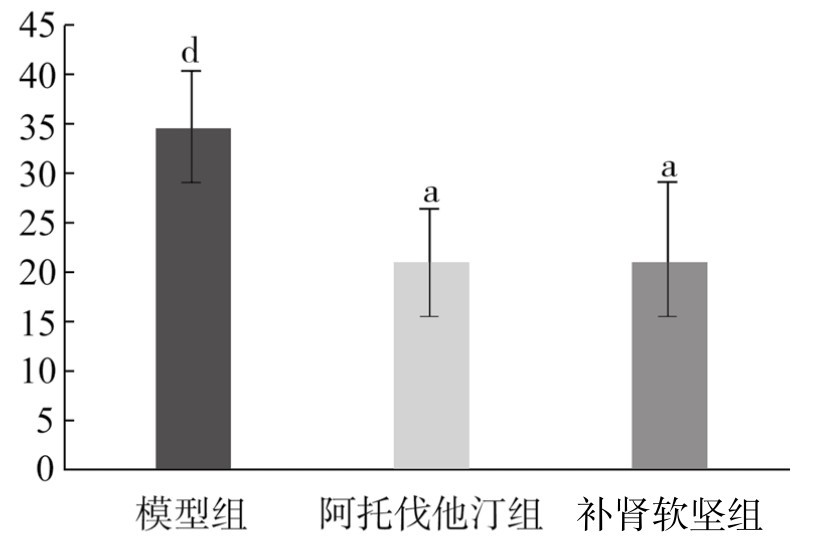
图3-23 各组新西兰兔胸主动脉TNF-α蛋白表达情况
注:与对照组相比,dP<0.01;与模型组相比,aP<0.05。
对照组PVAT脂肪细胞膜可见少量黄褐色颗粒表达。模型组PVAT脂肪细胞膜可见大量深褐色颗粒表达。与对照组相比,模型组阳性颗粒表达面积明显增加,差异非常显著(P<0.01)。与模型组相比,阿托伐他汀组阳性颗粒表达面积减小,差异有显著性(P<0.05);补肾软坚组阳性颗粒表达面积减小,差异有显著性(P<0.05)。(见表3-21,图3-24)
表3-21 各组新西兰兔PVAT组织TNF-α蛋白表达情况(x±s,单位:像素)

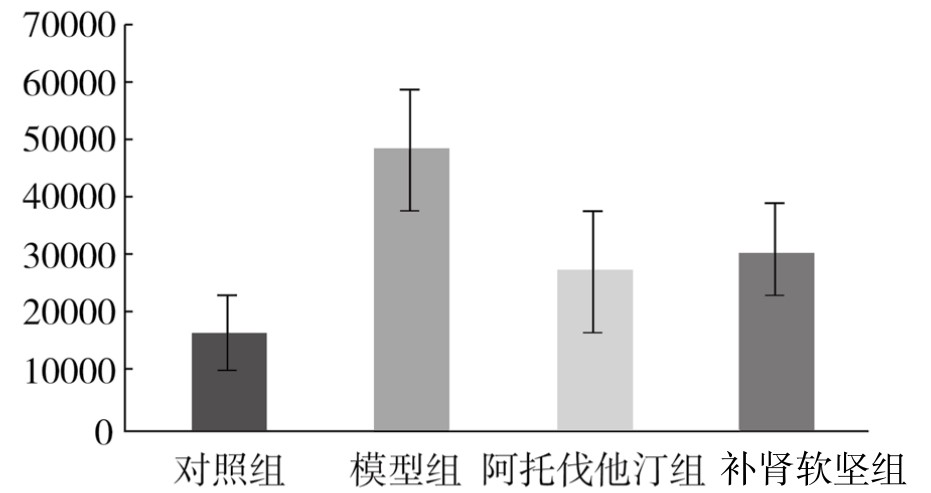
图3-24 各组新西兰兔PVAT组织TNF-α蛋白表达情况
注:与对照组相比,dP<0.01;与模型组相比,aP<0.05,bP<0.01。
2.免疫组化染色检测瘦素蛋白表达结果 对照组血管组织内膜可见少量黄色颗粒表达。模型组内膜可见大量深褐色颗粒表达,融合成片。与对照组相比,模型组阳性颗粒表达面积明显增加,差异非常显著(P<0.01)。与模型组相比,阿托伐他汀组阳性颗粒表达面积明显减小,差异非常显著(P<0.01);补肾软坚组阳性颗粒表达面积减小,差异有显著性(P<0.05)。(见表3-22,图3-25)
表3-22 各组新西兰兔胸主动脉瘦素蛋白表达情况(x±s,单位:%)

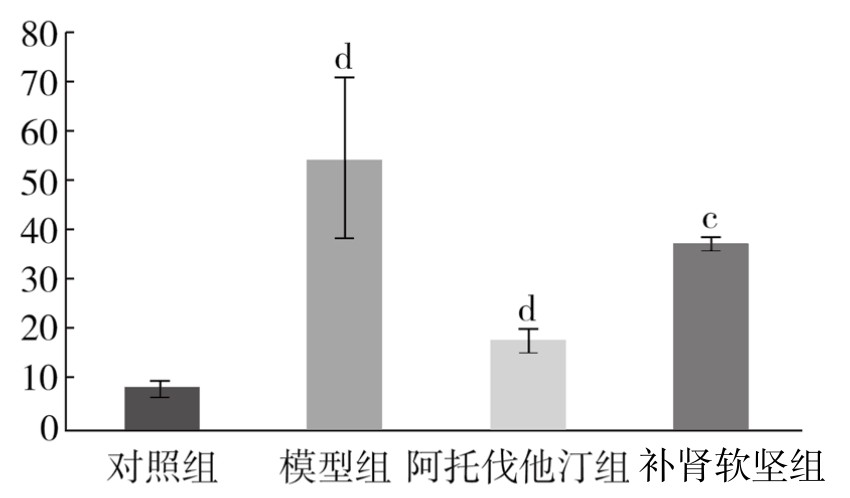
图3-25 各组新西兰兔胸主动脉瘦素蛋白表达情况
注:与对照组相比,dP<0.01;与模型组相比,aP<0.05,bP<0.01。
对照组PVAT脂肪细胞膜可见少量黄色颗粒表达。模型组PVAT脂肪细胞膜可见大量深褐色颗粒表达。与对照组相比,模型组阳性颗粒表达面积明显增加,差异非常显著(P<0.01)。与模型组相比,阿托伐他汀组阳性颗粒表达面积明显减小,差异非常显著(P<0.01);补肾软坚组阳性颗粒表达面积明显减小,差异非常显著(P<0.01)。(见表3-23,图3-26)
表3-23 各组新西兰兔PVAT组织瘦素蛋白表达情况(x±s,单位:像素)

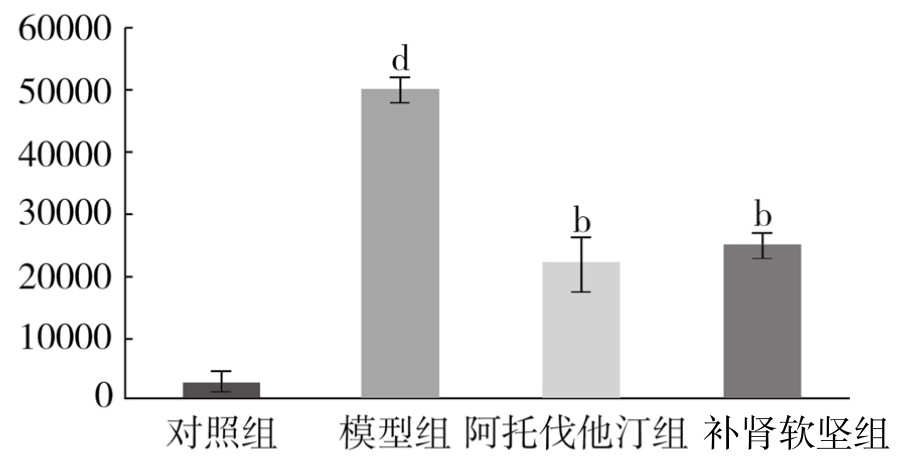
图3-26 各组新西兰兔PVAT组织瘦素蛋白表达情况
注:与对照组相比,dP<0.01;与模型组相比,bP<0.01。
3.免疫组化染色检测MMP-9蛋白免疫组化结果 对照组内膜未见明显褐色的MMP-9阳性表达,模型组增生的内膜中可见大量MMP-9阳性表达,呈深褐色。与对照组相比,模型组阳性颗粒表达面积明显增加,差异非常显著(P<0.01)。与模型组相比,阿托伐他汀组阳性颗粒表达面积减小,差异有显著性(P<0.05);补肾软坚组阳性颗粒表达面积减小,差异有显著性(P<0.05)。(见表3-24,图3-27)
表3-24 各组新西兰兔胸主动脉MMP-9蛋白表达情况(x±s,单位:%)

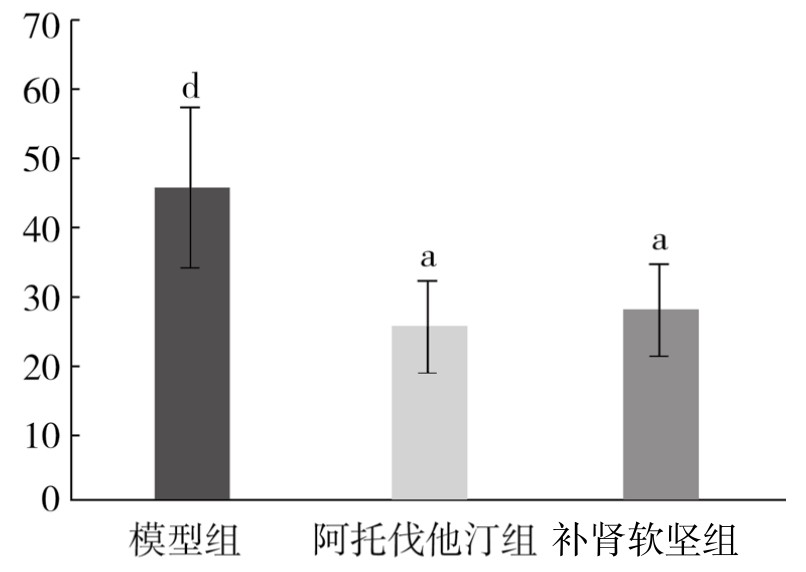
图3-27 各组新西兰兔胸主动脉MMP-9蛋白表达情况
注:与对照组相比,dP<0.01;与模型组相比,aP<0.05。
对照组PVAT脂肪细胞膜可见少量黄色颗粒表达。模型组PVAT脂肪细胞膜可见大量深褐色颗粒表达。与对照组相比,模型组阳性颗粒表达面积明显增加,差异非常显著(P<0.01)。与模型组相比,阿托伐他汀组、补肾软坚组阳性颗粒表达面积均减小,差异有显著性(P<0.05)。(见表3-25,图3-28)
表3-25 各组新西兰兔PVAT组织MMP-9蛋白表达情况(x±s,单位:像素)

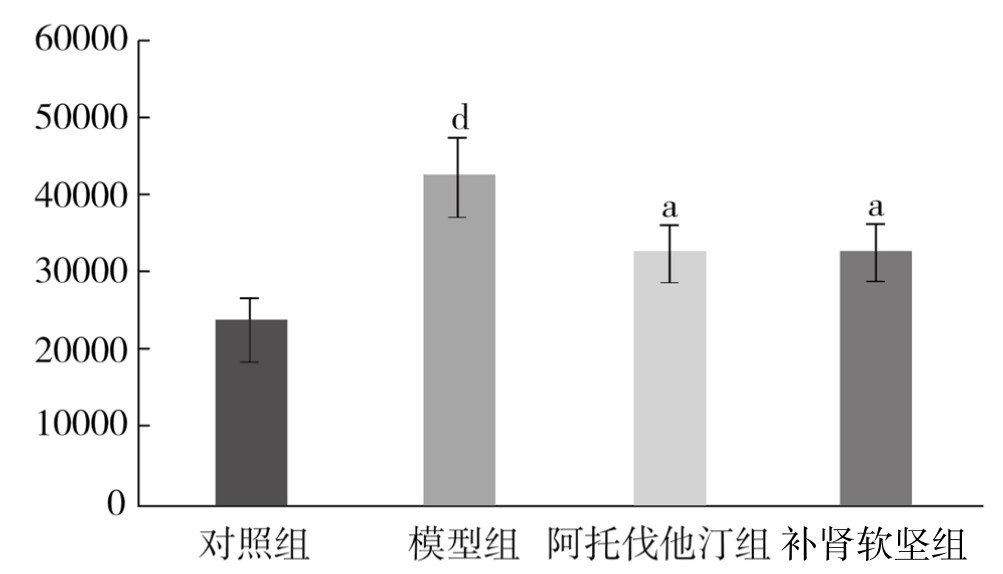
图3-28 各组新西兰兔PVAT组织MMP-9蛋白表达情况
注:与对照组相比,dP<0.01;与模型组相比,aP<0.05。
本实验表明,补肾软坚方药能够减少血管及PVAT中TNF-α蛋白、瘦素蛋白、MMP-9蛋白的表达:阐释了补肾软坚方药抗AS的机制是通过下调血管及PVAT炎性因子TNF-α和瘦素的表达,减少血管内源性及外源性MMP-9的分泌,从而起到改善AS内膜增生作用。
(三)讨论
补肾软坚方药在控制血脂、内膜增生程度、PVAT脂肪细胞大小方面均起作用。其能够在一定程度上降低血清TC、TG、LDL-C水平,升高HDL-C水平,并减少内膜泡沫细胞聚集和平滑肌增殖、迁移,从而改善内膜的增生程度;并在一定程度上改善PVAT炎性浸润状况,减小脂肪细胞的直径,从而改善其增生、肥大。本实验结果阐明了补肾软坚方药能够改善PVAT脂肪细胞形态及内膜增生,具有抗AS作用。
