补肾软坚方药单体二苯乙烯苷(TSG)对血管内皮细胞凋亡及内质网应激的调控研究
细胞凋亡是一个复杂的过程,多个细胞器参与其中,同时涉及多条细胞信号传送通路。内质网应激(ERS)是指由于某种原因导致细胞内质网稳态失衡、生理功能发生紊乱的一种亚细胞器的病理过程。ERS作为细胞水平的应激将AS形成的细胞机制与多种危险因素联系起来,并在细胞凋亡中起着重要的作用,贯穿AS发展全程。
科研团队前期运用补肾软坚方药治疗AS性疾病疗效肯定,动物实验表明可通过调节整体氧化应激和炎症反应而拮抗AS。那么,补肾软坚方药的抗AS作用是否还通过调节亚细胞水平的应激及其介导的血管内皮细胞凋亡而实现?
在以往实验的基础上,本实验应用ERS抑制剂4-苯基丁酸(4-PBA)作为阳性对照药,探讨补肾软坚方药单体成分二苯乙烯苷是否能够从ERS途径干预ox-LDL诱导的血管内皮细胞凋亡。
(一)材料与方法
1.细胞株 EA.hy926人脐静脉细胞融合细胞株。
2.主要试剂和药品 胎牛血清(FBS)、氧化低密度脂蛋白(ox-LDL)、噻唑蓝(MTT)、青霉素及链霉素混合液、乳酸脱氢酶(LDH)测定试剂盒、细胞凋亡与坏死检测试剂盒(Hoechst33342/PI)、Annexin-V-FLUOS染色试剂盒、人GRP78酶联免疫试剂盒。
3.方法
(1)细胞培养 同第四章第四节。
(2)细胞分组与处理 取对数生长期EA.hy926细胞均匀接种于96孔板或6孔板中,以含10%FBS的DMEM培养基培养24h,待细胞充分贴壁至融合状态时,置换含0.5%FBS的DMEM培养基继续培养24h,令细胞周期同步于G0/G1期。根据实验内容采取以下不同分组:
1)依据TSG对血管内皮细胞活力的影响,分为以下5组:
①Control组:置换含0.5%FBS的DMEM培养基继续培养24h。
②TSG(0.1μM)组:置换含0.5%FBS和0.1μM TSG的DMEM培养基继续培养24h。
③TSG(1μM)组:置换含0.5%FBS和1μM TSG的DMEM培养基继续培养24h。
④TSG(10μM)组:置换含0.5%FBS和10μM TSG的DMEM培养基继续培养24h。
⑤TSG(100μM)组:置换含0.5%FBS和100μM TSG的DMEM培养基继续培养24h。
2)依据4-PBA对血管内皮细胞活力的影响,分为以下6组:
①Control组:置换含0.5%FBS的DMEM培养基继续培养24h。
②4-PBA(1mM)组:置换含0.5%FBS和1mM 4-PBA的DMEM培养基继续培养24h。
③4-PBA(2mM)组:置换含0.5%FBS和2mM 4-PBA的DMEM培养基继续培养24h。
④4-PBA(3mM)组:置换含0.5%FBS和3mM 4-PBA的DMEM培养基继续培养24h。
⑤4-PBA(4mM)组:置换含0.5%FBS和4mM 4-PBA的DMEM培养基继续培养24h。
⑥4-PBA(5mM)组:置换含0.5%FBS和5mM 4-PBA的DMEM培养基继续培养24h。
3)依据TSG对ox-LDL干预下血管内皮细胞活力、LDH释放、细胞形态、细胞凋亡、GRP78蛋白表达的影响,分为以下7组:
①Control组:置换含0.5%FBS的DMEM培养基继续培养24h后,每孔加入同②-⑥组ox-LDL相应体积的含0.5%FBS的DMEM培养基,对细胞进行干预24h。
②ox-LDL组:置换含0.5%FBS的DMEM培养基继续培养24h后,根据实验所用培养板的大小,加入不同体积ox-LDL令其终浓度为100mg/mL,对细胞进行干预24h。
③TSG(0.1μM)组:置换含0.5%FBS和0.1μM TSG的DMEM培养基继续培养24h后,根据实验所用培养板的大小,加入不同体积ox-LDL令其终浓度为100mg/mL,对细胞进行干预24h。
④TSG(1μM)组:置换含0.5%FBS和1μM TSG的DMEM培养基继续培养24h后,根据实验所用培养板的大小,加入不同体积ox-LDL令其终浓度为100mg/mL,对细胞进行干预24h。
⑤TSG(10μM)组:置换含0.5%FBS和10μM TSG的DMEM培养基继续培养24h后,根据实验所用培养板的大小,加入不同体积ox-LDL令其终浓度为100mg/mL,对细胞进行干预24h。
⑥TSG(100μM)组:置换含0.5%FBS和100μM TSG的DMEM培养基继续培养24h后,根据实验所用培养板的大小,加入不同体积ox-LDL令其终浓度为100mg/mL,对细胞进行干预24h。
⑦4-PBA(1mM)组:置换含0.5%FBS和1mM 4-PBA的DMEM培养基继续培养24h后,根据实验所用培养板的大小,加入不同体积ox-LDL令其终浓度为100mg/mL,对细胞进行干预24h。
(3)MTT比色法检测细胞活力
①种板:取对数生长期的EA.hy926细胞以5×104个/mL密度接种于96孔板中,每组设5个复孔,每孔加入100μL含10%FBS的DMEM培养基培养24h;另设3个不种细胞的空白对照孔作为调零孔,实验中其他一切操作同Control组;96孔板最外围一圈孔弃去不用,以100μL/孔D-hanks溶液封边。
②同步化:待细胞贴壁并生长至融合状态后,弃旧液,D-hanks洗2遍,每孔加入100μL含0.5%FBS的DMEM培养基培养24h。
③给药:弃旧液,D-hanks洗2遍后,按“方法”(2)中分组情况给予各组不同处理。
④干预完毕后,弃上清液,D-hanks洗2遍,每孔加入含0.5mg/mL MTT的DMEM培养基100μL,在培养箱中(37℃、5%CO2)避光孵育4h。弃去MTT溶液,每孔加入150μL DMS充分溶解甲臜结晶。振荡器上充分振荡10min,在倒置显微镜下观察直到紫色结晶全部溶解,用酶标仪测定每孔在570nm波长处的吸光度(A)值,以空白对照孔调零。
⑤以Control组细胞活力为100%,各处理组细胞活力按此计算式计算细胞活力:
细胞活力(%)=(处理组OD570/Control组OD570)×100%
(4)IFCC法检测细胞培养上清液中LDH活性
①种板:取对数生长期的EA.hy926细胞以5×104个/mL密度接种于96孔板中,每组设6个复孔,每孔加入100μL含10%FBS的DMEM培养基培养24h;96孔板最外围一圈孔弃去不用,以100μL/孔D-hanks溶液封边。
②同步化:待细胞贴壁并生长至融合状态后,弃旧液,D-hanks洗2遍,每孔加入100μL含0.5%FBS的DMEM培养基培养24h。
③给药:弃旧液,D-hanks洗2遍后,按“方法”(2)中分组情况给予各组不同处理。
④干预完毕后,以各组中每2个孔中的上清液作为一个样品,将每2个孔中液体吸出至一个1.5mL离心管中,故每组有3个样品,每个样液体含量为200μL。
⑤常温下以800r/min离心5min,以去除上清液中含有的凋亡及坏死细胞;取离心后的上清液,使用日立全自动生化分析仪检测LDH活性。
(5)细胞凋亡的形态学观察 取对数生长期的EA.hy926细胞以5×104个/mL密度接种于96孔板中,每组设3个复孔,每孔加入100μL含10%FBS的DMEM培养基培养24h;96孔板最外围一圈孔弃去不用,以100μL/孔D-hanks溶液封边。待细胞贴壁并生长至融合状态后,弃旧液,D-hanks洗2遍,每孔加入100μL含0.5%FBS的DMEM培养基培养24h,令细胞周期同步于G0/G1期。弃旧液,D-hanks洗2遍后,按“方法”(2)中分组情况给予各组不同处理。干预完毕后,分别将细胞置于倒置相差显微镜和倒置荧光显微镜下观察细胞形态及凋亡坏死情况。各组细胞处理完毕后,分别进行倒置相差显微镜下观察细胞形态及以Hoechst33342/PI染色置于倒置荧光显微镜下检测细胞凋亡与坏死。
(6)流式细胞术测定细胞凋亡率 细胞以1.2×105个/mL密度接种于6孔板中,分为实验组5组[同“方法”(2)中分组情况]和校正组4组(①未染色组、②双染组、③单染Annexin V组、④单染PI组)。进行培养、同步化、给药、取细胞孵育液等操作。将2.2mL细胞孵育缓冲液、44μL Annexin-V-FLUOS染色液、44μL PI染色液加入一个EP管,避光混匀;然后实验组和校正组②,每个EP管中加100μL混合好的染色液重悬细胞;校正组①不做染色处理;校正组③的EP管中用100μL细胞孵育缓冲液重悬细胞,加入2μL Annexin-V-FLUOS染色液,混匀;校正组④的EP管中用100μL细胞孵育缓冲液重悬细胞,加入2μL PI染色液,混匀;继而在15℃~25℃下避光孵育10~15min,每106个细胞添加0.5mL的细胞孵育缓冲液,30min内上机检测凋亡细胞百分比。
(7)ELISA法测定细胞内GRP78蛋白含量 细胞培养、给药、消化、离心、裂解、离心获取待测样品,按试剂盒说明书操作,获得各浓度标准品,制作标准曲线,依次加样,孵育,最终获得各孔板OD值。
4.统计学方法 计量资料数据均以x±s表示,多组间比较采用单因素方差分析,各组间两两比较采用q检验。运用SPSS 13.0软件进行数据处理,所有的统计检验均采用双侧检验,P<0.05为差异有显著性。
(二)结果
1.TSG对血管内皮细胞活力的影响 从表4-7和图4-40可以看出,0.1~100µM TSG能够轻度增强血管内皮细胞活力或对细胞活力无明显影响,但差异均无显著性(P>0.05)。实验重复3次,结果趋势相同,故选择0.1μM、1μM、10μM、100μM浓度的TSG进行后续实验。
表4-7 不同浓度TSG对血管内皮细胞活力的影响(x±s,n=5)
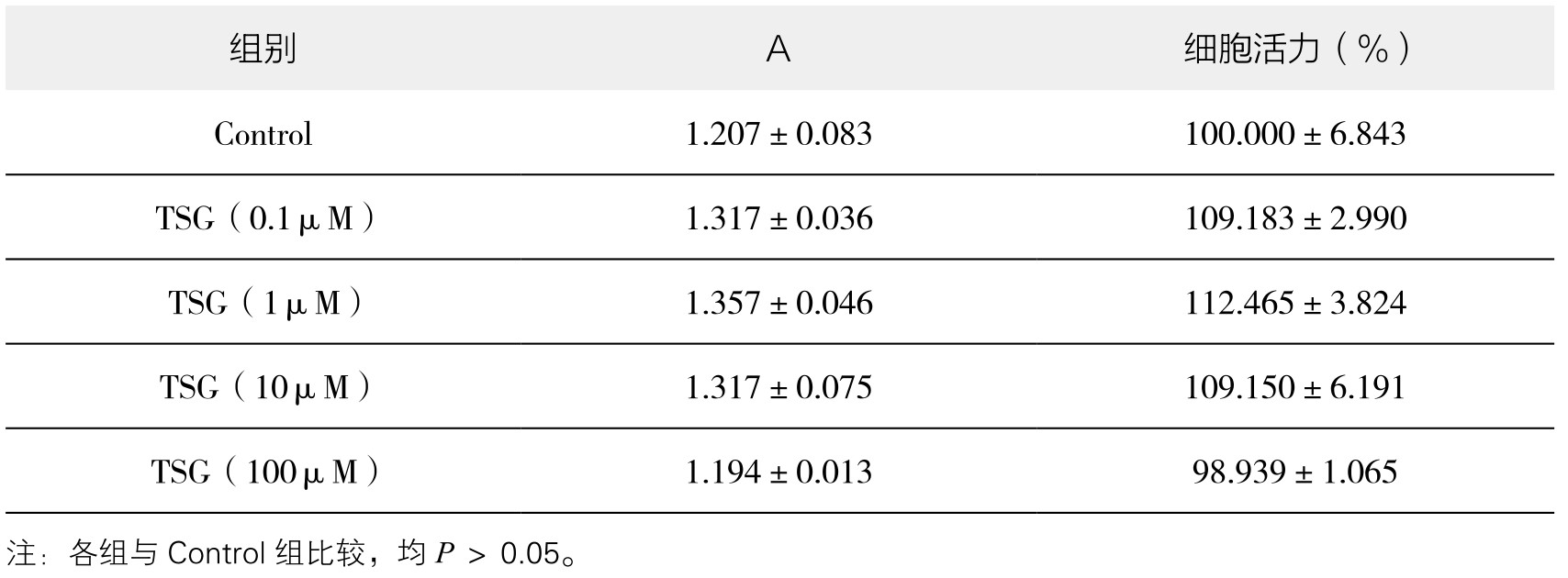
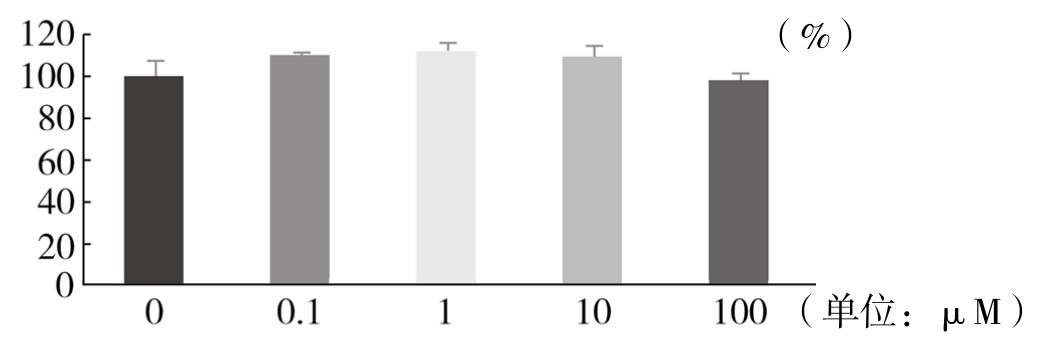
图4-40 不同浓度TSG对血管内皮细胞活力的影响
注:各组与Control组比较,均P>0.05。
2.4-PBA对血管内皮细胞活力的影响 从表4-8和图4-41可以看出,与Control组比较,1~5mM 4-PBA均不同程度地降低了血管内皮细胞的活力,其中3~5mM 4-PBA对细胞活力有抑制作用,差异有显著性(P<0.05或P<0.01),而1~2mM 4-PBA作用后细胞活力较Control组差异不显著(P>0.05)。实验重复3次,结果趋势相同,故选择对内皮细胞活力影响最小的1mM浓度的4-PBA进行后续实验。
表4-8 不同浓度 4-PBA 对血管内皮细胞活力的影响(x±s,n=5)
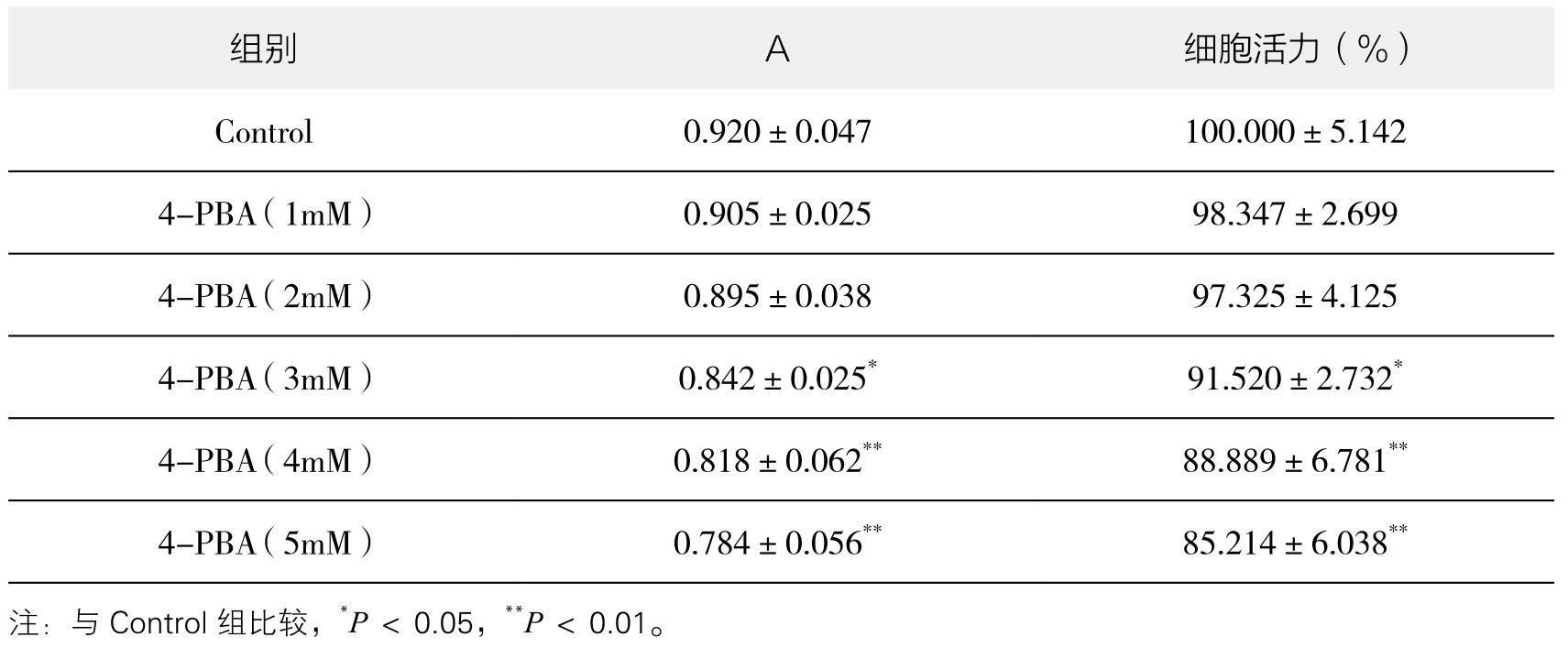

图4-41 不同浓度4-PBA对血管内皮细胞活力的影响
注:与Control组比较,*P<0.05,**P<0.01。
3.对ox-LDL干预下血管内皮细胞活力的影响 从表4-9和图4-42可以看出,与ox-LDL组相比,10µM、100µM TSG+ox-LDL组和1mM 4-PBA+ox-LDL组能够增强血管内皮细胞活力,差异有显著性(P<0.05或P<0.01)。1µM、10µM TSG+oxLDL组与4-PBA+ox-LDL组对内皮细胞活力的保护效应相近,差异不显著(P>0.05)。100µM TSG+ox-LDL组对内皮细胞活力的保护效应优于1mM 4-PBA+ox-LDL组,差异有显著性(P<0.05)。实验重复3次,结果趋势相同,说明TSG剂量依赖性地对ox-LDL诱导的血管内皮细胞活力减低具有保护作用。
表4-9 不同浓度TSG对ox-LDL诱导的血管内皮细胞活力的影响(x±s,n=5)

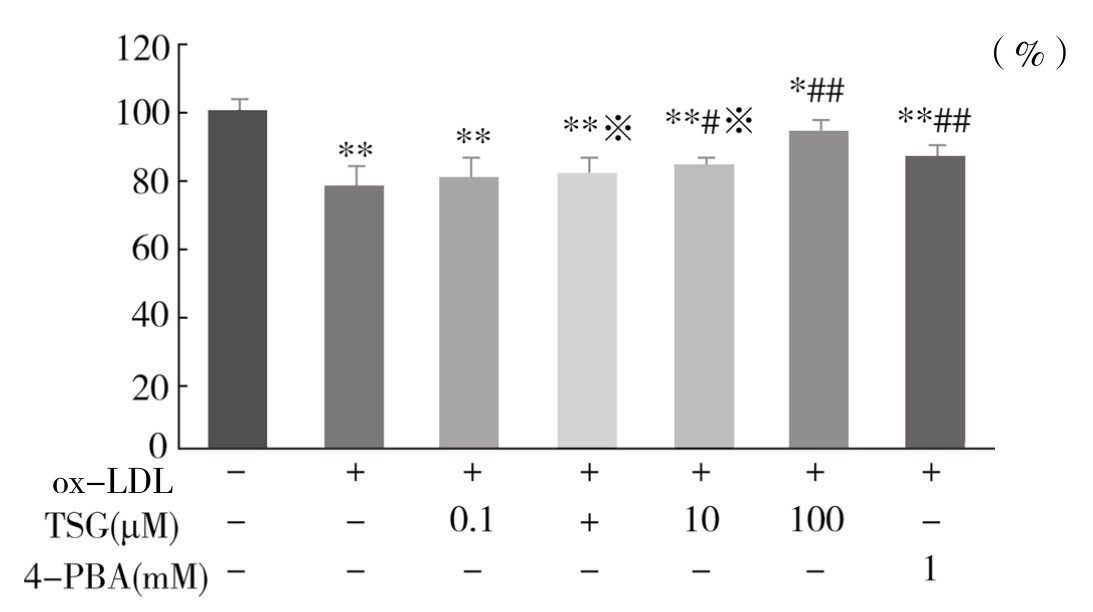
图4-42 不同浓度TSG对ox-LDL诱导的血管内皮细胞活力的影响
注:与Control组比较,*P<0.05,**P<0.01;与ox-LDL组比较,#P<0.05,##P<0.01;与4-PBA(1mM)+ox-LDL组比较,※P>0.05。
4.TSG对ox-LDL干预下血管内皮细胞损伤的影响 从表4-10和图4-43可以看出,与ox-LDL组相比,1µM、10µM、100µM TSG+ox-LDL组和1mM 4-PBA+ox-LDL组能够减少细胞培养上清液中LDH的释放,差异非常显著(P<0.01)。100µM TSG+ox-LDL组和4-PBA+ox-LDL组拮抗内皮细胞毒性的效应相近,差异不显著(P>0.05)。实验重复3次,结果趋势相同,说明TSG对ox-LDL诱导的血管内皮细胞损伤具有一定保护作用,且具有剂量依赖性。
表4-10 不同浓度TSG对ox-LDL诱导的血管内皮细胞 LDH释放的影响(x±s,n=3)

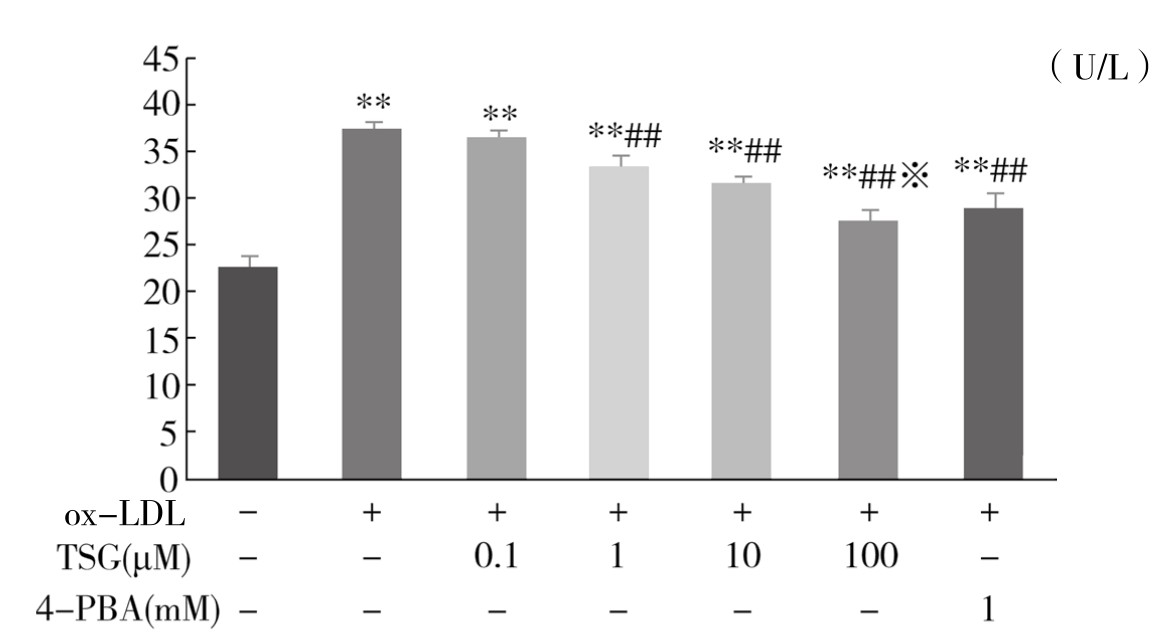
图 4-43 不同浓度TSG对ox-LDL诱导的血管内皮细胞LDH释放的影响
注:与Control组比较,**P<0.01; 与ox-LD组比较,##P<0.01; 与4-PBA(1mM)+ ox-LDL组比较,※P>0.05。
5.TSG干预ox-LDL诱导的血管内皮细胞凋亡的形态学观察
(1)倒置相差显微镜下观察细胞形态 倒置相差显微镜下,ox-LDL组细胞数目较Control组明显减少,细胞皱缩变圆,细胞间隙变大,细胞碎片增多。用不同浓度TSG和4-PBA预处理后,均能不同程度地改善ox-LDL造成的细胞损伤形态,且随着TSG浓度增加,细胞数目逐渐增多,细胞形态逐渐趋于规则饱满。(见图4-44)

图4-44 TSG对ox-LDL诱导的血管内皮细胞形态的影响(200×)
(2)倒置荧光显微镜下以Hoechst33342/PI染色检测细胞凋亡与坏死 经Hoechst 33342/PI染色后,于倒置荧光显微镜下观察内皮细胞的凋亡情况。用氪激光(紫外线)激发后,Control组的细胞核形态大小较为一致,呈浅蓝淡染的椭圆形,oxLDL组可见细胞核固缩,呈致密浓染、亮蓝色的颗粒状结构。用不同浓度TSG和4-PBA预处理后再进行ox-LDL孵育,呈固缩状态的细胞核数明显减少。随着TSG浓度增加,细胞数逐渐增多,亮蓝致密浓染的颗粒状结构减少,0.1μM TSG+oxLDL组与ox-LDL组的细胞形态差异不明显,在100μM TSG+ox-LDL组中,大部分细胞染色质呈均匀的低密度蓝光。用连续波氩激光(绿色光)激发后,Control组细胞核呈淡红色荧光或不被PI着色,而ox-LDL组细胞核出现致密浓染、亮红色荧光。随着TSG浓度增加,亮红致密浓染的颗粒状结构逐渐变淡减少,反映坏死细胞减少。表明TSG和4-PBA作用后能够不同程度抑制ox-LDL诱导的内皮细胞凋亡及坏死。
6.TSG干预ox-LDL诱导的血管内皮细胞凋亡率测定 流式细胞仪检测结果为散点图。从表4-11、图4-45、附录图4-46和附录图4-47可以看出,与Control组相比,ox-LDL组血管内皮细胞存活率明显下降,早期凋亡率明显增高,差异有显著性(P<0.01);与ox-LDL组相比,TSG+ox-LDL的4个浓度组和4-PBA+ox-LDL组均能增加存活细胞数量,降低内皮细胞早期凋亡率,差异有显著性(P<0.01)。10µM、100µM TSG+ox-LDL组与4-PBA+ox-LDL组对内皮细胞存活率、细胞早期和晚期凋亡率改善效果的差异不显著(P>0.05),但100µM TSG+ox-LDL组有优于4-PBA+ox-LDL组的趋势。100µM TSG+ox-LDL组与4-PBA+ox-LDL组内皮细胞早期凋亡率与Control组相比,差异均不显著(P>0.05);100µM TSG+ox-LDL组细胞存活率和总死亡率与Control组相比,差异均不显著(P>0.05);4-PBA+ox-LDL组细胞存活率和总死亡率与Control组相比,差异均有显著性(P<0.05)。实验重复3次,结果趋势相同,说明TSG剂量依赖性地对ox-LDL诱导的血管内皮细胞早期凋亡具有保护效应,且作用不弱于4-PBA,体现了一定优势。
表4-11 不同浓度TSG对ox-LDL诱导的血管内皮细胞凋亡率的影响(%,x±s,n=3)

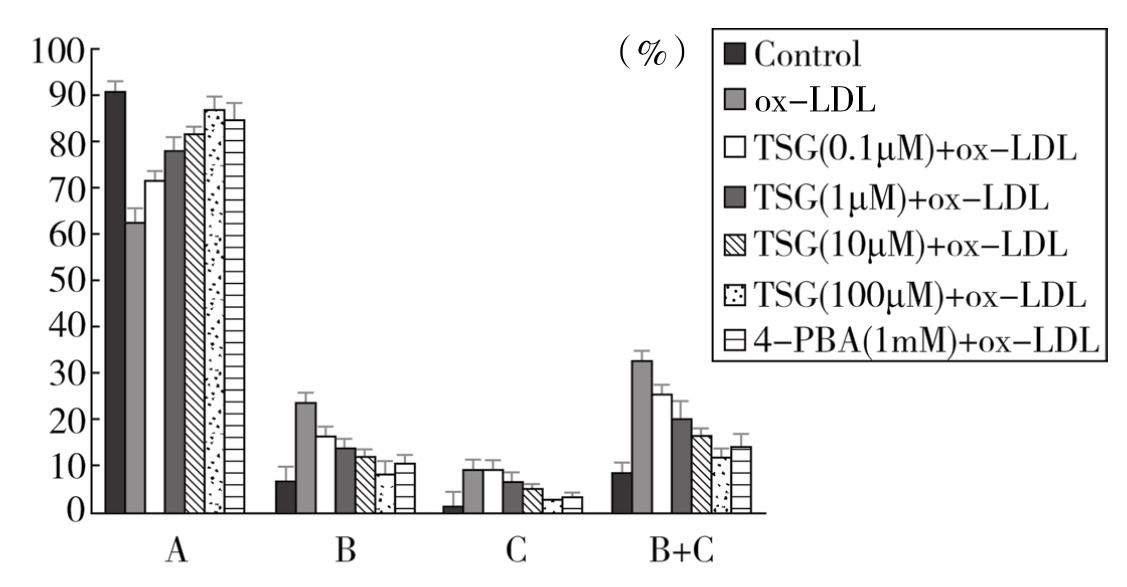
图4-45 不同浓度TSG对ox-LDL诱导的血管内皮细胞凋亡率的影响
注:A为活细胞,B为早期凋亡细胞,C为晚期凋亡和坏死细胞,B+C为总死亡细胞。
7.TSG对ox-LDL诱导的血管内皮细胞ERS标志蛋白GRP78表达的影响 从表 4-12 和图4-48可以看出,与Control组比较,ox-LDL组GRP78蛋白表达明显增加,差异具有显著性(P<0.01)。不同浓度TSG和4-PBA均可不同程度抑制GRP78蛋白表达,其中TSG(100μM)+ox-LDL组与4-PBA(1mM)+ox-LDL组比较,作用相似,差异不显著(P>0.05)。实验重复3次,结果趋势相同。
表4-12 不同浓度TSG对ox-LDL诱导的血管内皮细胞GRP78蛋白表达的影响(x±s,n=6)

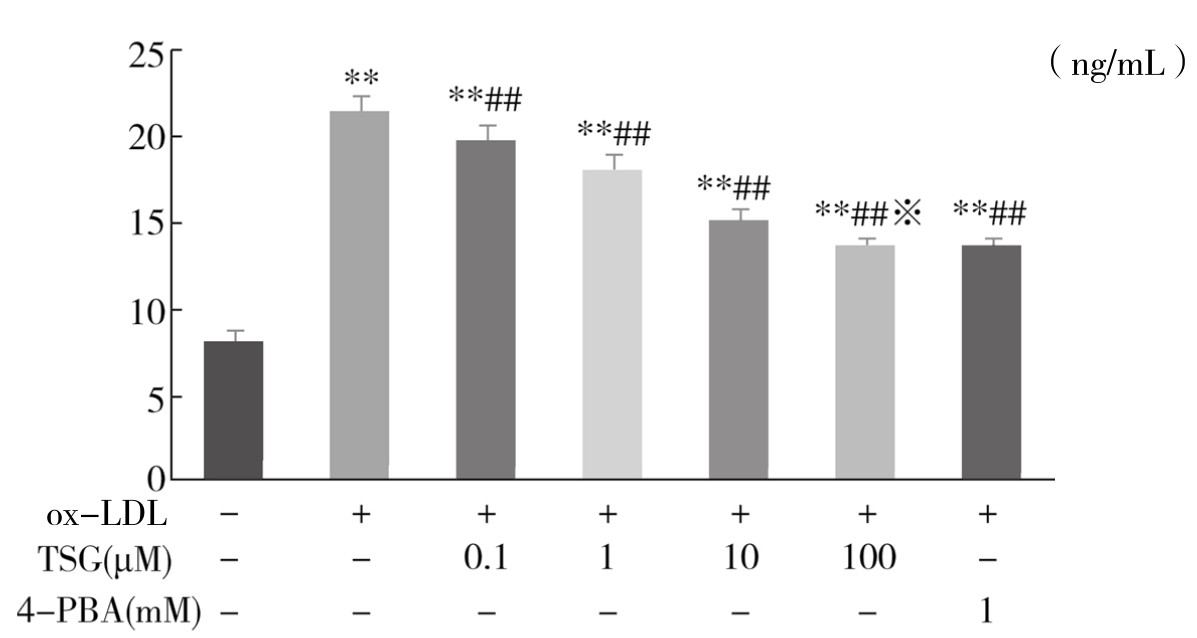
图4-48 不同浓度TSG对ox-LDL诱导的血管内皮细胞GRP78蛋白表达的影响
注:与Control组比较,**P<0.01; 与ox-LD组比较,##P<0.01; 与4-PBA(1mM)+ ox-LDL组比较,※P>0.05。
(三)讨论
动脉粥样硬化(AS)是中老年人普遍存在的一种病变,也是缺血性心脑血管疾病共同的病理基础,其本质是人类随年龄的增长而出现的一种不可避免的动脉管壁退行性病理变化。关于AS的治疗,近年来,研究热点已从减小或消除斑块,转而聚焦到如何稳定易损斑块及防止其破裂所引发的更加严重的问题。中医“治未病”的预防思想包括两部分——未病先防和既病防变,是千百年来指导人们防病治病的重要原则之一。如果说强调稳定斑块比消退斑块更为迫切是对AS“既病防变”的合理诠释,那么如何在“未病先防”的思想指导下对本病进行相关探索可能不失为中医药研究的另一良途。即:“病”指AS斑块已成形,此时治疗应从稳定斑块入手;而在AS发生早期斑块尚未完全成形之际,就运用中医药理论和方法对其进行干预以逆转或延缓本病的发展,亦是很有潜力但尚未得到足够重视的研究方向。
随着分子心血管病学的深入研究,越来越多的资料表明,细胞凋亡是多种心血管病发生与演变的细胞学基础。研究表明,血管内皮细胞凋亡促进斑块形成,在AS早期起重要作用。目前已经确定的细胞凋亡信号转导途径主要有3条:死亡受体通路、线粒体通路和内质网通路。其中,对ERS与AS中细胞凋亡的关系研究以平滑肌和巨噬细胞凋亡为主,属于中医“既病防变”的治未病思想,对ERS与早期AS内皮细胞凋亡之间的相关性尚缺乏深入探讨。本研究选取血管内皮细胞作为研究对象,提出在AS发生早期注意保护内皮细胞、防止其过度凋亡以干预斑块形成的重要意义,属于“未病先防”的治未病思想,以期为更好地防治AS提供新的思路和方法。同时本实验结果表明,TSG安全作用浓度范围在0.1~100μM之间。不同浓度TSG预孵育后可剂量依赖性地拮抗ox-LDL造成的细胞毒性作用,改善细胞形态,具有明显抗ox-LDL诱导的血管内皮细胞凋亡的作用,并能够显著抑制GRP78蛋白表达,且作用不弱于4-PBA,体现了一定优势。初步表明TSG抗ox-LDL诱导的血管内皮细胞凋亡的作用机制与ERS途径有关。
