补肾软坚方药影响内皮细胞HO-1相关氧化应激水平的研究
以动脉粥样硬化(AS)为病理基础的心脑血管疾病是目前发病率和病死率最高的疾病,氧化应激是动脉粥样硬化重要的发病机制之一。血红素氧合酶-1(HO-1)相关信号通路在许多疾病尤其是动脉粥样硬化性疾病中起着重要的保护作用,HO-1诱导表达具有很强的细胞氧化应激保护作用,被认为是最基本的内源性保护机制。已有研究表明HO-1在体内和体外均有表达,并能够抑制血管平滑肌细胞(VSMC)的增殖及血管再狭窄的形成。前期研究表明,补肾软坚方药介导的脑保护作用与其上调HO-1活性密切相关。本研究分离培养乳兔主动脉内皮细胞(RaECs),通过不同浓度的HO-1抑制剂锌原卟啉(Znpp-IX)处理RaECs,预处理24h后再以补肾软坚方药含药血清干预72h,检测HO-1/CO信号通路相关蛋白,探讨补肾软坚方药在体外培养RaECs中对HO-1/CO信号通路的干预效应,为补肾软坚方药临床应用提供科学依据。
(一)材料与方法
1.实验动物与细胞 RaECs来源于2周龄雄性日本大耳白兔。
2.药物与试剂 补肾软坚方药,胶原酶I(Collagenase Ⅱ)、L- 谷氨酰胺(L-glutamine)、多聚赖氨酸(Poly-L-Lysine)、锌原卟啉(Znpp-IX),羊HO-1多克隆抗体(sc-7695)、驴抗羊FITC-IgG(sc-2024),HO-1、单核细胞趋化蛋白-1(MCP-1)、基质金属蛋白酶-2(MMP-2)、基质金属蛋白酶-9(MMP-9)、P-选择素(P-selection)ELISA试剂盒。
3.方法
(1)补肾软坚方药含药血清制备 同第二章第三节。
(2)原代细胞分离及培养 取2周龄日本大耳白兔胸主动脉,剥去外膜,纵向剪开血管,内膜面向下铺入2g/LⅠ型胶原酶、2g/LⅡ型胶原酶,2g/LⅢ型胶原酶和2g/LⅣ型胶原酶、0.25%胰蛋白酶混合消化液中(按1∶1∶1∶1∶4混合)于37℃、5% CO2培养箱中消化约20min,按1∶1加入培养基以终止消化。轻轻刮下内膜层细胞,将细胞悬液离心,用DMEM培养液混匀沉淀细胞,吹打分散至单个细胞培养,24h贴壁,48h后首次半定量换液,去除部分细胞碎片和未能贴壁的细胞,再按1∶2分瓶传代培养。采用倒置相差显微镜观察细胞培养结果。
(3)MTT法检测细胞活力 取对数生长期RaECs,以4×104/mL密度接种于96孔板中,每孔100μL。培养24h后,分别以5%、10%、20%补肾软坚方药含药血清干预24h、48h、72h、96h,于各浓度及时间点干预完毕后,各孔加入0.5% MTT培养4h,弃上清液,每孔内加入DMSO,振荡10min溶解沉淀,酶联免疫检测仪在490nm波长处测定其吸光度值(OD值)。细胞存活率(%)=处理组OD值/对照组OD值×100%。每组设3个复孔,实验重复3次。
(4)细胞分组及药物处理 直径14mm圆盖玻片以浓硫酸浸泡并过夜,清洗,烘干后进行高压消毒,置于24孔细胞培养板中,以0.1%(w/v)多聚赖氨酸包被。RaECs常规培养于含10%胎牛血清的M199培养基中,置于37℃、5% CO2培养箱中。细胞融合80%~90%时进行传代,取对数生长期细胞接种于放置圆盖玻片的24孔培养板中给予干预。以DMSO溶解Znpp-IX,避光配制成浓度为10mmol/L的母液,加入无血清培养基中,使Znpp-IX终浓度分别为1μmol/L、10μmol/L、100μmol/L。实验分组如下:①空白对照组:10%FBS正常培养细胞;②实验对照组:10%兔正常血清培养细胞;③ZnppIX组(包含1μmol/L组、10μmol/L组、100μmol/L组):RaECs以不同浓度Znpp-IX孵育24h后再以10%补肾软坚方药含药血清干预72h。
4.标本检测项目
(1)酶联免疫吸附法测定HO-1、MCP-1、MMP-2、MMP-9、P-选择素 收集1μmol/L、10μmol/L、100μmol/L Znpp-IX干预24h后的细胞上清液,检测HO-1水平;收集Znpp-IX孵育24h后再以10%补肾软坚方药含药血清干预72h后的细胞上清液检测HO-1水平;收集10μmol/L、100μmol/L Znpp-IX孵育24h后,再以10%补肾软坚方药含药血清干预72h后的细胞上清液,检测MCP-1、MMP-2、MMP-9、P-选择素水平,步骤严格按照说明书进行。
(2)荧光免疫染色 置有细胞爬片的24孔板吸取完上清液后,小心用镊子将爬片取出,用玻璃胶粘贴于载玻片上,细胞面向上。将玻片置于37℃ PBS中洗3次,每次3~5s,然后在4%多聚甲醛中固定15min;PBS漂洗;1%BSA封闭30min;加入1% BSA稀释的羊HO-1多克隆抗体,置于保湿盒中于4℃杂交过夜;PBS漂洗;加入1% BSA稀释的驴抗羊FITC-IgG于室温杂交3h;PBS漂洗后用30%的甘油封片,于荧光共聚焦扫描显微镜下观察荧光物质的强度,激发波长495nm,发射波长525nm,并照相。
5.统计学方法 所得数据以均数±标准差(x±s)表示,采用SPSS 18.0统计软件包进行统计学处理。计量资料多组间比较采用单因素方差分析。
(二)结果
1.补肾软坚方药对细胞活性的影响 从图4-5中可以看出,5%、10%、20%三种浓度补肾软坚方药含药血清作用于RaECs后,均无细胞毒性作用,且在72h表现出良好的促生长效应,10%含药血清对RaECs的细胞活性效应高于5%、20%组,数据显示10%补肾软坚方药含药血清具有最佳的促RaECs增殖的作用。
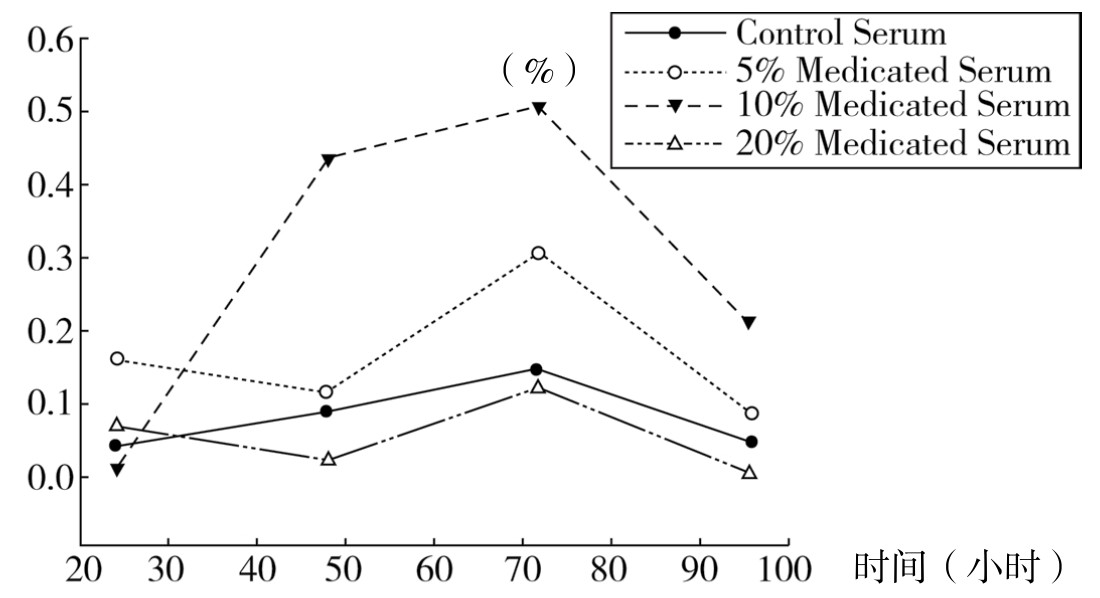
图4-5 补肾软坚方药对细胞活性的影响
2.HO-1水平,MCP-1、MMP-2、MMP-9、P-选择素表达水平 分别以1μmol/L、10μmol/L、100μmol/L Znpp孵育RaECs 24h后,三种浓度的Znpp-IX均能够抑制HO-1酶的水平,1μmol/L Znpp-IX孵育组与Znpp未孵育组比较,HO-1水平差异具有显著的统计学意义(P<0.05)。(见图4-6)
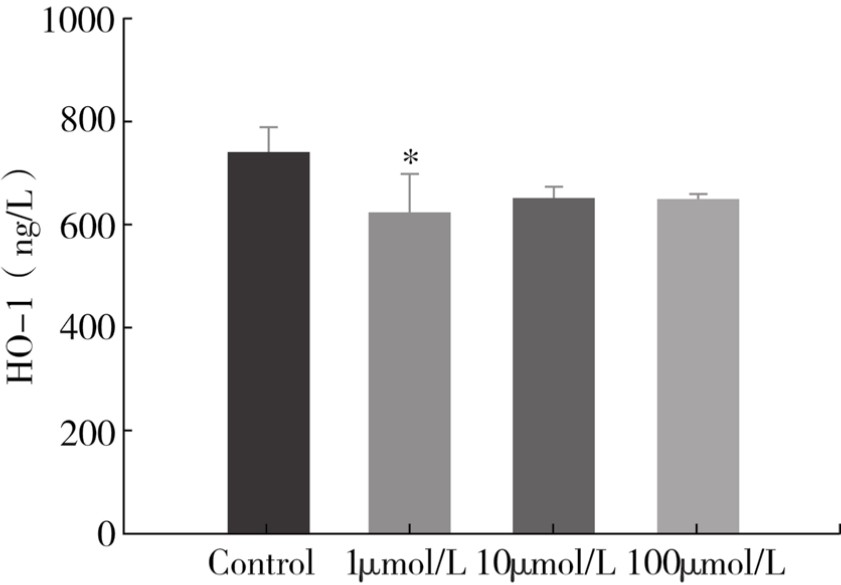
图4-6 Znpp-IX孵育RaECs 24h后HO-1水平
注:*与对照组(Control)比较,P<0.05。
分别以1μmol/L、10μmol/L、100μmol/L Znpp-IX孵育RaECs 24h后,再以10%补肾软坚方药含药血清干预72h。结果显示(见图4-7,BSKS示以10%补肾软坚方药含药血清干预后),与空白组血清比较,10%含药血清提高了100μmol/L Znpp-IX组的HO-1水平。
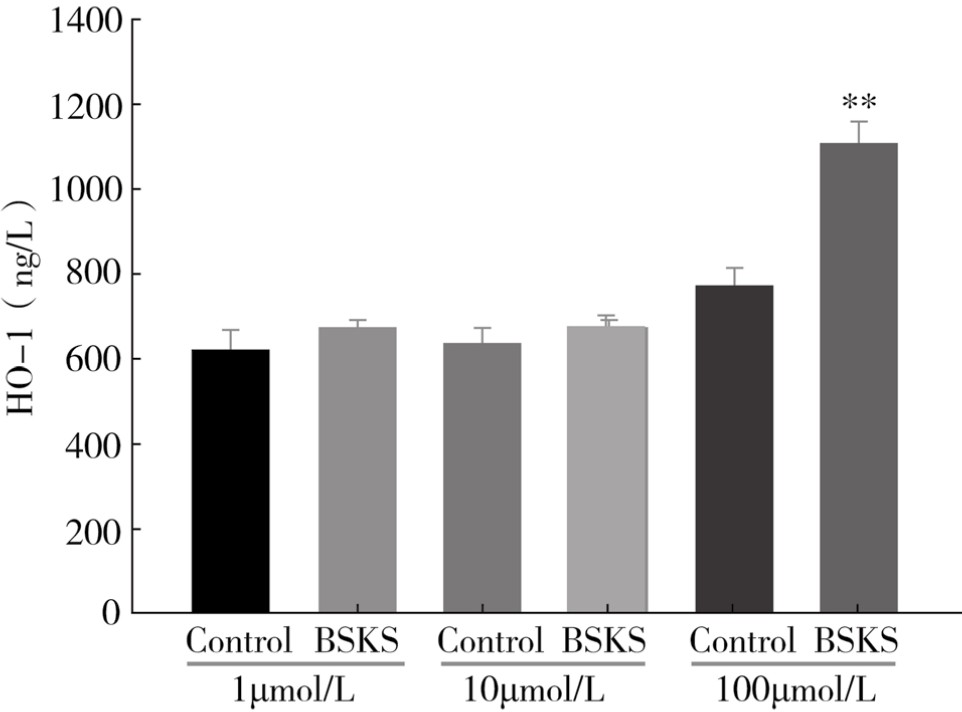
图4-7 补肾软坚方药对HO-1水平的影响
注:**与同浓度对照组(100μmol/L)比较,P<0.01。
分别以10μmol/L、100μmol/L Znpp-IX孵育RaECs 24h后,再以10%补肾软坚方药含药血清干预72h。检测结果发现(见图4-8,BSKS示以10%补肾软坚方药含药血清干预后),与Znpp-IX未孵育组比较,MCP-1水平升高(P<0.05),MMP-2水平降低(P<0.05),MMP-9、P-选择素水平没有明显差异,但补肾软坚方药有降低P-选择素水平趋势。
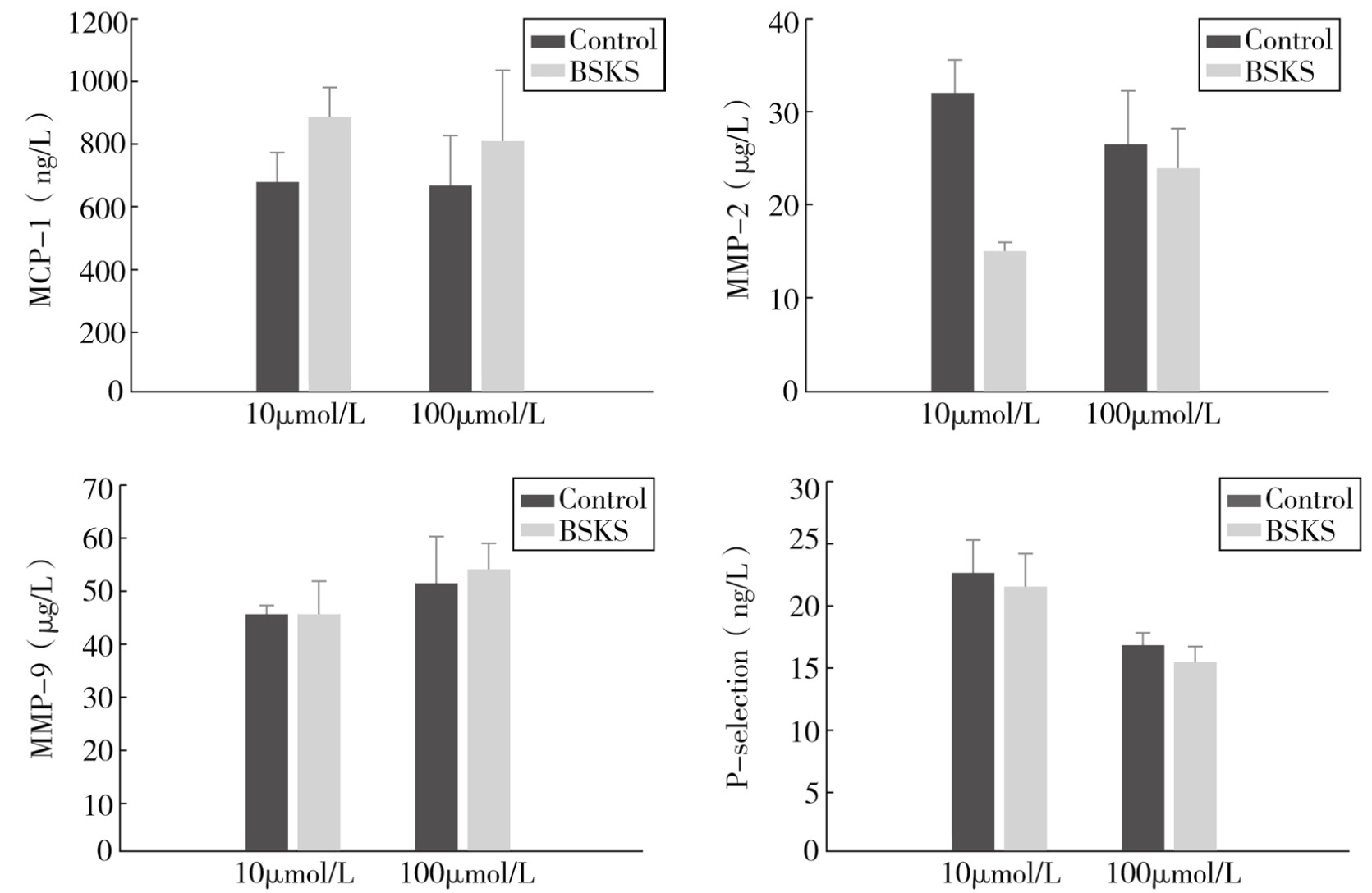
图4-8 补肾软坚方药对MCP-1、MMP-2、MMP-9、P-选择素水平的影响
3.荧光免疫细胞化学染色 研究结果显示,HO-1的特异性抑制剂Znpp-IX预处理RaECs 24h,再以补肾软坚方药干预72h后可以使RaECs HO-1水平明显降低,而补肾软坚方药上调了HO-1水平。(见附录,图4-9)
(三)讨论
近年研究显示,氧化应激在心血管病变中,尤其是动脉粥样硬化的发生发展过程中扮演着重要角色。动脉粥样硬化发生时,体内一系列保护机制被激活,血红素氧合酶(HO)就是这种保护性蛋白质之一。HO-1是HO的同工酶,可由其底物血红素(Heme)和多种应激刺激诱导表达,参与适应和防御氧化应激等细胞应激反应,维持细胞稳态,促进细胞生存,是一种多效性的细胞保护效应分子,是机体内源性抗损伤的重要机制之一。实验发现,经补肾软坚方药干预后HO-1 mRNA表达明显升高,阻抑了日本大耳白兔动脉粥样硬化病变的进展。多项研究阐释了中药复方制剂补肾软坚方药在动脉粥样硬化病变中的抗炎症、抗氧化作用,可能是通过调控NF-κB或HO-1 mRNA基因的表达以影响HO-1/CO-cGMP通路中相关酶的活性而实现的,同时补肾软坚方药也通过对抗过氧化反应稳定动脉粥样硬化斑块。
本研究发现,10%补肾软坚方药含药血清显示出对乳兔内皮细胞最佳促增殖效果,HO-1的特异性抑制剂Znpp-IX预处理RaECs 24小时后可以使RaECs HO-1水平明显降低,而补肾软坚方药上调了HO-1水平。10μmol/L、100μmol/L HO-1孵育RaECs 24小时后,再以10%补肾软坚方药含药血清干预72h。结果显示,补肾软坚方药降低了10μmol/L组MMP-2水平(P<0.05),同时升高了MCP-1水平(P<0.05)。研究结果提示,补肾软坚方药的抗炎机制可能与其抗氧化作用密切相关,并且通过HO-1相关信号通路实现。
