补肾软坚方药对ox-LDL诱导的血管内皮细胞凋亡的影响
AS是冠状动脉疾病、中风、周围血管疾病等多种疾病的病理基础,是人类衰老和死亡的重要因素。研究表明,内皮细胞功能障碍及凋亡是AS的起始环节,在AS形成和发展过程中起重要作用。依据中医理论,AS的形成与发展多与“脾肾虚衰,痰浊停滞”有关,对AS的治疗当以“益肾健脾、软坚散结”为大法,基于此法所立的补肾软坚方药是由阮士怡教授研制,经天津市卫生局批准,在临床上广泛使用、治疗AS疗效肯定的院内制剂。在团队以往的研究中,补肾软坚方药治疗AS有效的相关机制已从抑制氧化应激、炎症反应等角度得到初步阐明。我们认为补肾软坚方药还可能通过抑制血管内皮细胞凋亡这一环节抑制AS的形成和发展。本实验在前期研究的基础上,进一步观察补肾软坚方药含药血清对ox-LDL诱导的EA.hy926细胞形态、细胞活力、LDH释放水平及细胞凋亡水平的影响。
(一)材料与方法
1.实验动物和细胞株 成年雄性SD大鼠10只,SPF级,体重平均(200±20)g,大鼠自由饮水,在室温23℃~25℃、湿度50%~70%的环境饲养,光照12h,黑暗12h。细胞株选用人血管内皮细胞株EA.hy926。
2.主要试剂和药品 胎牛血清、氧化低密度脂蛋白(ox-LDL)、MTT、LDH测定试剂盒、Hoechst33342/PI双染凋亡试剂盒、Annexin-V FITC/PI凋亡检测试剂盒、补肾软坚方药。
3.方法
(1)细胞培养 同第四章第四节。
(2)含药血清的制备 同第二章第三节。
(3)补肾软坚方药含药血清对ox-LDL诱导的血管内皮细胞活力的影响 对数生长期EA.hy926细胞,以5×104/mL的细胞密度接种于96孔板中,每孔100μL,在细胞融合80%后分组。对照组和模型组予终浓度为10%的对照组SD大鼠血清培养液孵育,补肾软坚组予终浓度为10%的补肾软坚组SD大鼠血清培养液孵育,并设调零组(只加培养基,不加细胞),每组设4个复孔。24h后弃上清液,对照组予含0.5%胎牛血清的培养液,模型组与补肾软坚组予ox-LDL终浓度为200μg/mL的含0.5%胎牛血清的培养液。处理24h后,弃上清液,每孔中加入100μL DMEM(高糖)培养液和10μL MTT(终浓度5mg/mL),37℃、5%CO2培养箱内孵育4h后,弃上清液,每孔中加入150μL的DMSO原液,振荡10min。待结晶完全溶解后,用酶标仪于570nm处测定吸光度值(A值)。
设对照组细胞活力为100%,其余各组细胞活力按以下公式计算:
细胞活力(%)=(A实验组-A调零组)/(A对照组-A调零组)×100%
以上实验重复3遍。
(4)补肾软坚方药含药血清对ox-LDL诱导的血管内皮细胞LDH释放的影响 取对数生长期的EA.hy926细胞,以5×104/mL的细胞密度接种于24孔板中,每孔1mL。在细胞融合80%后分组。对照组和模型组予终浓度为10%的对照组SD大鼠血清培养液孵育,补肾软坚组予终浓度为10%的补肾软坚组SD大鼠血清培养液孵育。每组设3个复孔。24h后弃上清液,对照组予含0.5%胎牛血清的培养液,模型组与补肾软坚组予ox-LDL终浓度为200μg/mL的含0.5%胎牛血清的培养液。处理24h后收集各孔上清液,按照试剂盒说明,用全自动生化分析仪检测细胞上清液中LDH水平。以上实验重复3遍。
(5)Hoechst33342/PI双荧光染色法观察检测细胞凋亡 细胞接种、分组及药物处理步骤同(4),处理24h后,弃上清液,小心用PBS冲洗1次,每孔分别加入1mL细胞染色缓冲液,5μL Hoechst33342和5μL PI避光反应20min,每孔再用PBS轻轻冲洗一次,置于荧光显微镜下,在波长为365nm的紫外线激发下观察细胞的凋亡情况,并拍照记录。以上实验重复3遍。
(6)Annexin-V FITC/PI双染流式细胞术检测细胞凋亡率 取对数生长期的EA.hy926细胞,以1×105/mL的细胞密度接种于6孔板中,每孔2.5mL,在细胞融合80%后。对照组和模型组予终浓度为10%的对照组SD大鼠血清培养液孵育,补肾软坚组予终浓度为10%的补肾软坚组SD大鼠血清培养液孵育。每组设3个复孔。24h后弃上清液,对照组予含0.5%胎牛血清的培养液,模型组与补肾软坚组予ox-LDL终浓度为200μg/mL的含0.5%胎牛血清的培养液。处理24h后,每孔收集细胞数约为5×105个,用预冷的PBS洗1次,2000r/min离心5min,再加入100μL预先配好的标记液(1mL孵育缓冲液incubation buffer+20μL Annexin-V+20μL PI)混匀后避光孵育15min,再加入500μL孵育缓冲液incubation buffer导入流式管,用流式细胞仪检测分析,并统计各组细胞早期凋亡率。以上实验重复3遍。
4.统计学方法 计量数据以x±s示,采用SPSS 1.5统计软件进行单因素方差分析。组间两两比较通过LSD法分析。
(二)结果
1.补肾软坚方药含药血清对ox-LDL诱导的血管内皮细胞形态的影响 如图4-34所示,在倒置相差显微镜下观察到对照组内皮细胞呈梭形或多角形,细胞形态饱满,数目较多,排列密集;模型组细胞数目明显减少,排列疏松,细胞内颗粒物质增多;补肾软坚组细胞状态介于对照组和模型组之间。

图4-34 补肾软坚方药含药血清对ox-LDL诱导的血管内皮细胞形态的影响(100×)
2.补肾软坚方药含药血清对ox-LDL诱导的血管内皮细胞活力的影响 如图4-35所示,模型组细胞活力下降到50%以下,与对照组相比,差异非常显著(P<0.01)。补肾软坚组细胞活力介于对照组(C)与模型组(M)之间,差异非常显著(P<0.01)。实验表明,补肾软坚方药含药血清能显著升高ox-LDL诱导的血管内皮细胞的活力。
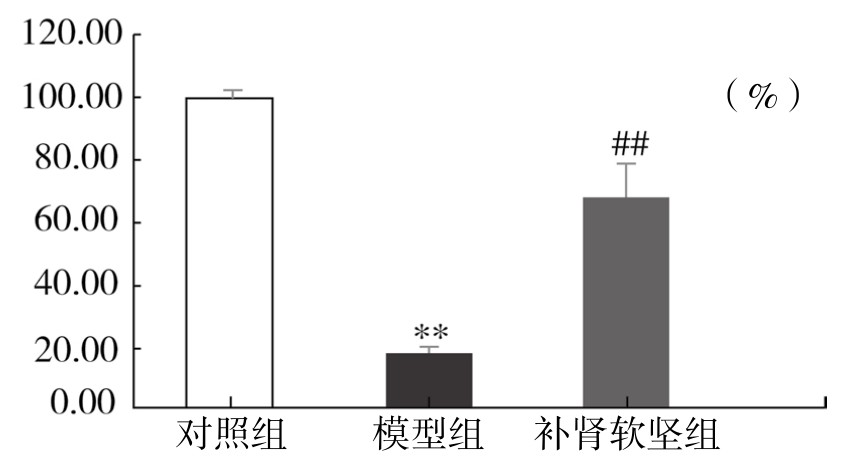
图4-35 补肾软坚方药含药血清对ox-LDL诱导的血管内皮细胞活力的影响
注:与对照组相比,**P<0.01;与模型组相比,##P<0.01。
3.补肾软坚方药含药血清对ox-LDL诱导的血管内皮细胞LDH释放水平的影响如图4-36所示,模型组细胞上清液的LDH水平显著上升(P<0.01),与对照组相比,补肾软坚组上清液的LDH水平明显下降(P<0.05),介于空白对照组与模型组之间。实验表明补肾软坚方药含药血清能明显降低LDH释放水平。
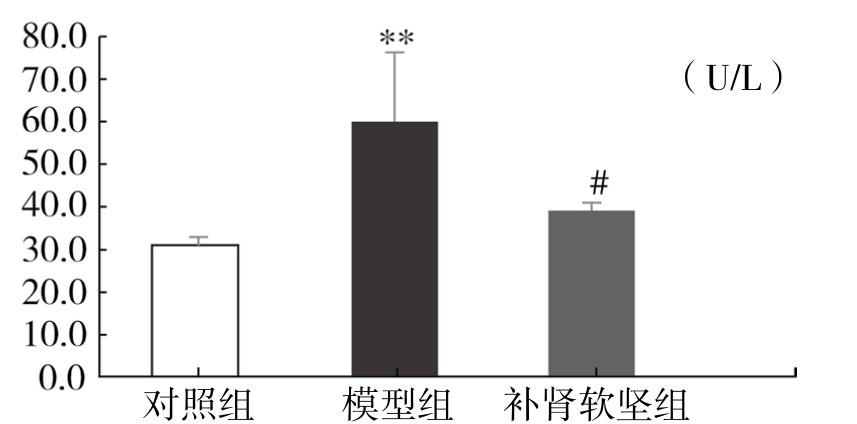
图4-36 补肾软坚方药含药血清对ox-LDL诱导的血管内皮细胞LDH释放水平的影响
注:与对照组相比,**P<0.01;与模型组相比,#P<0.05。
4.Hoechst33342/PI双荧光染色法观察检测细胞凋亡 如附录图4-37所示,对照组细胞多为正常细胞,细胞核呈低蓝色,核型较大,均匀规整。模型组与对照组相比,凋亡细胞及坏死细胞明显增多,出现核固缩、核碎裂,部分细胞核呈红色荧光。补肾软坚组与模型组相比,凋亡细胞及坏死细胞明显减少。
5.Annexin-V FITC/PI染色法流式细胞术检测细胞凋亡率 与对照组相比,模型组细胞早期凋亡率明显上升(P<0.01),与模型组相比,补肾软坚组细胞早期凋亡率明显下降(P<0.01),介于对照组与模型组之间。实验表明,补肾软坚方药含药血清能有效抑制ox-LDL诱导的内皮细胞凋亡。(见图4-38,见附录图4-39)
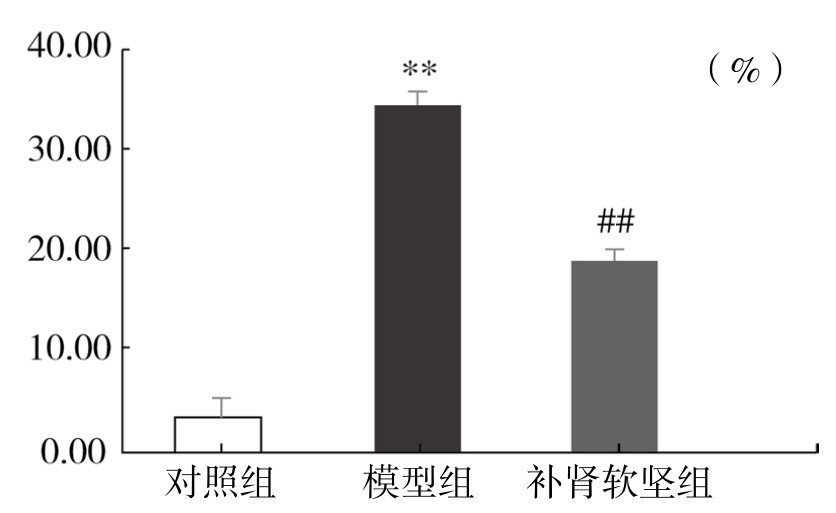
图4-38 各组细胞早期凋亡率
注:与空白对照组相比,**P<0.01;与模型组相比,##P<0.01。
(三)讨论
AS是冠状动脉疾病、中风、周围血管疾病等多种疾病的病理基础,是人类衰老和死亡的重要因素。血管内皮细胞功能障碍及凋亡被认为是AS病理过程的起始环节,在AS形成和发展过程中占重要地位。大量流行病学调查研究表明,血浆LDL水平与AS发生、发展呈显著正相关。近年来越来越多的研究发现,ox-LDL是导致血管内皮损伤的重要因素之一。ox-LDL是一种氧自由基携带者,能够直接影响血管内皮细胞的通透性、炎症反应及分泌调节等功能,并且能通过调节某些信号通路导致内皮细胞凋亡。
研究表明,许多抑制AS发生发展的药物均可抑制内皮细胞凋亡。依据中医理论,AS的形成多与“脾肾虚衰,痰浊停滞”有关,防治AS当以“益肾健脾、软坚散结”为大法。本实验观察了补肾软坚方药含药血清对ox-LDL诱导的内皮细胞形态、细胞活力、LDH释放水平及细胞凋亡的影响。结果表明,补肾软坚方药能显著升高细胞活力,明显降低LDH释放水平,显著降低细胞早期凋亡率,进而起到保护内皮细胞、抗细胞凋亡的作用。
综上所述,血管内皮细胞凋亡在AS的形成和发展过程中占重要地位,补肾软坚方药可通过抑制血管内皮细胞凋亡阻断和抑制AS的发展,为其应用于AS的防治提供理论基础。但补肾软坚方药中含有多味中药,成分复杂,究竟是哪些单体或药物组合起到抑制细胞凋亡的作用,以及其通过调控哪些信号通路实现抑制凋亡作用的机制尚不明确,有待我们后续进一步研究。
