补肾软坚方药干预动脉粥样硬化家兔蛋白质硝基化修饰的研究
动脉粥样硬化(AS)的发病机制复杂。最新研究发现,在AS复合异生细胞斑块、无细胞纤维斑块和内膜斑块中均发现有3-硝基酪氨酸(3-NT)的存在,而蛋白质中的酪氨酸硝基化生成3-NT正是蛋白质硝基化的重要标志,也是斑块易损的机制之一。蛋白质硝基化现象在心血管疾病中普遍存在,是一种典型的氧化还原依赖的蛋白质翻译后修饰,也是一氧化氮发挥其广泛信号转导作用的新的重要途径。越来越多的证据表明蛋白质络氨酸硝基化参与并促进AS的发生、发展,在AS病程中发挥重要作用。补肾软坚方药立法于“健脾益肾、软坚散结”,对AS病变疗效明确,对实验性AS也具有较好的治疗作用。本实验观察补肾软坚方药对AS家兔硝化反应的抑制作用,从对p38丝裂原活化蛋白激酶(p38MAPK)、诱导型一氧化氮合成酶(iNOS)、内皮型一氧化氮合成酶(eNOS)及其对iNOS/NO-COX-2调控角度入手,探讨其干预AS的机制。
(一)材料与方法
1.动物 同第三章第三节实验二。
2.药物与试剂 补肾软坚方药,辛伐他汀,3-NT、环氧合酶-2(COX-2)、一氧化氮(NO)ELISA试剂盒,p38MAPK、基质金属蛋白酶-9(MMP-9)免疫组化试剂盒,羊eNOS多克隆抗体、羊抗兔IgG。
3.方法
(1)造模 采用高脂饮食加免疫损伤和球囊拉伤方法建立兔AS模型。
(2)分组给药 雄性家兔56只,按体重随机分为4组,即正常组、模型组、补肾软坚方药组、辛伐他汀组(以下简称正常组、模型组、辛伐组、补肾组)。正常组8只,其余各组16只。于第8周时,各给药组按剂量开始灌胃给药,辛伐他汀5mg/kg,1次/日;补肾软坚方药1g/kg,2次/日,每克以蒸馏水5mL溶解饲喂。正常组同时饲喂等剂量蒸馏水。第24周(即给药后第16周)取材。
(3)取材 各组分别于0周(给药前)、给药后第8、12、16周采血。每次采血前禁食12h,经耳缘静脉采血3mL,静置1h后3000 r·min-1离心10min,提取血清置于-80℃冰箱冻存备用。自第8周开始给药,给药第16周(第24周)后,用3%戊巴比妥钠30mg/mL/kg麻醉固定,无菌条件下在体获取主动脉,生理盐水冲洗后,置于组织冻存管,液氮保存备用,余新鲜组织置于-80℃冰箱保存。
4.标本检测项目
(1)酶联免疫吸附法检测血清NO、3-NT、COX-2水平 检测步骤严格按试剂盒说明书进行。
(2)Western-blot检测NOS蛋白水平 取100mg主动脉组织样本剪碎,加入裂解液(50mM Tris-HCl,pH8.0,150mmol·L-1 NaCl,100mg·L-1 PMSF,1%TritonX-100),用组织匀浆器冰上裂解组织30min,12000×g,离心5min后,取20μg样品与上样缓冲液混合,煮沸5min,进行10% SDS-PAGE电泳,转硝酸纤维素膜(Pall Corporation);将膜在含5%脱脂奶粉的TBST(10mmol·L-1 Tris-HCl,pH7.5,150mmol·L-1 NaCl,0.05% Tween-20)中室温下封闭1h,随后加入羊抗兔eNOS多克隆一抗,抗羊IgG-HRP二抗,ECL化学发光试剂检测,显影,摄像,图片分析。
(3)免疫组化检测p38MAPK阳性面积 选取与病理图像分析所用片子相邻的切片用免疫组化检测p38MAPK阳性面积。每只动物选取3张切片,每张切片随机观察5个不同的高倍镜视野(40×),计算阳性细胞(细胞内有黄褐色或棕黄色沉淀物)面积占内膜面积的百分比,取其平均值。
(4)RT-PCR检测iNOS mRNA、p38MAPK mRNA基因 采用Trizol法提取总RNA,每个标本均进行p38MAPK mRNA、iNOS mRNA和内参GAPDH基因的荧光定量PCR。总反应体积10μL,反应体系为:5μL SYBR GreenMix-Plus,上下游引物各0.5μL(10μmol·L-1),2μL cDNA,加ddH2O至反应总体积10μL。反应条件:95℃,5min;95℃,30s;59℃,30s。共进行40个循环,57℃~96℃绘制熔解曲线,利用比较CT法计算各样本mRNA的表达。比较CT法计算各样本mRNA的表达情况,依据公式ΔCt=Ct目的基因-Ct内参基因,分别计算各组的ΔCt值,各样本mRNA的相对表达量以2-ΔCt表示,以2-ΔΔCt表示各组间的相对表达率,其中ΔΔCt=ΔCt目的基因-ΔCt校正样本基因。引物序列见表3-11。
表3-11 iNOS,p38MAPK基因引物序列

5.统计学方法 采用PASW Statistics 18.0统计软件进行数据统计,多组间比较采用One-way ANOVA检验,显著性水平为P<0.05。
(二)结果
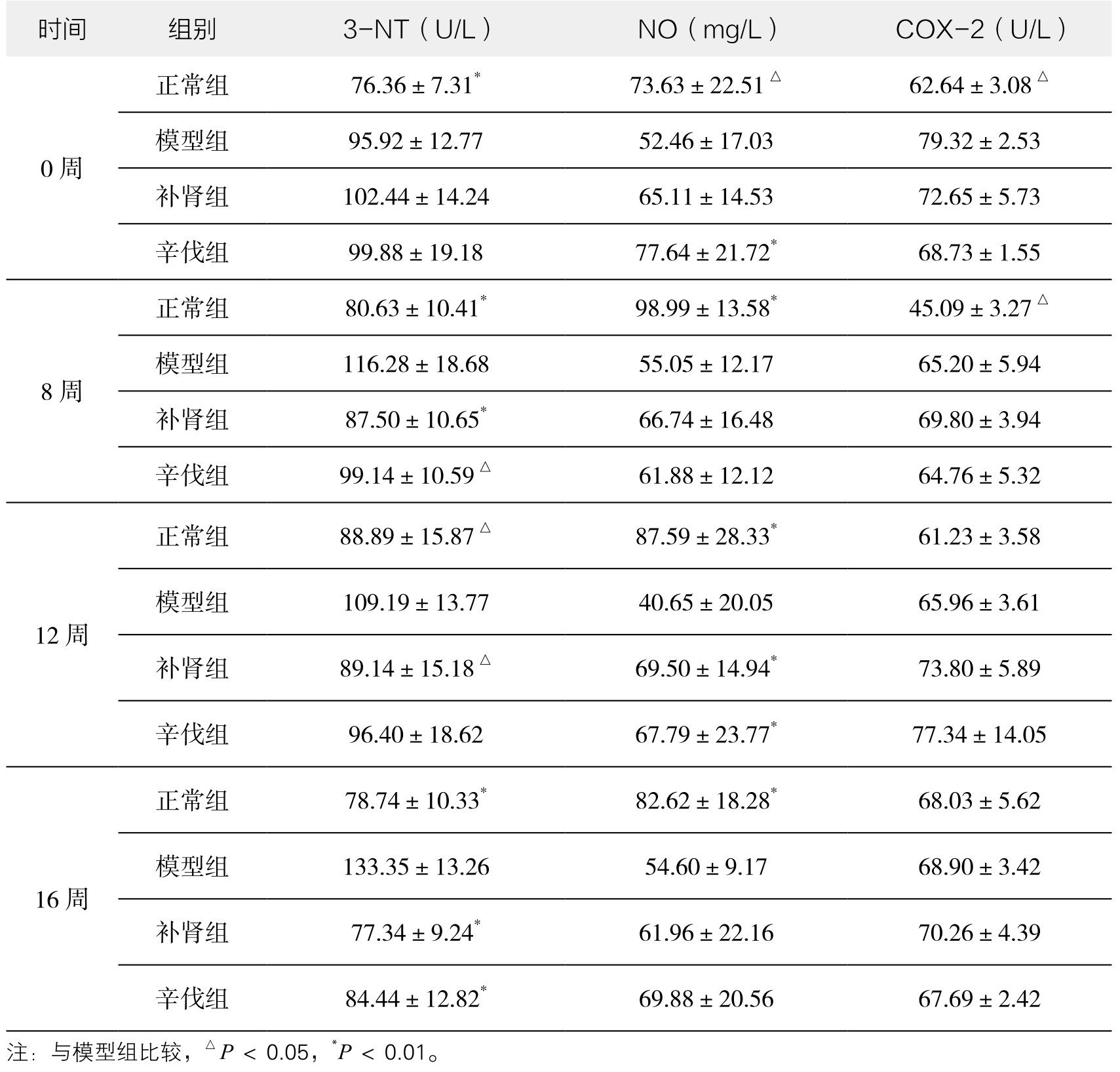
1.NO,3-NT,COX-2水平 与正常组比较,模型组NO水平在给药前及给药后第8、12、16周均明显降低,在补肾软坚方药干预8周后,NO水平逐渐升高,补肾组和辛伐组在第12、16周时,与正常组同期比较,差异有显著性(P<0.01);与正常组比较,模型组3-NT水平在给药前及给药后第8、12、16周均明显升高,提示动脉组织硝基化,在补肾软坚方药干预8周后,3-NT水平逐渐下降,补肾软坚方药抑制了硝基化损伤;模型组在给药前8周,COX-2活性高于同期正常组(P<0.05),但在第12,16周时,各组均没有明显差异。(见表3-12)
表3-12 补肾软坚方药对各组NO、3-NT、COX-2水平比较
2.主动脉eNOS蛋白结果 以预染Marker为标准条带显示,eNOS蛋白为133kDa,GAPDH为35kDa,符合分子量。家兔经造模因素干预后,主动脉eNOS蛋白较正常组比较明显减少,经补肾软坚方药干预后eNOS蛋白表达明显升高,差异具有显著的统计学意义(P<0.05)。(见图3-16)

图 3-16 主动脉eNOS蛋白水平比较
注:正常组(NOR);模型组(CHOL);补肾组(BSKSH),1g·kg-1·d-1;辛伐组(SIMVA),0.005g·kg-1·d-1;与模型组比较△P<0.05,*P<0.01。
3.主动脉p38MAPK阳性表达面积比较 正常对照组血管壁见少量p38MAPK阳性表达;模型组血管壁平滑肌细胞、内皮细胞的胞核有大量棕黄色阳性区域,在胞质内也有少量阳性表达;补肾组和辛伐组内皮细胞和平滑肌细胞有少量棕黄色阳性沉淀物。(见附录,图3-17)
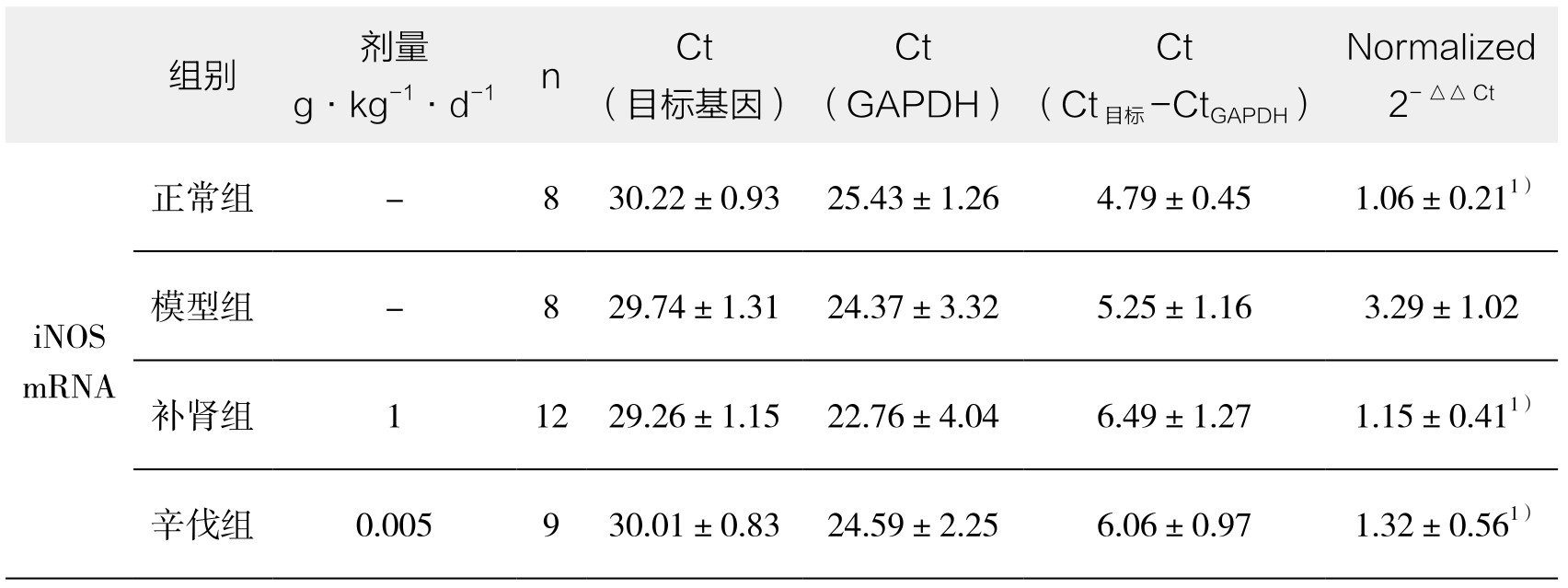
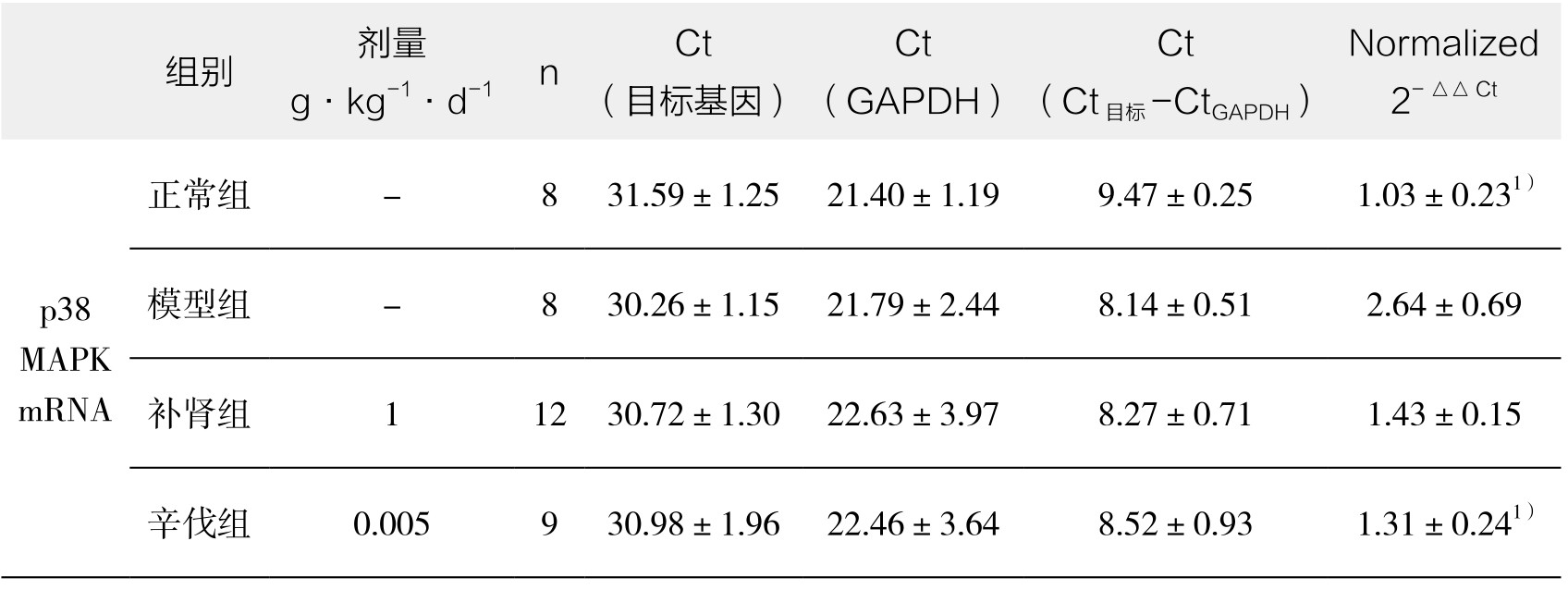
4.主动脉p38MAPK mRNA及iNOS mRNA表达 家兔正常组主动脉iNOS mRNA基因仅有少量表达,模型组iNOS mRNA表达增加,经补肾软坚方药干预后iNOS mRNA表达明显减少,差异具有显著性(P<0.05),辛伐他汀也有类似于补肾软坚方药的抑制硝基化效应;家兔正常组主动脉p38MAPK mRNA基因仅有少量表达,模型组p38MAPK mRNA表达增加,经补肾软坚方药干预后p38MAPK mRNA表达明显升高,差异具有显著性(P<0.05),辛伐他汀也有类似于补肾软坚方药的抗氧化效应。(见表3-13)
表3-13 补肾软坚方药对各组iNOS mRNA、p38 MAPK mRNA的影响
续表
(三)讨论
蛋白质硝基化是与氧化应激密切相关的蛋白质翻译后修饰。作为一种蛋白质翻译后修饰,酪氨酸硝基化常在病理状态下伴随活性氧和活性氮的增加而产生。AS病变组织内产生大量活性氧,这些活性氧可以与炎症状态下产生的大量一氧化氮(NO)结合生成过氧化亚硝基阴离子(ONOO-),启动硝基化应激,破坏蛋白质的功能和酶的活性,造成细胞凋亡,增强iNOS的表达,使蛋白质酪氨酸残基硝基化生成3-NT。AS的不同时期,在巨噬细胞丰富的损伤部位都可检测到iNOS的表达和蛋白质酪氨酸的硝基化。临床研究发现,蛋白质硝基化现象在心血管疾病中普遍存在,体内蛋白质硝基化水平的升高可以作为AS的独立危险因素。
本研究发现,家兔正常组主动脉iNOS mRNA基因仅有少量表达,模型组iNOS mRNA表达增加,经补肾软坚方药干预后iNOS mRNA表达明显升高。本研究结果显示,动脉粥样硬化发生后,机体内存在氧化/抗氧化调节系统失衡,模型组内膜明显增厚、纤维帽较薄,斑块内有大量脂质沉积,血清3-NT水平明显升高,经补肾软坚方药干预后,血清3-NT水平下降,NO水平明显升高,而COX-2活性没有明显变化;免疫组化染色发现,补肾软坚方药也明显降低了家兔p38MAPK水平;主动脉p38MAPK mRNA、iNOS mRNA基因在正常组仅有少量表达,动脉粥样硬化病变组p38MAPK mRNA及iNOS mRNA表达增加,经补肾软坚方药干预后,p38MAPK mRNA、iNOS mRNA基因表达明显下降,辛伐他汀也有类似的抑制硝基化效应。研究发现,家兔经高脂饲喂、球囊拉伤及免疫损伤后,机体处于应激状态,COX-2活性明显升高,补肾软坚方药干预后COX-2活性有降低的趋势,但与同期对照组比较没有显著的统计学差异;同时,免疫组织化学法发现,模型组血管壁有大量p38 MAPK棕黄色阳性区域,而补肾组和辛伐组内皮细胞和平滑肌细胞仅有少量棕黄色阳性沉淀物。
在人体内,酪氨酸硝基化途径不是唯一的,而且可能不是彼此独立发生而是同时发生。人体是一个复杂的巨系统,对于每种疾病,须分别探讨酪氨酸硝基化在其中的作用。与此同时,体内硝基化的机制仍然在研究中且存在很多争议,并期望能找到一种直接抑制酪氨酸硝基化的方法,在机体硝基化损伤的防治中起到重要作用,对于相关疾病的治疗开辟一条新的途径。蛋白质硝基化普遍存在于AS的发生及发展阶段,找到抑制酪氨酸硝基化的方法,可为防治AS提供新的途径。补肾软坚方药可明显提高机体的抗硝基化能力,延缓AS发生、发展。本次研究也提示补肾软坚方药通过激活iNOS/NO-COX-2路径中相关因子的表达是其抗硝基化应激作用的机制,也是其抗AS的机制之一。
