8.2 食品安全风险评估
风险评估既是风险分析框架的科学核心部分,也是应用科学原理和技术对危害事件发生的可能性和不确定性进行科学评估的过程,主要基于自然科学,如毒理学、流行病学、微生物学、化学等方面的知识,就危害物对人体和环境暴露所造成危害的可能性和严重性进行评估。国际食品法典委员会CAC将风险评估定义为:一个以科学为基础的过程,包括危害识别、危害特征描述、暴露评估以及风险特征描述四个步骤。
根据采用的评估方法,风险评估一般可分为确定性评估(Deterministic assessment)和相对复杂的概率性评估(Probabilistic assessment)两种方法。根据结果的产出形式,风险评估可分为定性评估(Qualitative assessment)和定量评估(Quantitative assessment)。定性评估是用高、中、低等描述性词语来表示风险;而定量评估是以量化的数值表示风险大小及其伴随的不确定性。食品安全风险评估的主要研究对象识别和界定食品安全问题的属性和特征,明确食品安全问题的主要研究对象是实施风险评估的起点。以熟肉制品中单增李斯特菌定量风险评估为例,其模型示意图见图8-3。
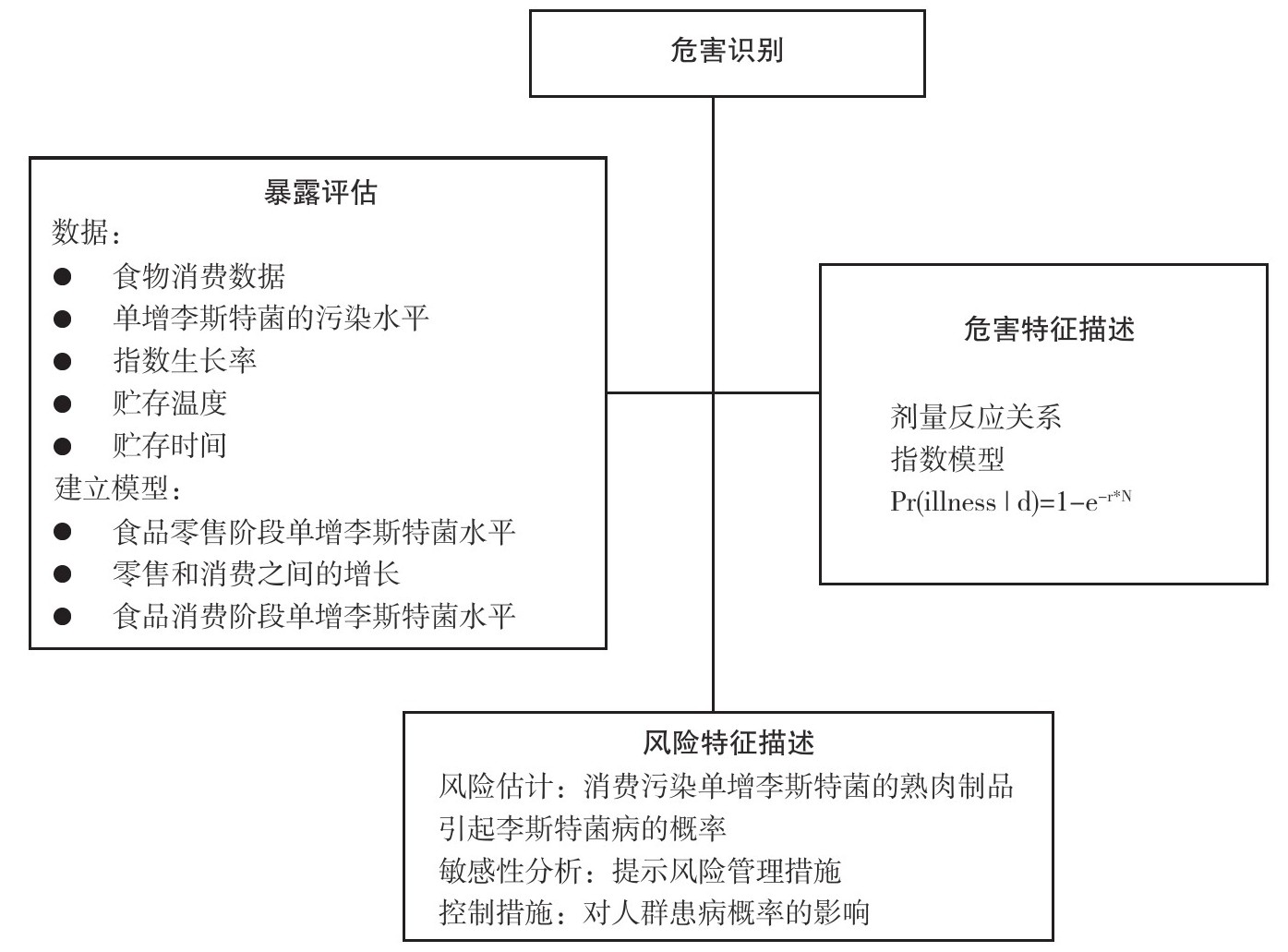
图8-3 熟肉制品中单增李斯特菌定量风险评估模型示意图
8.2.1 食品安全风险评估程序
由于风险本身往往缺乏直接可见的人体不良反应症状,并且存在一定的不确定性和混杂因素,因此有必要对风险评估过程制定程序化框架,以保证风险评估的质量和可比性。图8-4为食品安全风险评估工作程序。
(1)确定风险评估项目 风险评估项目来源包括风险管理者委托的评估任务和委员会根据目前食品安全形势和需要自行确定的评估项目。在正式委托或确定风险评估项目前,委员会原则上需与风险管理者合作,对拟评估的食品安全问题进行分析,以确定风险评估的必要性。分析时应着重考虑食品安全问题的起因、可能的危害因素及所涉及的食品、消费者的暴露途径及其可能风险、消费者对风险的认知以及国际上已有的风险控制措施等。当分析结果提示风险可能较高但其特性尚不明确、风险受到社会广泛关注或符合《食品安全法》《食品安全风险评估管理规定》中关于开展风险评估的条件时,可确定风险评估项目并下达风险评估任务书。

图8-4 食品安全风险评估工作程序
(2)组建风险评估项目组 委员会在接到风险评估任务后,应成立与任务需求相适应,且尽可能包括具有不同学术观点的专家的风险评估项目组。必要时可分别成立风险评估专家组和风险评估工作组。专家组主要负责审核评估方案、提供工作建议、作出重要决定、讨论评估报告草案等工作;工作组主要负责起草评估方案、收集评估所需数据、开展风险评估、起草评估报告、征集评议意见等工作。
(3)制定风险评估政策 项目组需要在任务实施前与风险管理者积极合作,共同制定适于本次评估的风险评估政策,以保证风险评估过程的透明性和一致性。风险评估政策应对管理者、评估者以及其他与本次风险评估有关的相关方的职责进行明确规定,并确认本次评估所用的默认假设、基于专业经验所进行的科学判断、可能影响风险评估结果的政策性因素及其处理方法等。
(4)制订风险评估实施方案 风险评估项目组应根据风险评估任务书要求制订风险评估实施方案,内容包括风险评估的目的和范围、评估方法、技术路线、数据需求及采集方式、结果产出形式、项目组成员及分工、工作进程、经费等。必要时需要写明所有可能影响评估工作的制约因素(如费用、资源或时间)及其可能后果。风险评估实施方案在实施过程中可根据评估目标的变化进行必要的调整。调整的内容需与风险评估报告一同备案。风险评估目的应针对风险管理者的需求,根据风险评估的任务规定解决项目设定的主要问题,也包括有助于达到风险评估目的的阶段性目标。
风险评估范围应对评估对象及其食品载体以及所关注的敏感人群进行明确界定。根据管理需要、评估目的和有效数据等因素确定风险评估方法后,应制定合理、可行的技术路线。在风险评估数据需求中,应根据评估目的和所选择的评估方法,尽可能列出完成本次风险评估所需的详细数据及表示方式、来源、采集途径、质量控制措施等。对于缺失的关键数据,需提出解决办法或相关建议。实施方案应根据评估任务量、项目组成员的专业特长及对项目内容的熟悉程度进行明确分工,制定工作进度计划、具体的阶段性目标及经费需求。风险评估结果原则上应在充分利用现有数据的基础上达到风险评估目的,满足风险管理需求。
(5)开展风险评估工作 风险评估工作开展之前需要采集风险评估数据。风险评估者需要采集的数据种类取决于评估对象和评估目的,应在科学合理的前提下,尽可能采集与评估内容相关的所有定量和定性数据。具体要求见《食品安全风险评估数据需求及采集要求》。所采集的数据在正式用于风险评估前,应组织专业人员对数据的适用性和质量进行审核。膳食暴露评估所需的消费量、有害因素污染水平、营养素或添加剂含量数据原则上应在保证科学性的前提下,优先选用国内数据;特殊情况下可选用全球环境监测系统/食品部分(GEMS/FOOD)区域性膳食数据或其他替代数据,但必须提供充足理由。除了膳食暴露评估所需数据之外,还应尽可能采集基于流行病学或临床试验的内暴露或生物监测数据。
(6)报告起草与审议 风险评估项目组可按照评估步骤指定各部分内容的起草人和整个报告统稿人。风险评估报告撰写格式和内容参见《食品安全风险评估报告撰写指南》。风险评估报告草案经国家食品安全风险评估专家委员会审议通过后方可报送风险管理者。具体审议程序及要求参见《国家食品安全风险评估专家委员会管理文件——食品风险评估报告审议程序》。
(7)记录 为了保证风险评估的公开、透明,整个风险评估过程的各环节需要以文字、图片或音像等形式进行完整且系统地记录并归档。为了保证与评估相关各类文件的可追溯性,对于风险评估的制约因素、不确定性和假设及其处理方法、评估中的不同意见和观点、直接影响风险评估结果的重大决策等内容要进行详尽记录,必要时可商请专家签名。记录应与风险评估过程中产生的其他材料(包括正式报告)妥善存档,未经允许不得泄露相关内容。具体保密要求可参见《国家食品安全风险评估专家委员会管理文件—档案管理》。
8.2.2 食品安全风险评估步骤
8.2.2.1 危害识别
危害识别(hazard identification, HI)是指确定某一种或某一类特定食品中可能引起健康损害效应的生物性、化学性或物理性因素的过程。危害识别是对各种危害因素特性进行定性、定量描述的过程,其工作的开展基于对多种来源的研究数据的综合分析。危害识别是风险评估研究的起点,其目的是明确食品中的危害物质可能产生的人体健康损害效应,以及产生这种损害效应的可能性和不确定性。具体任务包括:
(1)识别危害因子的性质,并确定其所带来的危害的性质和种类等。
(2)确定这种危害对人体的影响结果。确定人体暴露来源、体内代谢机制、可能产生的毒性及其作用机制等。
(3)检查对于所关注的危害因子的检验和测试程序是否适合、有效。
(4)确定什么是显著危害。这对于评估能否完全和彻底十分重要。在某些时候,不同分析人员可能会对某些个体的危害物质所带来的不利影响究竟有多大存在不同的看法。
用于危害识别的数据资料来源可以是人群流行病学研究、动物实验研究、体外实验研究、结构—活性关系研究等。不同类型的研究所提供的证据强度不同,从高到低依次为流行病学研究、动物试验研究、体外试验、定量结构—活性关系研究。具体数据来源包括:
(1)权威技术资料。参考世界卫生组织(WHO)、FAO/WHO食品添加剂联合专家委员会(JECFA)、美国食品药品监督管理局(FDA)、美国环保署(EPA)、欧洲食品安全局(EFSA)等国际权威机构最新的技术报告或述评进行危害识别描述;
(2)对于缺乏上述权威技术资料的危害因素,可根据在严格试验条件(如良好实验室操作规范等)下所获得的科学数据进行描述;
(3)对于资料严重缺乏的少数危害因素,可以根据国际组织推荐的指南或我国相应标准开展毒理学研究工作。若危害因素是化学物质,危害识别应从危害因素的理化特性、吸收、分布、代谢、排泄、毒理学特性等方面进行描述。若是微生物,需要特别关注微生物在食物链中的生长、繁殖和死亡的动力学过程及其传播/扩散的潜力。
在选用适宜的数据资料进行危害识别的过程中,需要对各种来源的研究数据进行充分评议,根据对现有的研究资料的综合分析,确定毒性或不良健康损害效应的特点,并确定毒作用的靶器官或靶组织。危害识别的主要方法包括毒理学研究(包括体内试验、体外替代试验、毒理学测试新技术及人体试验等)、食源性疾病监测、食品中污染物监测和流行病学研究等。接下来就对这些方法和步骤进行详细介绍。
●毒理学研究
毒理学(toxicology)是一门研究外源因素(化学因素、物理因素和生物因素)对生物机体和生态系统的损害作用/有害效应与机制的科学。现代毒理学采用先进的化学、生理学、生物化学与分子生物学知识,借助于计算机技术,不断渗透到多个专业领域,逐步形成许多分支学科和交叉学科:按学科领域分类,有环境毒理学、食品毒理学、工业毒理学、临床毒理学、毒理流行病学、管理毒理学等;按靶器官分类,有肝脏毒理学、肾脏毒理学、免疫毒理学等;从机制角度分类,则有分子毒理学、遗传毒理学等。
食品毒理学是研究食品中外源化学物质的性质、来源、形成和它们的不良反应与可能的有益作用和机制,确定这些物质的安全限量和评价食品安全性的一门科学。研究内容包括急性食源性疾病以及具有长期效应的慢性食源性危害,涉及从食物的生产、加工、运输、贮存及销售全过程的各个环节,食物生产的工业化和新技术的采用,以及对食物中有害因素的新认识。研究的外源化学物包括工业品及工业使用的原材料、食品添加剂、农药等传统的物质,以及近来新出现的氯丙醇、丙烯酰胺、三聚氰胺、兽药残留、霉菌毒素等。随着经济、贸易、科技的高速发展,全球食品安全风险因素也日益繁杂。
1.毒理学研究基本术语
(1)毒物 毒物(toxicant)是指较小剂量就能引起生物体损害的化学物质;其余的称为非毒物。毒物作用于生物体所产生的各种损害统称为有害影响(harmful effect)。毒物引起生物体损害的能力称为毒性(toxicity)。毒物是人们生产和制造的各类化学品以及人类活动过程中产生的各种有毒害的副产品。而生物(动物、植物、微生物)体内形成的可引起其他生物体损害的物质称为生物毒素,简称毒素(toxin),以此与人工合成的毒物相区别。
按来源和用途毒物分为:环境污染物、工业化学品、农用化学品、医用化学品、日用化学品和嗜好品、生物毒素、军事毒物、放射性元素以及存在于食品中的有害物质。按毒性大小和危害程度可将毒物分为:剧毒物、高毒物和低毒物。按毒理作用部位(靶器官)和生物学效应可将毒物分为:肝毒物、肾毒物、神经毒物、致癌物、致畸物、致突变物等。
(2)暴露 生物体以不同的途径和方式直接或间接接触到毒物,毒物的毒性才可以体现出来,称为暴露(exposure)。生物体只有通过不同的途径和方式接触到外源物,外源物才有对生物体造成损害的可能。因此暴露是外源物对生物体体现出毒性的前提条件。在研究和评价外源物的潜在危害时,要研究这些物质的理化性质、生物学效应、剂量水平,还应考虑它们的暴露途径和方式、暴露时间、暴露频率和暴露间隔等重要因素。
外源物进入生物体的途径主要有:呼吸道、消化道、皮肤。外源物所引起的毒性反应大小会因为暴露途径和方式的不同而有很大的差别。消化道吸收是外源物进入食物链的主要吸收途径,主要部位是小肠和胃。外源物的理化性质、胃肠的蠕动和内容物的多少以及胃肠道内的酸碱度都是吸收速度的主要影响因素。
(3)毒性效应反应 外源物对生物体的毒性效应,主要有化学物致敏反应、特异体质反应、即时毒性效应和迟发毒性效应、局部毒性效应和全身毒性效应以及可逆性毒性效应和不可逆性毒性效应等类型。
化学物致敏反应:又称变态反应或超敏反应,是一类由于暴露某种或某类化合物而引起并由免疫诱导的有害效应。
特异体质反应:某些人有先天性的遗传缺陷,会对某些化学毒物表现出异常的反应性。一般是指某些个体表现为对某种化学物质的异常敏感或者异常不敏感。
即时毒性效应:单次暴露外源物后随即发生或出现的毒性作用。
迟发毒性效应:一次或多次暴露外源物后间隔一段时间才出现的毒性作用。
局部毒性效应:在生物体最初暴露外源物的部位直接发生的毒性作用。
全身毒性效应:外源物进入机体后,经吸收和转运分布至全身或靶器官(靶组织)而引起的毒性效应。
可逆性毒性效应:有些毒性效应是可逆的,即机体停止接触引起毒性效应的外源性化学物质后已造成的损害可逐渐消失。对肝脏等再生能力强的组织器官的损害,大部分是可逆效应。
不可逆性毒性效应:有些毒性效应则不可逆,即机体停止接触外源性化学物质后已造成的损害作用仍不能消失甚至可能进一步加重。对中枢神经系统的损害,基本上是不可逆毒性效应。
高敏感性:指某一群体在接触较低剂量的特定化学毒物后,当大多数成员尚未表现出任何异常时,就有少数个体出现了中毒症状。
高耐受性:指接触某一化学毒物的群体中有少数个体对其毒性作用特别不敏感,可以耐受远高于其他个体所能耐受的剂量。
(4)剂量—反应(效应)关系 对于食品中的外源性化学物质来说,毒性大小在很大程度上取决于摄入的剂量。
剂量—反应关系和剂量—效应关系,都是指外源物作用于生物体时的剂量与所引起的生物学效应的强度或发生率之间的关系。剂量—反应关系是评价外源物的毒性和确定安全暴露水平的基本依据,分为“定量个体剂量—反应关系”和“定性群体剂量—反应关系”两种基本类型。
定量个体剂量—反应关系:描述不同剂量的外源物所引起的生物个体的某种生物效应强度以及两者之间的依存关系。
定性群体剂量—反应关系:反映不同剂量外源物引起的某种生物效应在一个群体(实验动物或调研人群)中的分布情况即该效应的发生率或反应率。
剂量—反应曲线主要有对数曲线、S形曲线和直线3种类型(图8-5),其中以对数曲线、S形曲线最为常见。毒理学上最常见的是一类呈偏态分布的不对称S形曲线。它反映的机理可能是因为剂量越大,生物体的改变越复杂,干扰因素越多,而且体内自稳机制对效应的调整机制也越明显;也可能是由于群体存在一些耐受性较高的个体,要使群体的反应率升高,就需要大幅增加暴露量。
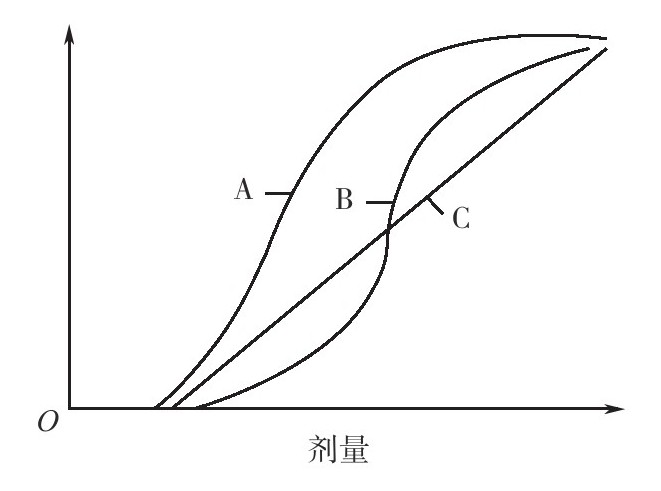
图8-5 剂量—反应曲线的3种类型(A、B、C分别为对数曲线、S形曲线和直线)
(5)常用毒性参数。
1)致死剂量(lethal dose)半致死剂量(half lethal dose, LD50)是最常用的毒性参数,是指给予单次剂量的受试物后,预期引起半数实验动物死亡的剂量水平。可由实验数据经统计分析获得。近年来,人们开始关注90%动物致死剂量(LD90)和10%动物致死剂量(LD10)等其他毒性参数。
绝对致死剂量(absolute lethal dose, LD100)有时也用绝对致死浓度(LC100)表示,是指引起一组受试动物全部死亡的最低剂量或浓度。
最小致死剂量(minimum lethal dose, LDm)是指使一组受试动物仅个别死亡的剂量。
最大耐受剂量(maximal tolerance dose, MTD)是指不致引起受试动物死亡的最大剂量。
这些都是在致死毒性试验中直接观察所得的参数,受个体差异的影响很大,已经很少作为评价外源性化学物质的毒性的指标,而是常用它们作为急性毒性试验中选择剂量范围的依据。
2)阈值剂量和未观察到有害作用剂量 阈值剂量(threshold dose)是指诱发机体某种生物效应呈现的最低剂量,是剂量—反应关系原理的另一个非常重要的概念,也称为最低可观察到有害作用剂量(lowest observed adverse effect level, LOAEL)。绝大多数外源物的毒性反应尤其是急性毒性反应都存在着一个阈值剂量。
未观察到有害作用剂量(no observed adverse effect level, NOAEL)是指用现有的技术手段和指标未观察到外源物对受试机体产生毒性效应的最大剂量或浓度,简称无作用剂量,也曾称为无观察作用剂量(NOEL)或最高无害作用水平。未观察到有害作用剂量可以根据实验观察并经统计学处理而获得。需要注意的是,一种外源性化学物质的NOEL和LOAEL与所选择的动物种系和数目、观察指标的敏感性、暴露和观察时间的长短等多种因素有关,因此未观察到有害作用剂量并不意味着“零风险”(risk-free)。
3)安全限值 每日参考剂量(references doses, RfD)是指每日暴露的毒物不至于对人群健康产生有害影响的剂量水平。RfD是美国环境保护局(EPA)首次提出的,用于对非致癌性物质进行风险评价的参数。RfD是用未观察到有害作用剂量除以安全系数,包括不确定性因子(UF)和(或)校正因子(MF)获得。每日参考剂量的计算公式为:

安全系数是由动物试验资料外推至人的不确定因素和人群毒性资料本身的不确定因素而设置的转换系数。
基准剂量(benchmark dose, BMD)是指在取代有诸多局限性的未观察到有害作用剂量的概念。这种方法是把所有可用的实验资料都拟合到一条或数条剂量—反应曲线中,然后用这些剂量—反应曲线来估测总和效应的未观察到有害作用剂量范围,以有助于综合评价外源物对健康的影响。BMD已经成功地应用于发育毒性和生殖毒性的风险评估。
若用基准剂量取代未观察到有害作用剂量来计算每日参考剂量,则计算公式为:

每日允许摄入量(acceptable daily intake, ADI):指允许正常成人每日由外环境摄入体内的特定化学物质的总量。在此剂量下,终生每日摄入该化学物质不会对人体健康造成任何可测量出的健康危害,单位用mg/(kg体重·d)表示。
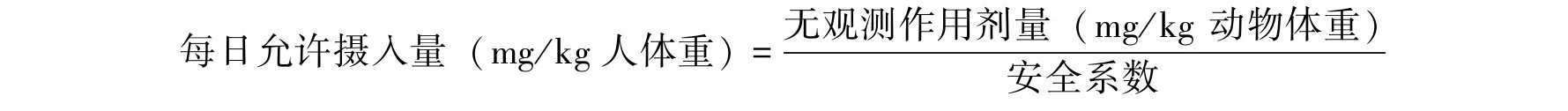
最高容许浓度(maximum allowable concentration, MAC):是指车间内工人工作地点的空气中某种化学物质不可超越的浓度。在此浓度下,工人长期从事生产劳动,不致引起任何急性或慢性的职业危害。在生活环境中,MAC是指对大气、水体、土壤等介质中有毒物质浓度的限量标准。
阈限值(threshold limit value, TLV):为美国政府工业卫生学家委员会(ACGIH)推荐的生产车间空气中有害物质的职业接触限值。为绝大多数工人每天反复接触不致引起损害作用的浓度。由于个体敏感性的差异,在此浓度下不排除少数工人出现不适、既往疾病恶化,甚至罹患职业病。
2.毒理学研究方法
通过毒理学研究可以识别、评价和控制外源物的潜在危害,预测其对人类毒性作用的一般规律。通常包括体外试验和动物试验、临床观察和现场调查等方面。
(1)体外试验 食品安全风险评估中,进行危害识别的研究方法主要是动物试验研究和流行病学调查。但是全世界每年越来越多的新化合物进入人类的商品领域,利用传统的动物试验取得完整的资料已远远不能满足需求。分子、细胞生物学、细胞组织器官培养等体外试验技术的发展进步,为危害识别的研究提供新的科学方法和工具,许多外源性毒性作用难以在人体或动物完成或观测,可在实验室利用体外试验进行。这些体外毒理学试验(重复剂量染毒试验体外方法、致癌性试验体外方法、生殖发育毒性试验体外方法等)用于危害识别的研究,为我们提供了更全面的毒理学资料,也可用于局部组织或靶器官的特异毒效应研究。体外毒理学研究除了用于危害识别外,还可用于危害特征描述。
体外试验的目的:可以对目标外源物进行初筛和毒性测试,研究化学物结构—活性关系,预测类似毒性的物质结构,研究探讨毒性作用机制特别是细胞和分子水平的毒性作用机制等。
体外试验的特点:体外试验方法虽然简单、快速、经济,具有实验条件比较容易控制等优点,但由于其生物试验均在离体条件下开展,不能精确模拟外源物在生物体的生物转运和生物转化过程,缺乏毒效学和毒性动力学的资料。(https://www.daowen.com)
体外试验的方法:现在国内外广泛采用的体外试验方法有多种微生物诱变试验、各种脏器灌流、不同组织薄片培养、细胞培养、细胞受体或其他亚细胞器组分的培养、提纯的酶和DNA分子等。食品安全风险评估中,进行危害识别研究的三种主要体外试验为:体外细胞培养试验、体外组织培养试验和脏器离体灌流试验。
(2)动物试验 动物试验是食品安全风险评估中进行毒理学研究的主要方法和手段,毒理学研究的最终目的是研究外源化学物对人体的损害作用(毒作用)及其机制,但不可能在人身上直接进行研究和观察,因此,要借助于动物体内试验研究,将各种受试物经口给予动物,观察其在动物身上的各种毒性反应、毒作用靶器官和毒作用机制,将实验动物的研究结果再外推到人。与体外试验相比,动物试验能提供更为全面的毒理学数据,在毒理学研究中占据特别重要的地位。危害识别是从观察到研究、从毒性到有害作用的发生、从作用的靶器官到组织的识别,最后对给定的暴露条件下可能导致有害作用是否需要评估作出科学的判断。由于流行病学数据难以获得,因此,目前危害识别中绝大多数毒理学资料主要来自动物试验。
动物试验可以提供以下几个方面的信息:
①了解外源性化学物的吸收、分布、排泄情况;
②确定毒性效应指标、阈值剂量或未观察到有害作用剂量等;
③探讨毒性作用机制和影响因素;
④确定化学物的相互作用;
⑤了解代谢途径、活性代谢物以及参与代谢的酶等;
⑥慢性中毒的可能性及其靶器官,毒性作用类型。
在实际工作中可以根据具体用途及要求,来确定试验的内容。
动物试验遵循的基本原则包括以下几点:
1)外推原则 前提假设人是最敏感的动物物种,且人和实验动物的生物学过程与体重或体表面积相关。那么可靠的动物试验结果可以外推于人,用来评估对人体的潜在危害。
2)高暴露原则 毒理学试验中实验模型所需的动物总是远少于处于危险中的人群,为了得到有统计学意义的可靠结果,实验动物必须暴露于高剂量,以使效应发生的频率足以被检测,这具有理论依据和实践意义;
3)相同暴露途径原则 毒理学试验中染毒途径的选择,应尽可能模拟人接触该受试物的方式。
(3)临床观察和现场调查 对人群的观察和调查在毒理学研究中具有体外试验和动物试验不可替代的作用,是外源性化学物对人体的最终危害证据的最可靠来源。
临床观察是指对短期或长期接触外源性化学物质的人体或人群的直接观察。临床观察主要通过药物的临床试验研究和中毒病人的治疗处理来获得毒理学资料。临床观察是新药上市前安全性研究以及上市药物毒副作用研究的关键环节。许多发达国家的临床试验要求遵循良好临床规范(good clinical practical, GCP),包括四期临床试验和上市药物不良反应监测。这方面我国还亟待完善。获得人体观察资料的另一条重要途径是救治中毒病人。这些病人可能是由于短期服用大量药物或者接触大量外源性化学物引起的急性中毒,也可能是长期职业接触或暴露于某些外源性化学物环境中而引起的慢性中毒。
现场调查在毒理学中包括卫生学调查和医学调查。卫生学调查是指对外源物的性质、来源和分布以及人群接触外源物的原因、方式和接触程度等的调查。医学调查则是通过人群的体格检查,结合各种实验室的辅助检查,观察毒物对人体健康的早期影响。现场调查是研究外源性化学物对接触人群健康影响以及有害效应的重要环节。由于影响化学物毒性危害的因素很多,包括化学物性质、环境因素、个体因素等。因此,外源性化学物的毒理学评价,不仅要以实验室研究(体外试验和动物试验)和临床观察获得的资料为依据,而且更要进行现场调查,收集外源性化学物的来源、分布、作用于人群的方式和条件、对人群健康的早期影响和远期效应等资料。
3.毒理学试验设计的原则
在食品安全风险评估中,常用作毒理学研究的实验动物有小鼠、大鼠、豚鼠和兔等。小鼠在生物医学研究中的应用最多的是各种药物的毒性试验,急性毒性试验、亚急性和慢性试验、半数致死量的测定;各种筛选性试验;生物效应测定;各种药物效价测定;照射剂量与生物效应试验。大鼠在生物医学研究中的应用也比较广泛,常用来做神经—内分泌试验研究,营养、代谢性疾病研究,药物研究,肿瘤研究,传染病研究,行为表现的研究,畸胎学研究和遗传学研究等。为了能有效地控制随机误差,以较少的试验对象取得较多而且可靠的试验数据,在毒理学研究试验设计时必须遵循:
(1)随机原则 在进行毒理学动物试验时,动物必须随机分组。
(2)重复原则 应有一定数量的重复观察结果,在大多数情况下样本量越大,越能反映总体参数的客观、真实情况,但为了控制试验规模和成本,在保证试验结果可靠性的前提下,选择适宜的样本量。
(3)对照原则 在试验时要对试验组设立可以对比的组。毒理学试验中常用的对照形式有以下几种:未处理对照(空白对照)、阴性对照(溶剂/赋形剂对照)、阳性对照、自身对照及历史性对照。
动物试验是以实验动物作为研究对象的,为获得可靠的研究结果,先决条件是正确地选择实验动物。实验动物的选择主要包括以下几个方面:
(1)物种选择 应选择在代谢、生物化学和毒理学特征上与人最接近,自然寿命不太长,易于饲养和实验操作,经济并易于获得的物种。目前常规选择的两个物种是啮齿类和非啮齿类。
(2)品系选择 品系是实验动物学的专用名词,指采用计划交配的方法,获得起源于共同祖先的一群动物。不同品系实验动物对外源化学物毒性反应有差别,所以毒理学研究要选择适宜的品系,对某种外源化学物毒理学系列研究中应固定使用同一品系动物,以求研究结果的稳定性。
(3)实验动物微生物控制的选择 对毒性研究及毒理学研究应使用Ⅱ级(或Ⅱ级以上)的动物,以保证实验结果的可靠性。
(4)最后是个体选择 还应考虑动物的性别、年龄、体重、生理和健康状况等。
4.毒理学试验设计要点
对于食品中的化学物,主要经口摄入。世界各国对动物试验和实验设计都出台了相关的标准要求,我国执行《食品安全性毒理学评价程序》中的16项国家标准。常用于危害识别的动物试验主要包括急性毒性试验、重复给药毒性试验、生殖和发育毒性试验、神经毒性试验、遗传毒性试验和致癌试验等。食品安全性毒理学评价程序和试验标准见表8-3。
表8-3 食品安全性毒理学评价程序和试验标准

●流行病学研究
流行病学是研究人群中疾病与健康状况的分布及其影响因素,并研究防治疾病及促进健康的策略和措施的科学。其最重要的目的是获得当前未明的疾病病因知识。因此,在食品安全中,流行病学已经成为揭示导致食源性疾病危害因子的重要手段。
从流行病学研究的性质来看,流行病学研究分为观察法、实验法和数理法,以前两种方法为主。按设计类型,流行病学研究可分为描述流行病学、分析流行病学、实验流行病学和理论流行病学四类,每种类型又包括多种研究设计。按照是否事先设立对照组,观察法又可进一步分为描述性研究和分析性研究。食品安全风险评估主要采用描述流行病学和分析流行病学研究。描述流行病学主要是描述疾病或健康状态的分布,起到揭示现象、为病因研究提供线索的作用,即提出假设。分析流行病学主要是检验或验证科研的假设。而实验流行病学则用于证实或确证假设。流行病学是研究特定人群中疾病和健康状态的分布及其决定因素以及防控疾病和促进健康的策略与措施的科学。从流行病学研究的性质来看,流行病学研究可以分为观察性研究、实验性研究和理论性研究,以前两种方法为主。
1.流行病学研究的分类(图8-6)
(1)观察性研究。
1)横断面研究 横断面研究(cross-sectional study),又称“现况研究”或“现况调查”,是在一个时间断面上或短暂的时间内收集调查人群的描述性信息,包括调查对象的疾病和健康状况及其影响因素,调查对象包括确定人群中所有的个体或这个人群中的代表性样本。横断面研究常用的方法包括抽样调查、普查和筛检,调查结果常被作为卫生保健服务和规划制定的重要参考。
2)生态学研究 生态学研究(ecological study)的特点是以群体而不是个体作为观察、分析单位,研究的人群可以是学校或班级、工厂、城镇甚至整个国家的人群。生态学研究是在群体水平上研究生活方式和生存条件对疾病(健康)的影响,分析某种因素的暴露与疾病(健康)的关系。生态学研究的目的有两个:一是产生或检验病因学假设;二是对人群干预实施的效果予以评价。
3)队列研究 队列研究(cohort study)又称随访研究(follow-up study),按照是否暴露于某种因素或者暴露的程度将研究人群分组,然后分析和比较这些人群组或研究队列的发病率或死亡率有无明显差别,从而判断暴露因素与疾病的关系。其目的是检验病因假设和描述基本的自然史。队列研究尤其适用于暴露率低的危险因素的研究。
4)病例对照研究(case-control study)又称病例历史或回顾性研究,既是流行病学研究中最重要的方法之一,也是检验病因假设的重要工具。病例对照研究是选择一定数量的患有某种疾病的病例为病例组,另选择一定数量的没有这种疾病的个体为对照组,调查病例组与对照组中某可疑因素出现的频率并进行比较,来分析该因素与这种疾病之间的关系。因为病例组与对照组来自不同的人群,因而难免有影响分析结果的因素导致偏差。病例对照研究可用于罕见疾病的病因调查,可以缩短研究周期和减少人力物力。
(2)实验性研究 实验性研究(experimental study)又称干预研究(interventional trials)或流行病学实验(epidemiological experiment),是研究者在一定程度上掌握着实验的条件,根据研究目的主动给予研究对象某种干预措施,比如施加或减少某种因素,然后追踪、观察和分析研究对象的结果。
根据研究目的和对象不同,实验性研究一般可以分为临床试验(clinical trial)、现场试验(field trial)和社区干预试验(community intervention and cluster randomized trial)3种。临床试验对象必须是诊断确切的病例,研究内容为临床治疗措施,目的是揭示某种疾病的致病机理或因素,评价某种疾病的疗法或发现预防疾病结局(如死亡或残疾)的方法。与临床试验不同,现场试验的研究对象不是病人,主要研究对象为未患病的健康人或高危人群中的个体,而不是群体或亚人群。与临床试验相同的是研究过程中直接对受试者施加干预措施。通常研究费用较高,必须到工厂、家庭或学校等“现场”进行调查或建立研究中心,现场试验仅适合于那些危害性大、发病范围广的疾病的预防研究。社区干预和整群随机试验又称社区为基础的公共卫生试验(community-based public health trial),社区干预试验中接受处理或某种预防措施的基本单位是整个社区或某一群体的亚群,如某学校的某个班级、某工厂的某个车间等。所以社区干预试验也可以认为是以社区为基础的现场干预实验的扩展。通常选择两个社区,一个施加干预措施,另一个作为对照,研究对照两个社区的发病率、死亡率以及可能的干预危险因素。社区干预试验一般历时较长,通常需6个月以上。试验结果可供相关部门的卫生规划和决策参考。
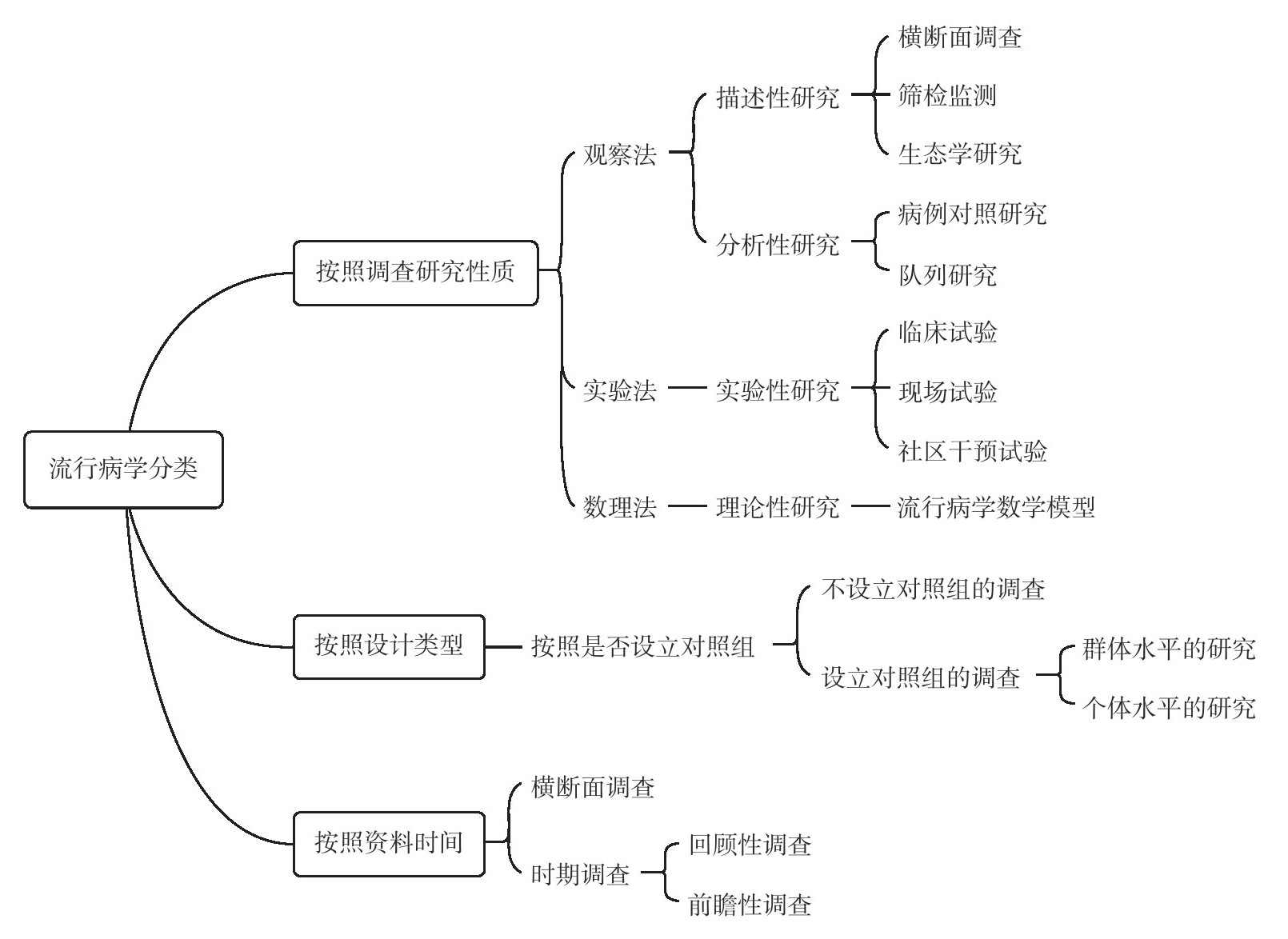
图8-6 流行病学研究方法分类
2.流行病学调查设计类型的选择
在开展流行病学调查时,需要采用什么设计类型,着重考虑收集和分析资料的细致程度及可能性。按照是否设立对照组分为不设立对照组的调查和设立对照组的调查。在实际调查中,往往要按资料时间分类的方法进行调查设计,收集的资料是某一时点的,或是一定时期内的(不在同一时点上)。这样的流行病学调查可分为时点调查即横断面调查和时期调查,时期调查又可以进一步划分为回顾性调查及前瞻性调查。
(1)按照是否设立对照组设计调查。
1)不设立对照组的调查 由于研究因素不明确或群组间无可比性等原因,不宜进行统计学的相关分析,对调查对象不进行分组。这些调查只能看作是对某些总体或其部分情况的了解。如“某一人群或地区死亡回顾调查”“某种疾病的普查及筛检”“污染与疾病监测”“临床病例随访”“个案调查”“病例报告”等。通过不设立对照组的调查描述疾病的分布时,往往要进行多个群组调查,利用多次调查的资料,尽可能得到一些暴露因素进行识别判断。
2)设立对照组的调查 设立对照组也就是将调查对象分成两个或多个组,各组之间除研究因素外,其他影响结果的因素应基本相同,即具有可比性。有了对照组就能通过统计学的比较分析来研究变量之间的相关联系,也就是说进入了分析流行病学的研究阶段。
群体水平的研究(group-level study):一般称为生态学研究,它是以群体为基本单位收集或分析资料,从而进行暴露与疾病关系的研究。在生态学研究中不知道(或无视)在暴露者中有多少发生了疾病或非暴露者中有多少发生了疾病,也就是不能(或没有)在特定的个体中将暴露与疾病联系起来。所谓疾病也包括其他效应,所谓暴露则指一切可能影响疾病的研究因素。例如,进行我国某县的胃癌死亡率与幽门螺杆菌(Hp)感染率之间的关系调查研究。研究设立了对照组,但用的是死亡率、感染率等反映群组特征的变量。感染Hp的人中有多少死于胃癌及未感染Hp的人中有多少死于胃癌是不知道的,即不能在特定的个体中将暴露与疾病联系起来。
个体水平的研究(individual-level study):是以个体为基本单位收集和分析资料,从而进行暴露与疾病关系的研究。这里的个体研究并不是只研究某个个体,而是以个体为基本单位收集和分析资料,以便在特定的个体中将暴露与疾病联系起来,进而研究其组成的群体之一。个体研究既可以进行发病者与未发病者中暴露情况的比较,也可以进行暴露者与非暴露者中发病等情况的比较。有的相关与回归研究等,只调查一组人群,以个人为测量和分析单位,看似没有对照组。实际上它是定群研究或病例对照研究分组很细的情况,即每个人互为内对照。有时疾病与暴露也是相对而言,它们只是不同的研究变量而已。例如“某人群血硒和发硒含量间的相关分析”“某地男孩身高与体重的相关与回归分析”等。
(2)按资料时间分类设计调查。
上述方法是按统计分析对调查设计的不同要求将流行病学调查进行“连续划分”的设计类型。在实际调查中,往往要按资料时间分类的方法进行调查设计,收集的资料是某一时点的,或是一定时期内的(不在同一时点上)。这样的流行病学调查可分为时点调查即横断面调查和时期调查,时期调查又可以进一步划分为回顾性调查及前瞻性调查。这些调查均可采用不同的设计类型;同样,每一种设计类型也均可用于横断面调查、回顾性调查及前瞻性调查。
1)横断面调查(cross-sectional study)又称为现况研究或现况调查或横断面研究,是指在特定时间断面或时期内,收集调查特定范围内人群中有关变量(因素)与疾病(健康状况)的关系。调查对象包括确定人群中所有的个体或这个人群中的代表性样本,也就是按设计要求收集某一时点或短暂时间内流行病学资料的调查,这些资料均可看成是在同一时点上。横断面调查不仅用于估计总体参数及生态学研究(如“某疾病的普查及筛检”“生理指标正常值范围的确定”、描述疾病分布等),也可进行病例对照研究和定群研究。
2)回顾性调查(retrospective study)也就是按设计要求收集过去某一段时间流行病学资料的调查。在回顾性调查中,研究因素与疾病均在开始收集资料前已经发生,研究者从各种记录或从调查对象及其亲属的回忆中获得资料。回顾性调查不仅可以进行病例对照研究,而且据统计大多数定群研究也是回顾性的,人们常称为“回顾性队列研究”(retrospective cohort study)或“历史性定群研究”(historical cohort study)等。例如,当要进行放射治疗与白血病关系的研究时,可以查阅几所医院早年的诊断记录,从中发现红细胞增多症或疑似患者,从医院病历中还可查到每一名患者所接受的治疗措施,然后通过各种记录调查各治疗组患者到某年某月为止发生急性白血病的情况,进行比较分析,就是回顾性定群研究。实际上大量的回顾性调查还是在描述流行病学等方面的应用,如“某人群或地区死亡回顾调查”“疾病流行因素的回顾及分析”以及经常性“个案调查”总结等。
3)前瞻性调查(prospective study)也就是按设计要求收集以后某一段时间流行病学资料的调查。在前瞻性调查中,疾病在开始收集资料前尚未发生,研究者直接观察研究因素与疾病发生等情况。与横断面调查和回顾性调查一样,前瞻性调查也适用于各种设计类型,定群研究只是类型之一,在描述流行病学等方面也有应用,如“疾病监测”“临床病例随访”等。目前很多学者已将病例对照研究应用于前瞻性调查。
流行病学调查方法可以根据需要从不同角度建立起多种分类系统,但分类根据必须统一,也就是每次划分必须按同一标准进行。如根据是否抽取样本还可以将流行病学调查分为普查和抽样调查等。有些人将流行病学调查方法按横断面调查(或现况研究)、病例对照研究及定群研究等分类或排列,在一次划分中使用了两个或两个以上的不同根据,使各种方法之间留有空缺(划分不全)或相互重叠(子项相容),不利于对流行病学调查方法的全面了解和系统掌握。
3.流行病学在危害识别中的应用
对于一个不明原因的食源性疾病而言,从不知病因到病因清楚,要经过一系列的研究。1987年,世界卫生组织召开会议指定了病因探索和鉴定的一般程序。一个未知的致病危害因子的探明一般分为3个阶段。首先要根据疾病和有关因素在人群中的分布特点,调查研究形成病因假设。其次通过病例对照研究和队列研究等流行病学研究方法,进一步深入反复研究以检验假设的正确性。最后结合生物学、医学及流行病学研究的综合结果证实假设。
(1)建立假设 建立假设是食源性疾病病因研究的第一步。通过历史性回顾研究、横断面研究(抽样调查或普查)、疾病登记和报告分析、生态学研究等有关疾病的大量信息和资料,运用逻辑思维进行科学的分析和概括,从中找出与疾病发生有关的现象或因素,形成病因假说。
(2)检验假说 食源性疾病病因假说建立之后,应用分析流行病学的方法,进一步研究推论因素和疾病之间的相关性,从而检验病因假说。常用的方法包括病例对照研究和队列研究。两者各有特点,前者容易找到研究对象,研究周期短,费用小,但只能确定联系的存在,不能确定因果联系;后者可观察因果的时间顺序,但只能用于发病率较高的疾病,花费时间、人力和财力较多。
(3)证实假说 通过病例对照和队列研究等对病因假说进行初步验证之后,一般还需要通过流行病学试验研究来证实病因假说。试验方法可人为地控制某些因素,比较暴露组和对照组(非暴露组)的发病率或死亡率的差异,从而证实病因假说的真实性。动物试验是试验研究最常用的方法,如通过动物试验已经证实黄曲霉毒素是肝癌的致病因素。在条件允许的情况下,也可进行人群干预试验,是干预减少人群中某种因素的存在,比较人群中某种疾病的发病率或死亡率,还可证实病因。如通过禁止生产销售反应停、教育孕妇停止服用反应停等干预措施之后,胎儿海豹肢畸形率明显下降,从而证实了反应停是胎儿海豹肢畸形的致病因素。
随着科学研究和文献检索手段的不断进展,文献在食品安全风险因子的危害识别实践中也起着越来越重要的作用。现在常用的是系统评价(systematic review)和荟萃分析(meta a⁃nalysis)等技术,通过对文献进行系统查询、严格评价和整合,获得某种疾病的风险因素比较客观的结论(参阅相关文献和论著)。
(4)病因推断标准 病因的确定是食源性疾病预防控制的关键,也是公共卫生和预防医学相关决策的重要依据。大量的信息和结果来自观察性流行病学研究,因此,病因推断要基于丰富可靠的科学研究结果,进行科学的概括和逻辑推理,然后作出判断。这就需要建立一些判断标准,来衡量因素和疾病之间因果关联的真实性。
归纳起来,现在被广泛认可的标准有以下几点:研究因素和疾病之间关联强度越大,因果联系的可能性越大;如果用不同的方法对不同的人群或在不同的时间获得的因素与疾病之间的联系是一致的,那么两者之间因果联系的可能性强;因素和疾病之间联系的特异性越强,则因果联系的可能性越大;研究因素的暴露必须在疾病发生之前;因素和疾病之间的联系要有充分的生物学依据;若研究因素与疾病之间存在剂量—反应关系,则因果联系的可能性大;因素和疾病之间的联系要得到相关实验结果的支持。这些原则可作为风险因素研究证据的评价指南。
●毒性测试
毒性测试(toxicity testing)方法的核心是通过人体组织中毒性作用的途径模型和人体代谢动力学建立干扰作用下的定量剂量—反应关系。这种方法的实现,可以避免生物学显著效应对人类毒性途径的干扰,改变目前高剂量动物试验的结果外推到低剂量暴露人体(群)时所带来的不确定性。在毒性测试中,化学物的性质以及剂量—反应关系和外推模型是两个重要的要素。化学物的性质包括物理化学性质、使用和环境浓度及其稳定性、人类暴露的可能途径、生物累积的可能性、代谢和降解产物、与细胞中物质的分子间相互作用、潜在的毒理学特性等。而剂量—反应和外推模型能揭示毒性测试数据的规律。测试数据是剂量—反应和外推模型的重要支撑,有时候会因为缺乏数据而使其应用受到影响。目前发展的毒性测试技术主要有:高通量筛查、干细胞生物学、功能基因组学、生物信息学、系统生物学、计算机系统生物学、生理药代动力学、结构—活性关系、生物标记物等。
结构—活性关系亦即构效关系,即化学物的生物学活性与其结构和官能团有关,可以利用已知的结构类似化学同系物的资料或用确定的靶点资料来预测化学物活性。根据大量现有化学物的毒性分析结果,利用结构—活性关系分析可预测一种新化学物的潜在毒性。结构—活性关系分析广泛应用于危害识别,如潜在的遗传毒性、生态毒性等。如果能同时预测化学物的人体摄入量,将有助于确定毒理学试验的设计方案。目前,这种方法已主要用于对包装材料迁移物和香料的评价。
利用结构—活性关系来预测一种新化学物的潜在毒性时,一般要建立定量结构—活性相关(QSAR)模型。定量结构—活性/性质相关(quantitative structure-activity/property relation⁃ship, QSAR/QSPR)研究就是描述化合物分子结构与生物活性及理化性质之间的因果关系,揭示结构与生物活性及理化性质之间的量变规律,并利用规律预测新的化合物的活性/性质。目前QSAR/QSPR已在食品抗氧化剂、食品防腐剂、食品风味成分和食品成分安全性评价等方面向食品研究领域渗透。QSAR分为二维定量构效关系方法(2D-QSAR),包括Hansch法、基团贡献法和分子连接性指数法等;三维定量构效关系方法(3D-QSAR),与2D-QSAR比较,3D-QSAR方法能间接反映药物分子和靶点之间的非键相互作用特征;分子全息定量构效关系(holographic QSAR, HQSAR)。所谓分子全息是一种新的分子结构表征技术。基于分子全息的结构—活性相关技术能够将化合物的生物活性与其以分子的亚结构碎片的类型和数量所描述的分子组成之间建立相关关系,应用偏最小二乘回归技术建立定量预测模型,从而对化合物的生物活性进行预测。
8.2.2.2 危害特征描述
经过危害识别确定了危害因子之后,风险评估的第二步就是危害特征描述(hazard char⁃acterization)。世界卫生组织(WHO)国际化学品安全规划署(International Programme on Chemical Safety, IPCS)(2004)对危害特征描述的定义为:“对一种因素或状况引起潜在不良作用的固有特性进行的定性和定量(可能情况下)描述,应包括剂量—反应评估及其伴随的不确定性。”即指对食品中生物性、化学性和物理性因素产生的健康损害效应的特性进行定性和(或)定量描述。《食品安全风险评估管理规定》对危害特征描述的定义为:“对与危害相关的不良健康作用进行定性或定量描述。可以利用动物试验、临床研究以及流行病学研究确定危害与各种不良健康作用之间的剂量—反应关系、作用机制等,如果可能,对于毒性作用有阈值的危害应建立人体安全摄入量水平。”
危害特征描述的主要目的是描述食品中某种危害物质的剂量或暴露量与某种不良健康损害效应的发生率之间的关系,关键在于确定临界效应,即随着剂量或暴露量增加首先观察到的不良效应。危害特征描述通常包含两层含义:一是确定危害—效应关系是否存在;二是在确定这种关系存在的基础上,建立剂量—反应关系,即采用数学模型对人体摄入的有害物质剂量与人体发生不良反应的可能性之间的关系进行描述。
具体而言,危害特征描述通常要解决的问题包括:建立主要效应的剂量—反应关系;评估外剂量和内剂量;确定最敏感种属和品系;确定种属差异(定性和定量);作用方式的特征描述,或是描述主要特征机制;从高剂量外推到低剂量以及从实验动物外推到人。
●剂量—反应关系
危害特征描述的核心内容是进行剂量—反应关系的评估(dose-response assessment)。危害特征描述的剂量—反应关系评估是描述暴露于特定危害物时造成可能危害性的前提,同时也是安全性评价时建立指南或标准的起点。
1.基本概念
(1)剂量 毒理学研究中的剂量(dose)通常有3种基本表达方式:一是给予量或外部剂量,也称作用剂量;二是内部剂量或吸收剂量;三是靶剂量或组织剂量(也称有效剂量)。它们都是相互联系的,可以用于不同的剂量—反应关系分析。
外部剂量指在一定途径和频率条件下,给予实验动物或人的外源化学物或微生物数量。在JECFA术语中,外部剂量常指暴露量或摄入量。外部暴露常在流行病学研究观察法中应用。
内部剂量是指外源化学物与机体接触后机体获得的量或外部剂量被吸收进入体内循环的量,也可以指机体与微生物接触后被感染存活的微生物数量。对于外源化学物来说,这是化学物质被机体吸收、分配、代谢、排泄的结果,其数据来源于大量的毒物代谢动力学研究。对于微生物而言,这是病原微生物、食品和宿主(包括动物和人)相互妥协的结果。
靶剂量是外源化学物被机体吸收并分布在特定器官中的有效剂量,或指微生物感染机体后出现在某特定器官的量。对于外源化学物,可以利用代谢动力学分析方法决定靶剂量是指亲代复合物还是亲代与子代的新陈代谢产物,另外还需要考虑剂量是按照最大值还是按平均值来度量。对于微生物,靶剂量是微生物感染致病机理研究的结果。
在描述外源化学物剂量时有两个重要的决定因素:给予频率和持续时间。不同的剂量水平、频率和持续时间可以导致急性、亚慢性或慢性中毒等不同的毒性效应。在剂量—反应评估过程中,剂量可以任选三种方式中的一种,但原则上要求剂量描述应都包括毒性、频率和时间。剂量可以用很多度量方法,包括简单的给予剂量(例如mg/kg体重)、每日摄入量[例如mg/(kg体重·d)]等。引起食物中毒的微生物因其具有不同的致病力而导致各种急、慢性或间歇性机体反应,很少是累积效应的结果,因此微生物剂量多强调确定频率下感染量或一次性的摄入量,其表达方式一般是菌落总数的常用对数值。
在毒理学或流行病学研究中,暴露剂量(外部剂量)很难精确地测量,经常需各种假设来估计。有时暴露可通过检测血液生物学标志物或靶器官浓度先获得内部剂量或靶剂量,再通过内部剂量向外部剂量的生物转化来进行剂量—反应评估。然而关于生物转化的关联性,目前研究还非常有限,很多转化标准常是在达到最多暴露量的多年后才会制定。有时,在建立剂量—反应模型之前首先将动物试验的数据外推转化成人体暴露剂量,再与产生反应的人体内暴露数据建立一个剂量—反应模型。但是,这种模型需要人们了解外源化合物在动物和人体内的吸收率、靶器官、代谢、排泄和反应等生化过程,以及微生物病原因子、食品介质和不同宿主因子相互影响感染发病的机理。但正是这些知识的缺乏增加了这些模型分析的不确定性。
总之,使用外部剂量时,应考虑外源物在生物体内的吸收系数、系数速率,以及其他影响因素,最好能辅以血液、组织和器官或其他生物体液的测定,以更准确地反映生物体的实际暴露水平。
(2)反应 反应(effect, reaction)也称效应、作用,是指机体暴露于外源性物质之后出现的可观察或可检测到的生物学改变。在毒理学研究中,反应可分为适应性反应和有害反应。有害反应是指暴露于较高剂量水平时,其形态、生理、生长、发育、生殖或有机系统的改变,这些改变导致身体机能的削弱或机体对环境变化的反应能力降低,使受损害风险增加。这种反应有时表现为种属或器官差异,也有的是个体差异。在大多数情况下,当暴露于某一低剂量水平时,就会引起适应性反应。这些反应是可逆的,当暴露停止后,机体可以恢复到原来的状态。在不同的试验受体上(动物、人体、细胞培养)随机进行的同剂量—反应也是不同的,这种随机的反应差异常常会符合某种统计分布,如某种群体受体中某一反应的已知频率统计分布。总之,统计分布主要特点就是提供主要趋势(常用中值或平均值来表示)和数据的有效范围(常用标准偏差来表示)。
大部分剂量—反应分析数据可归为4类:质反应(qualitative responses)、计数(counts)、连续测量(continuous measures)和有序分类值(ordered categorical measures)。4类数据在建立剂量—反应分析模型时计算方式有些不同,但总的来说,剂量—反应分析模型是用来描述暴露剂量或时间与反应之间的关系。
2.剂量—反应关系类型
现代毒理学又将剂量—反应关系分为定量个体剂量—反应关系和定性群体剂量—反应关系两种基本类型。定量个体剂量—反应关系是描述不同剂量的外源物引起生物个体的某种生物效应强度,以及两者之间的依存关系。例如,在相当宽的剂量范围内,有机磷农药可以抑制乙酰胆碱酯酶活性,其抑制程度随剂量的增加而加重。定性群体剂量—反应关系反映不同剂量外源物引起的某种生物效应在一个群体(实验动物或调研人群)中的分布情况,即该效应的发生率或反应率,实质上是外源物的剂量与生物体的质效应间的关系。
在研究这类剂量—反应关系时,要首先确定观察终点,通常是以动物试验的死亡率、人群肿瘤发生率等“有”或“无”生物效应作为观察终点,然后根据诱发群体中每一个出现观察终点的剂量,确定剂量—反应关系。
3.剂量—反应关系曲线形式
把外源物暴露的剂量作为横坐标(自变量)、以生物学的毒性效应为纵坐标(因变量)作图,就可以得到剂量—反应曲线。剂量—反应曲线主要有三种形式:对数曲线、S形曲线和直线。毒理学上最常见的一类是长尾的不对称S形曲线,这反映暴露量在增加的过程中,反应的强度或反应率的改变呈偏态分布。
剂量—反应关系可用剂量—反应关系曲线表示,只有对某种物质的剂量—反应曲线有足够的了解,才能预测暴露于已知或预期剂量水平时的危险性。健康指导值或MOE的计算需要在剂量—反应曲线上确定1个参考点或分离点(point of departure, POD)、对已知反应的未观察到有害作用的剂量(no-observe-adverse-effect level, NOAEL)、阈值、观察到有害作用的最低剂量(lowest-observed-adverse-effect level, LOAEL)、基准剂量(benchmark dose, BMD)以及在最敏感种属中观察的临界效应的斜率,所有这些指标都是危险性评估的基础。
4.剂量—反应模型的构建
在危害特征描述过程中,可采用动物试验、体外试验等毒理学试验数据或人群流行病学数据资料来进行剂量—反应关系评估,运用数学模型拟合剂量—反应关系曲线。危害特征描述的核心内容是获得安全剂量的起始点(或参考点),如未观察到有害作用剂量(no observed adverse effect level, NOAEL)、最小观察到有害作用剂量(lowest observed adverse effect level, LOAEL)、基准剂量下限值(benchmark dose lower confidence limit, BMDL)等。
目前,剂量—反应数据可用数学模型来描述。剂量—反应模型(dose reaction modeling, DRM)是对科学数据进行拟合的数学表达方法,描述了剂量与反应之间关系的特征。数学模型包含三个基本要素:推导模型的假设、模型的函数表达式、函数表达式的参数。
建立剂量—反应分析模型,首先,要选择符合风险特点的分析用数据。一般可从数据质量、有用程度、可获得性以及样本的大小等角度出发,筛选合适的剂量—反应数据。其次,选择合适的模型。模型分为以实验为基础的经验模型和生物学模型两种。大部分剂量—反应分析模型用的是经验模型,该类模型数据不是基于机理机制的数学描述。最后,确定数据与模型的统计学关系。最普遍的统计学方法是假设反应的统计分布,利用该分布得到一个数学函数来描述数据与模型的拟合度。接下来,通过数据拟合确定模型。如果可以得到数据与模型有规律的统计关系,就可选出关系函数最优化的参数值。例如,常采用的最小二乘法,通过最小化预测值与观测值差的平方和来连接数据和模型。当然,模型参数估计还可以用更简单的方法,如通过数据点画一条直线,通过计算直线的斜率和截距可估计该线性模型的参数。一般来说,统计方法优于简单方法。
接下来是最重要的一步,对结果进行分析。根据前面步骤获得的模型参数和数学公式,通过计算输出、模型预测、基准剂量测定或直接外推等方式,对反应或剂量水平进行预测,从而制定相应的健康指导值。预测方法可以通过从某试验结果外推到其他暴露剂量或从实验动物外推到人来进行。在化学危害物评估过程中,应用剂量—反应分析模型预测可以定量评估无阈值效应和有阈值效应的风险。由于遗传毒性化学物的安全剂量通常以百万分之一的发生率为标准,而动物实验所测的危险发生率一般在1/20左右,因此,无阈值方法通常将剂量—反应关系外推至少4个数量级,这给结果带来了很大的不确定性。有阈值法通常以NOAEL或BMD为指标,并通过使用不确定系数,获得该化学物的安全暴露剂量水平。在微生物风险评估过程中剂量—反应分析模型应该可以量化风险,并结合暴露评估确定感染率或发病率,从而制定从农田到餐桌过程的一系列关键控制点和关键限值。总之,通过剂量—反应分析模型预测,公共卫生部门一般采取禁用或规定接触剂量水平等手段来降低有害化学物过量使用带来的风险,或采用制定食品标准或建立HACCP关键控制点等方式来控制食品被病原微生物污染的风险。最后,评估分析结果。通过模型比较和不确定性分析来描述模型预测的灵敏度,判断最终预测结果的可靠性。
5.剂量—反应分析方法
在剂量—反应分析模型过程中,有些人群是典型的潜在暴露人群而且有相似的暴露水平,可以获得充足的人体数据,但大部分情况下,剂量—反应分析方法都使用外推。由于食品中所研究的化学物质的实际含量很低,而一般毒理学试验的剂量又必须很高,因此在进行危害描述时,就需要根据动物实验的结论对人类的影响进行估计。为了比较并得出人类的允许摄入水平,需要把动物试验的较高剂量数据经过处理外推到比它低得多的剂量。
外推法基本可以分为两类:一类是评估剂量—反应分析中超出某实验数据范围的暴露风险;另一类是估计健康推荐值,例如ADI,而不对风险量化。简单来说,危害描述一般是由动物毒理学试验获得的数据外推到人,计算人体的每日容许摄入量(ADI值)。严格来说,对于食品添加剂、农药和兽药残留,可制定ADI值。对于食品污染物,分两种情形:针对蓄积性污染物如铅、镉、汞等制定暂定每周耐受摄入量(PTWI值),针对非蓄积性污染物如砷暂定每日耐受摄入量(PTDI值)。对于营养素,制定每日推荐摄入量(RDI值)。目前,国际上由JECFA制定食品添加剂和兽药残留的ADI值以及污染物的PTWI/PTDI值,由JMPR制定农药残留的ADI值。
动物试验外推到人通常有3种基本的方法:利用不确定系数(或安全系数);利用药物动力学外推;利用数学模型。药物动力学外推广泛用于药品安全性评价并考虑到受体敏感性的差别,毒理学家对于最好的模型及模型的生物学意义尚无统一的意见。大多数情况下,由于剂量—反应分析模型数据都来源于实验动物,并且设计的给予剂量明显超过了人类的潜在暴露量。动物试验较高剂量外推到低得多的人剂量水平时,这些外推步骤无论在定性还是定量上都存在不确定性。
(1)有阈值法 对于具有毒作用阈值的物质,在危害特征描述这一步骤中,通常能够推导得出经食物摄入该危害物质的健康指导值,例如适用于食品添加剂、农药残留或兽药残留的ADI值,适用于污染物的可耐受摄入量(tolerable intake, TI)等。通过毒理学方法得出其ADI值。实验获得的NOEL或NOAEL值乘以合适的安全系数等于安全水平或每日允许摄入量。这种计算方式的理论依据是:人体和实验动物存在合理的可比较剂量的阈值。对人类而言,可能要更敏感一些,遗传特性的差别更大一些,而且人类的饮食习惯更多样化。鉴于此JECFA和JMPR采用安全系数以克服这些不确定性。通过对长期的动物试验数据研究中得出安全系数为100,但不同国家的监管机构有时采用不同的安全系数。在可用数据非常少或制定暂行ADI值时JECFA也使用更大的安全系数。如上所述,安全系数用于弥补人群中的差异。所以在理论上某些个体的敏感程度超出了安全系数的范围。对潜在关键作用建议使用剂量—反应模型,衍生出基准剂量BMD和对特定事件(如5%或10%事件发生)采用置信区间下限(lower confidence limit, BMDL),如ED10或ED05等概念。通过比较BMDL,可以明确关键的作用,以最低的BMDL作为风险描述的作用始点。
对于大多数危害因素,通过直接采用国内外权威评估报告及数据,可以确定化学物的膳食健康指导值或微生物的剂量—反应关系。对于少数尚未建立膳食健康指导值的化学物,可利用文献资料或试验获得未观察到不良作用水平(NOAEL)、观察到不良作用的最低水平(LOAEL)或基准剂量低限值(BMDL)等毒理学剂量参数,根据上述风险评估关键点中所确定的不确定系数,推算出膳食健康指导值。对于无法获得剂量—反应关系资料的微生物,可根据专家意见确定危害特征描述需要考虑的重要因素(如感染力等);也可利用风险排序获得微生物或其所致疾病严重程度的特征描述。
(2)无阈值法 对于无阈值的危害物质,可结合暴露评估对这些物质的暴露限值(margin of exposure, MOE)进行估计,对特定暴露水平下的风险大小进行定量估计。对于没有阈值剂量的有害作用,可以采用低剂量外推或应用一些数学模型来研究。定量评估无阈值效应的危险性,通常使用动物试验中发病率的剂量—反应资料来估计与人类相关的暴露水平的危险性。由于曲线估计的不准确性,在动物试验观察范围内的剂量—反应曲线通常不能外推出低危险性的估计值。因此,最好选择适当的模型。人们提出了各种各样的外推模型。低剂量线性模型是最简单的模型,广泛适用于多种类型的实验数据。国际上使用的方法和模型各种各样,如线性多阶段模型和从剂量—反应曲线上的某一固定点(TD50、TD25、TD10、TD5或NOAEL)进行外推的简单线性外推法。目前的模型都是利用实验性肿瘤发生率与剂量,几乎没有其他生物学资料。没有一个模型可以超出实验室范围的验证,因而也没有对高剂量毒性、促细胞增殖或DNA修复等作用进行校正。基于这样一种原因,目前的线性模型只是对风险的保守估计。如对致突变、遗传毒性致癌物而言,一般不能采用“NOEL—安全系数”法来制定允许摄入量,因为即使在最低的摄入量时,仍然有致癌的风险存在。在此情况下,动物实验得出的BMDL被用作风险描述的起始点(point of departure)。因此,对遗传致癌物的管理办法有两种:一是禁止商业化地使用该种化学物品;二是建立一个足够小的被认为是可以忽略的对健康影响甚微的或社会能够接受的风险水平。在应用后者的过程中,要对致癌物进行定量风险评估。
8.2.2.3 暴露评估
暴露评估是实现风险量化的重要步骤,指人类和其他物种暴露于危害的实际程度和持续时间,一项暴露评估包括暴露在危害物质下的人群规模、自然特点以及暴露的程度、频率和持续时间等内容。国际化学品安全规划署(IPCS)对暴露评估的定义为:对一种生物、系统或(亚)人群暴露于某种因素(及其衍生物)所进行的评价。国际食品法典委员会(CAC)对暴露评估的定义主要在食品研究范围内,暴露评估为对一种化学物或生物经食物的可能摄入量以及经其他相关途径的暴露量的定量和(或)定性评价。这里的食品范围较广,如各类食物、饮料、饮用水和膳食补充剂等。
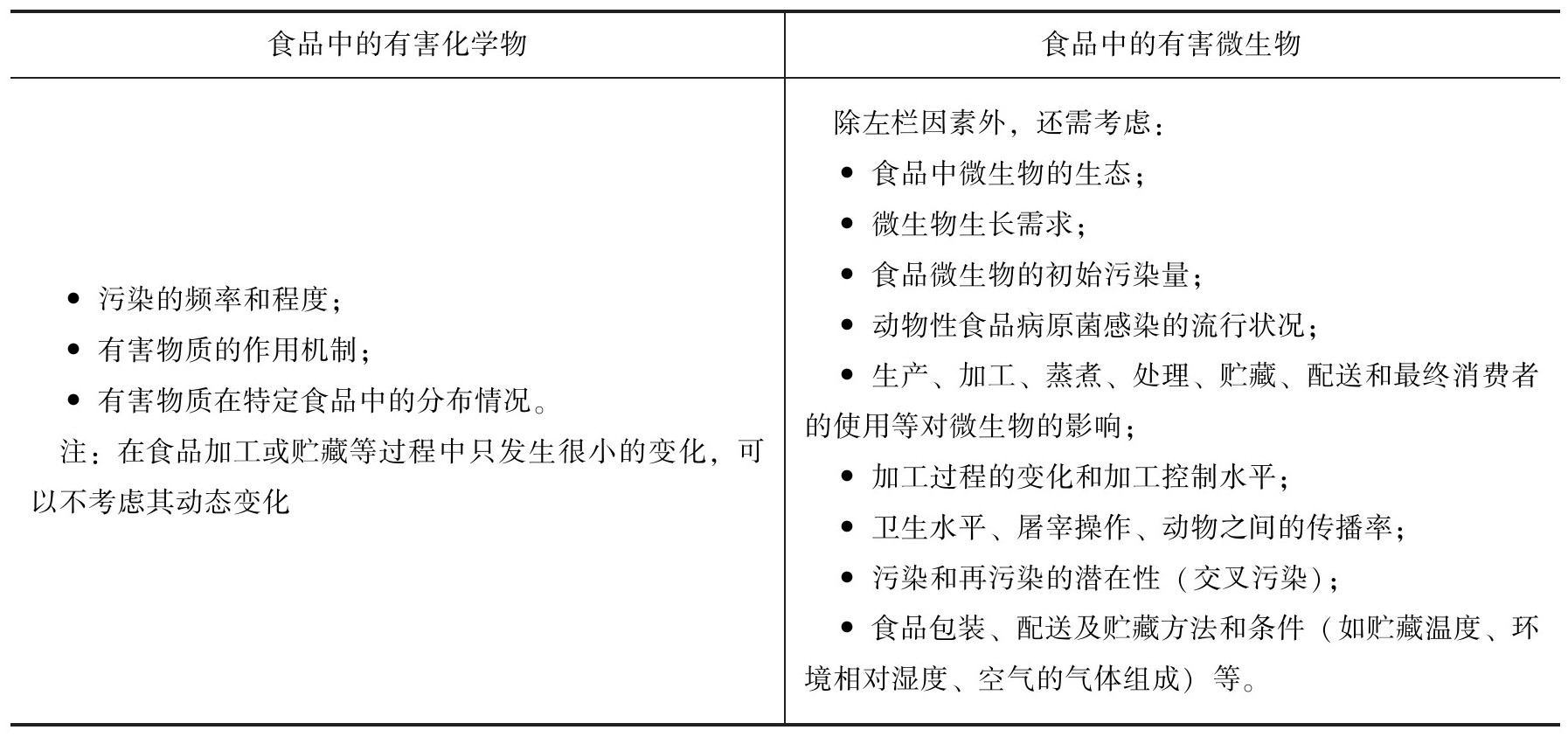
●暴露评估的对象(表8-4)
(1)有害化学物 膳食暴露评估是将食物消费量数据与食品中有害物的浓度数据进行整合,然后将获得的暴露估计值与所关注有害物的相关健康指导值进行比较,作为后续的风险特征描述的一部分。对于食品中的有害化学物,暴露评估时要考虑该化学物在膳食中是否存在、浓度、含有该化学物的食物的消费模式、大量食用问题食物的消费者和食物中含有高浓度该化学物的可能性。通常情况下,暴露评估将得出一系列摄入量或暴露量估计值,也可以根据人群(如分为婴儿、儿童、成人或分为易感、非易感)分组分别进行估计。这里的化学物包括了食品添加剂、污染物、加工助剂、营养素、兽药和农药残留等。
(2)有害微生物 对于食品中的有害生物,一般专指人类摄入食物后可导致食物中毒或食源性疾病的致病微生物。引起食物中毒的微生物通常可分为两大类:感染型如沙门氏菌的各种血清型、空肠弯曲菌、致病性大肠埃希氏菌;毒素型如蜡样芽孢杆菌、金黄色葡萄球菌、肉毒梭菌。另一种分类方法是根据致病力的强弱,按国际食品微生物标准委员会(ICMSF)的建议分为4类:病症温和、没有生命危险、没有后遗症、病程短、能自我恢复(如蜡样芽孢杆菌、A型产气荚膜梭菌、诺如病毒、EPEC型和ETEC型大肠埃希氏菌、金黄色葡萄球菌、非O1型和非O159型霍乱弧菌、副溶血性弧菌);危害严重、致残但不危及生命、少有后遗症、病程中等(空肠弯曲菌、大肠埃希氏菌、肠炎沙门氏菌、鼠伤寒沙门氏菌、志贺氏菌、甲肝病毒、单增李斯特氏菌、微小隐孢子虫、致病性小肠结肠炎耶尔森氏菌、卡宴环孢子球虫);对大众有严重危害、有生命危险、慢性后遗症、病程长[布鲁氏菌病、肉毒毒素、EHEC(HUS)、伤寒沙门氏菌、副伤寒沙门氏菌、结核杆菌、痢疾志贺氏菌、黄曲霉毒素、O1型和O139型霍乱弧菌];特殊人群有严重危害、有生命危险、慢性后遗症、病程长(O19型空肠弯曲菌、C型产气荚膜梭菌、创伤弧菌、阪崎肠杆菌)。
根据暴露持续时间的长短,膳食暴露评估可分为急性暴露评估和慢性暴露评估。急性暴露是指24h内的短期暴露,慢性暴露是指每天暴露并持续终生。无论是急性暴露还是慢性暴露,一项完整的暴露评估原则上应覆盖一般人群和重点关注人群。重点人群是指易感人群或与一般人群的暴露水平有显著差别的人群,如婴儿、儿童、孕妇、老年人和素食者等。
表8-4 开展暴露评估主要考虑的因素
另外,WHO/FAO在风险评估报告提到了开展暴露评估总体考虑的因素:
①在选择适当的食物消费数据和食品中有害物浓度数据前,必须明确膳食暴露评估的目的;
②确保暴露评估结果的等同性,暴露评估程序可能针对不同对象有差异,但这些程序应该对消费者产生相同的保护水平;
③无论毒理学结果的严重程度、食品化学物的类型、可能关注的特定人群还是进行暴露评估的原因如何,都应选择最适宜的数据和方法,尽可能保证评估方法的一致性;
④国际层面的暴露评估结果应该大于或等于(就营养素缺乏而言,应该低于)国家层面进行的最好的膳食暴露评估结果;
⑤暴露评估应该覆盖普通人群,以及易感或预期暴露水平明显不同于普通人群的关键人群(例如婴幼儿、儿童、孕妇或老年人);
⑥各国基于本国的膳食消费数据和浓度数据,并使用国际上的营养素和毒理学参考值,由此便于国际组织的汇总和比较。
●暴露评估的步骤
①可以采用逐步测试、筛选的方法在尽可能短的时间内利用最少的资源,从大量可能存在的有害物中排除没有安全隐患的物质。这部分物质无须进行精确的暴露评估。但是使用筛选法时,需要在食品消费量和有害物浓度方面使用保守假设,以高估高消费人群的暴露水平,以避免由于错误的暴露评估与筛选结果做出错误的安全结论。
②为了有效筛选有害物并建立风险评估优先机制,筛选过程中不应使用非持续的单点膳食模式来评估消费量,同时还应考虑到消费量的生理极限。要不断完善评估方法和步骤,确保能够正确评估某种特定有害物的潜在高膳食暴露水平。
③暴露评估方法必须考虑特殊人群,如大量消费某些特定食品的人群,因为一些消费者可能是某些所关注化学物浓度含量极高的食品或品牌的忠实消费者,有些消费者也可能会偶尔食用有害物浓度高的食品。
●膳食暴露评估结果描述的原则
暴露评估过程往往是基于特定的假设和数学模型,因此在结果描述时应注意以下原则:
①详细描述暴露评估方法,包括所选用的模型、数据、假设、局限性和不确定性;
②阐明在暴露评估中所采用的有关食品中化学物浓度数据和食品消费量数据来源或假设;
③评估结果应包括一般人群和高暴露人群膳食中待评估物质的摄入水平(如暴露量的第90百分位数,第95百分位数或第97.5百分位数),并说明其计算推导过程。
●暴露评估的数据来源
暴露评估的关键是获得计算暴露量所需的数据。这些数据是环境或特定产品中,危害物质的出现情况与感染方面的数据。长时间的监测数据则是要求更高水平的评估结果的关键。由于绝大多数情况下,对危害物质的污染情况的调查需要较长的时间,并通过多种途径进行,这就需要获得有关其特性、内外因的影响以及分析方法中各参数方面的准确数据。还需要使用消费方式方面的信息,这与不同人群使用或饮用、摄入剂量、加工处理方式和消费方式等有关,包括不正常的甚至是极端的暴露情况。在多数情况下,要进行风险评估的地方缺少定量分析所需要的数据资料。进行暴露评估的关键是需要提高数据资料的可比性和同质性,数据的同质性应至少保证所提供的数据具有类似的格式,并为所需求的目标提供必要的信息。
1.食品中有害物的浓度
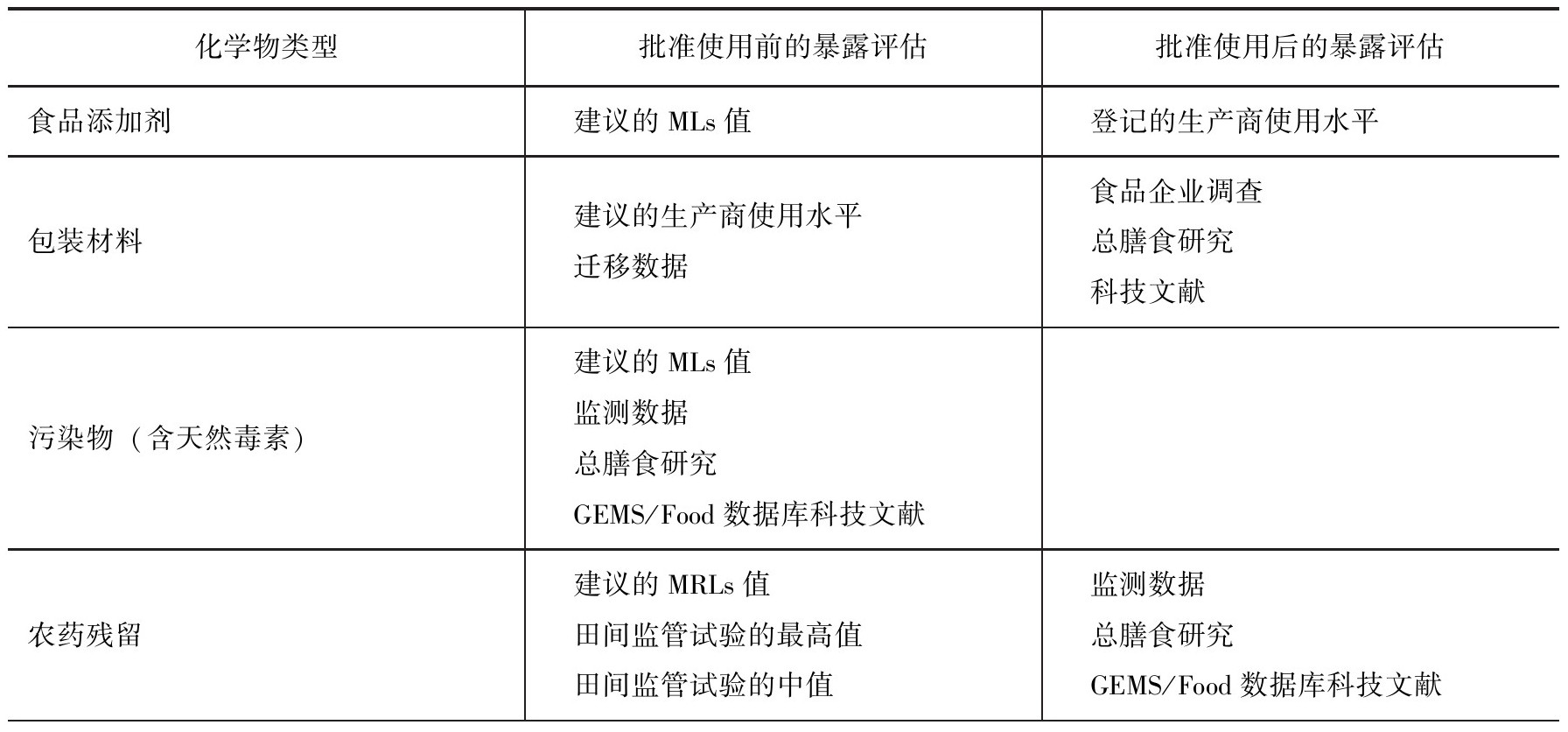
(1)化学物浓度数据 暴露评估所需数据可分为食品中有害物的浓度和食品消费量两部分。其中有害物可分为化学物和微生物两方面。化学物可以是:批准使用前(尚未批准使用);已经在食物中使用多年(已批准使用);天然在食品中或由于污染所导致的。在第一种情况中,化学物的浓度可以从食品制造和加工商那里获得。其他两种情况,可以从市场上的食品中获得化学物的浓度数据。食品中化学物浓度数据来源见表8-5。
表8-5 食品中化学物浓度数据来源
续表

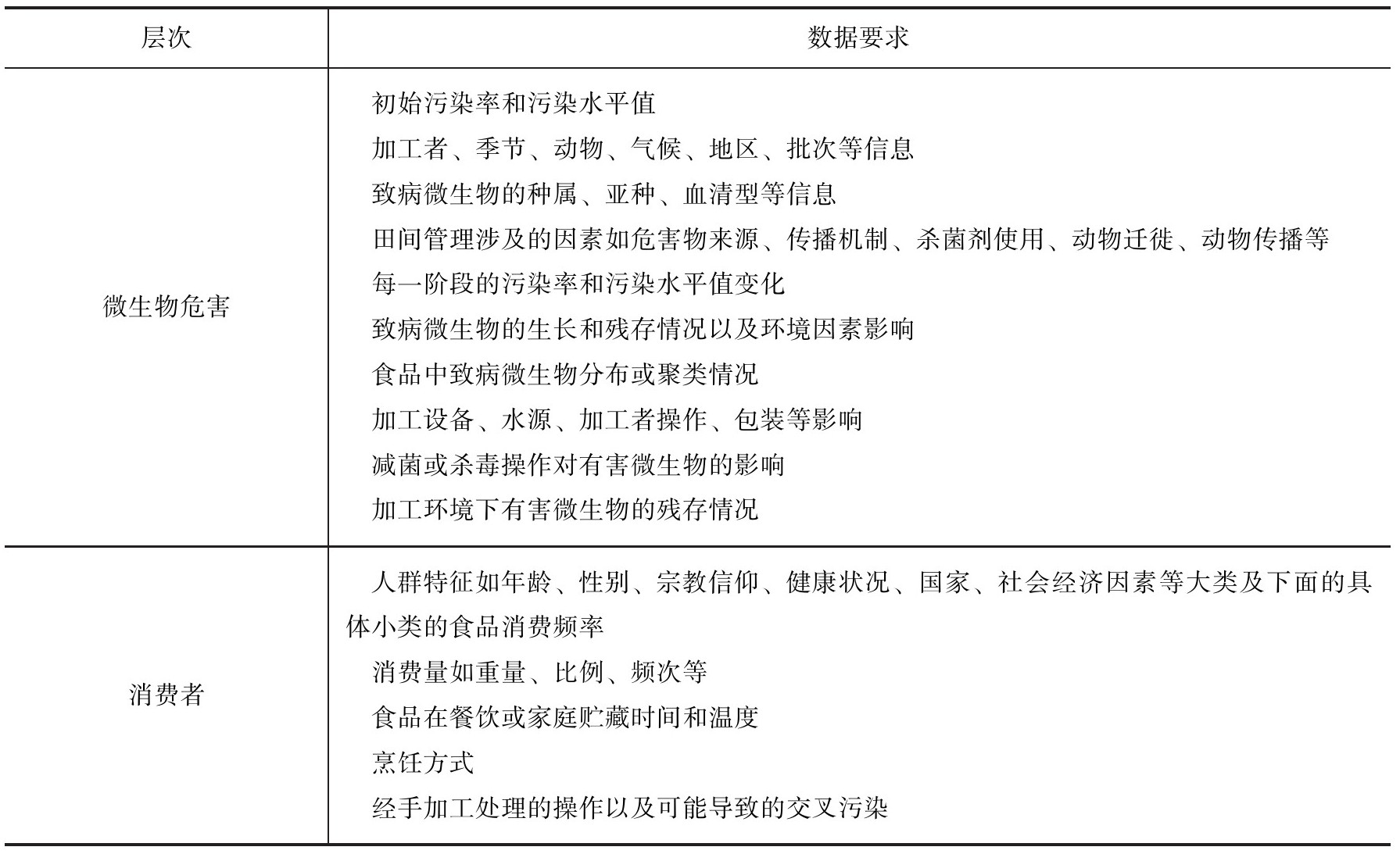
(2)微生物数据来源 微生物数据的来源广泛,包括:国家食源性疾病监测数据,如FoodNet与PulseNet数据库,我国国家食品安全风险评估中心也已构建了类似的国家级食源性疾病监测平台,这些数据都作为食品中致病微生物的暴露评估的主要依据;流行病学调查数据,此类调查数据可为微生物暴露评估提供特定消费者和特定致病微生物的大量信息;系统监测数据,由不同国家的政府机构组织对食品和水进行的定期监测;初级农畜产品调研数据,这些数据适用于建立预测微生物模型;食品企业自查数据;政府工作报告数据,如常见的年鉴形式,包括食品污染数据、食品消费数据、人口统计、消费者行为、营养膳食调查、食品生产数据、食品被召回情况、进出口检验和检疫数据等,以及开展的完整的风险评估报告;科技文献发表数据,包括期刊论文、简报、摘要、学术研讨会论文集等,此类数据最适用于开展暴露评估中很多不宜获得的信息,如加工再污染、厨房中交叉污染的数据,都可以整合到暴露评估中。将暴露评估的微生物数据分为食品产品、食品链、微生物危害和消费者四个层次,每个层次数据的具体要求见表8-6。
表8-6 暴露评估中所需的微生物数据要求

续表
数据缺失和不足是开展微生物暴露评估时常见的难题,但这不应成为阻碍开展暴露评估的借口,可以仔细分析问题所在,例如召集风险评估者和风险管理者进一步沟通,可以确认进一步补充数据的思路或方法。而且有时即使存在合适的典型数据,这一数据不足的问题仍然存在,例如有些数据属于政府或监管部门对外保密的,有些数据来源于商业机构对外需收费后提供。风险评估就是一个不断补充新数据、升级评估结果的循环过程。已有一些应对数据缺失或不足的措施,如模型重构、预测微生物建模、选用替代数据、寻求专家意见等。
2.食物消费数据
食物消费数据反映了个体或群体消费固体食物、饮料(包括饮水)、膳食补充剂的量。食物消费数据可以通过个人或家庭水平的食物消费调查或通过食物生产统计进行估计。食物消费的调查包括记录或日志、食物频率问卷(FFQ)、膳食回顾法和总膳食研究(TDS)。从食物消费调查获取的数据的质量取决于调查的设计、使用的方法和工具、受访者的意愿和记忆、统计处理和数据处理等因素。食物生产统计代表整个人群可消费的食物,通常以生产的原料形式表示。
食物消费数据库主要基于人群调查方法收集数据,食物平衡表数据包括可供人群消费的现有食物数量,通过国家统计的食物产量、消耗或利用的数据而获得。大多数国家一般都可以获得这些数据。例如美国农业部经济研究所和澳大利亚统计局编写的食物平衡表。世界卫生组织统计数据库(FAOSTAT)是一个类似的包含250个以上国家的食物平衡表数据集。当缺乏成员国的官方数据时,可通过国家食物生产和使用的统计信息来估计这些数据。
WHO基于部分FAO食物平衡表建立了GEMS/Food全球性膳食数据库,有近250种原料和半成品的日消费量数据。使用消费聚类膳食分析方法,20种主要食品的食物消费模式相似的国家被归为一类,再根据地理分布进行细分,基于1997~2001年所有可获得的FAO食物平衡表数据,产生了13个消费聚类膳食。2006年,对消费聚类膳食进行了更新,在第一版本的基础上纳入了对国家的评论;虽然新版聚类膳食仍是基于1997~2001年数据,但在可能的情况下填补了一些已经明确的数据空白。
●膳食暴露水平的建模
有了食品中有害物的浓度和食品消费量两部分主要的数据,即可对膳食暴露水平进行估计,这可应用不同的模型来实现。膳食暴露评估即通过整合食品中有害物的浓度和目标人群的食品消费量实现对人群摄入某种有害物(化学物或微生物以及代谢产物如毒素)的定量估计。
根据食品消费量和有害物数据信息,可构建两大类膳食暴露评估模型,即点估计模型和概率估计模型。其中点估计模型需要的信息较少,概率估计模型利用的信息较多。具体方法的选择依赖于评估目的、目标有害物特征、人群特点、评估精度要求等。特别地,在点估计和概率估计之间还有一种可称为单一分布(或简单分布)的模型类型,一般可看作概率估计模型的特殊形式。点估计模型与单一分布估计模型都是以食品有害物水平和食品消费量的事前估计相结合,即每种食品只有一种一个消费量水平和一个有害物浓度水平。概率估计模型是对待评价有害物在食品中存在概率、残留水平(浓度)及相关食品的消费量进行统计模拟的一种方法。
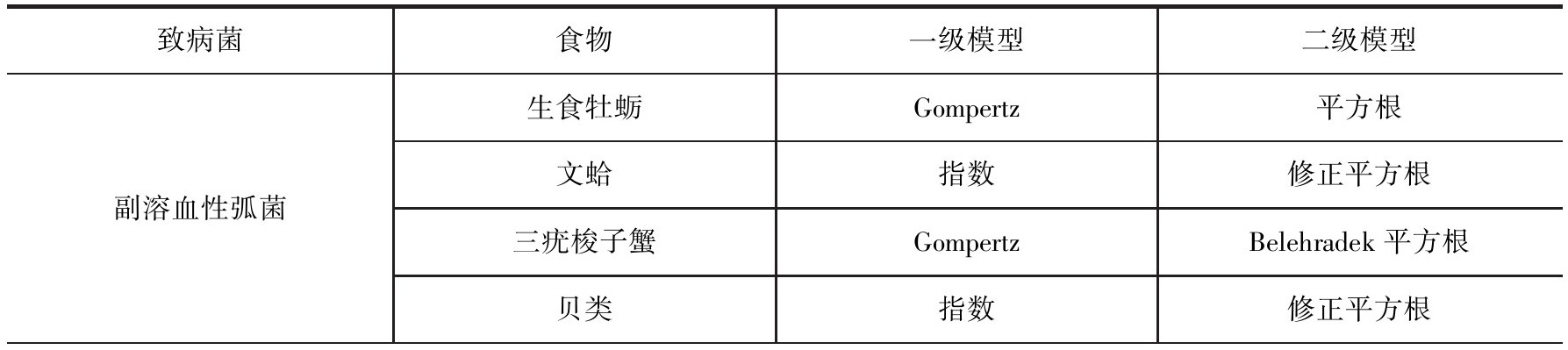
另外,在针对微生物暴露评估建模中,因微生物不同于化学物,微生物具有一定的活性,在食品链上只要条件合适就会生长,当出现逆境条件下还会失活,因此预测微生物学模型是针对微生物暴露评估体系中的特殊建模类型。膳食暴露评估中的点估计模型或称确定性评估模型就是一个单个的数值,这个数值可以描述消费者暴露水平的一些数据。例如,平均的膳食暴露评估是目标食品的平均消费水平与这些食品中目标物质的平均残留水平的乘积,在有合适的数据情况下,还可以计算高暴露人群的点估计水平(例如处于90百分位数的消费者)。但点估计法仅采用某一固定值进行评估,无法量化个体水平消费量和食品中污染物水平的变异,且无法对参数估计的不确定性进行说明,因此可归入筛选法。而概率评估是将个体作为研究对象,通过对可获得的全部数据进行模拟抽样,得到人群的暴露量分布,得到的信息量远远大于确定性估计,且结果更符合实际。微生物预测模型被用于描述在食物链不同环节如加工、销售、运输、消费等过程中环境因素对微生物数量变化的影响。表8-7列出了我国近些年来开展微生物暴露评估研究中应用的常见预测微生物模型。
表8-7 国内微生物暴露评估研究中应用的预测微生物模型
续表
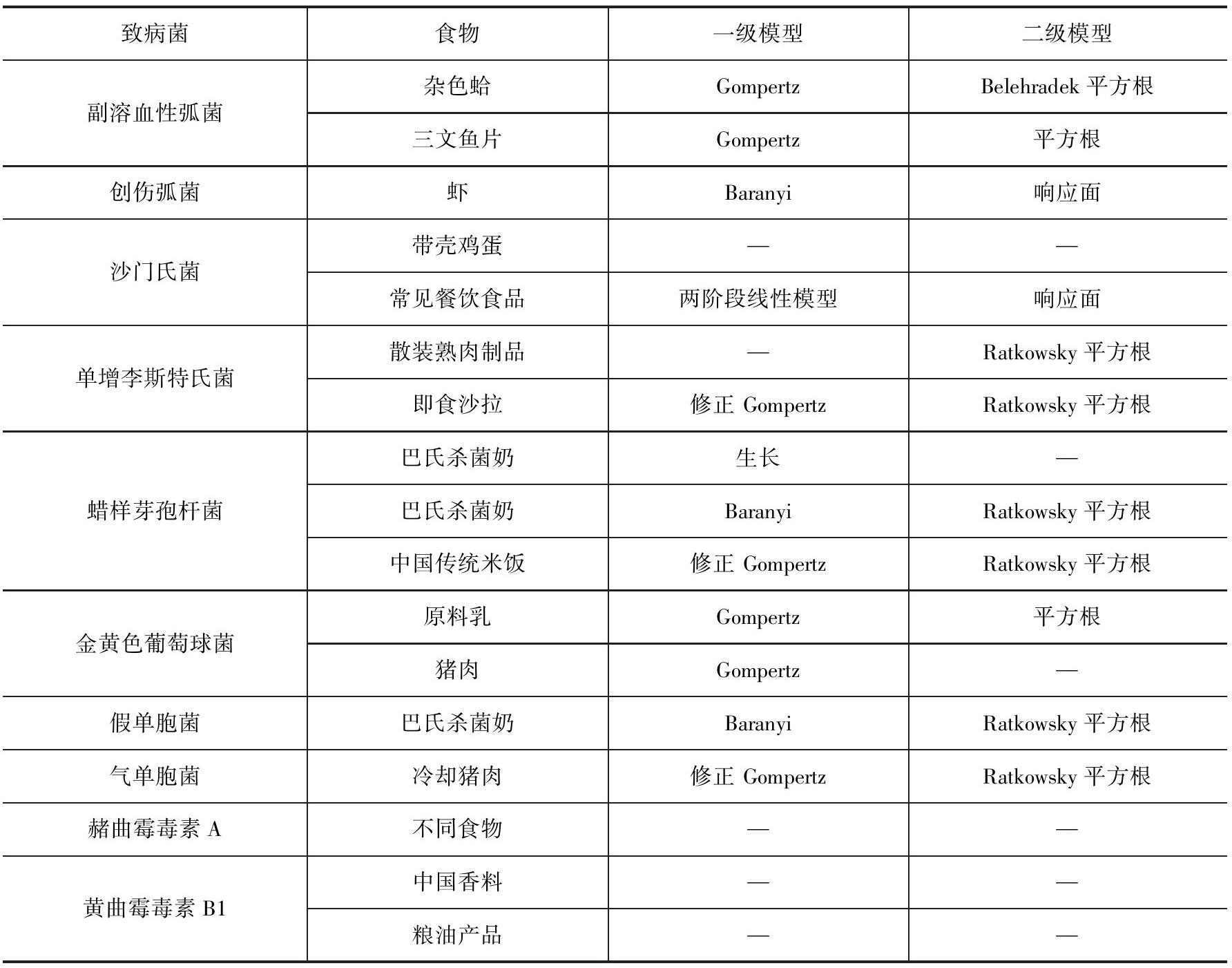
食品预测微生物学(predictive food microbiology)是一门在微生物学、数学、统计学和应用计算机科学基础上建立起来的学科,它是研究和设计一系列能描述和预测食品微生物在特定条件下生长和衰亡的模型。最初由Roberts和Jarvis于1983年提出。食品预测微生物学的主要目的是运用数学模型对食品微生物的变化进行定量分析,定量描述在特定环境条件下食源性微生物的生长、残存、死亡动态。当描述能力达到预测能力时,预测微生物学揭示特定微生物(某类食品中特定的腐败菌、病原菌)的生长、残存、死亡动态是由其所经历的环境因子决定的。环境因子包括内在的pH值、水分活度等和外在的温度、气体浓度以及时间等。许多因子会影响微生物的生长,然而只有几个因子起决定作用。无论在肉汤培养基或其他食品中,每个单一因子对微生物的影响可以看作是独立的。依据数学模型建立的基础分为以概率为基础的模型和以动力学为基础的模型。目前认可度较高的是Buchanan基于变量的类型把模型分为三个级别。一级数学模型是描述在特定的培养条件下,一种微生物对时间的生长或存活曲线;二级模型描述的是培养和环境变量对微生物生长或存活特性的影响;三级模型是描述合并或联合在一起的初级和二级模型。
8.2.2.4 风险特征描述
风险特征描述是基于危害识别、危害特征描述和暴露评估的结果,对特定人群发生已知的或潜在的健康损害效应的可能性、严重程度和不确定性进行定性和(或)定量估计。作为风险评估过程的最后一个步骤,风险特征描述是对前三个步骤信息的整合和综合分析,评估潜在风险,为风险管理的决策制定提供适宜的建议。风险特征描述过程将评估不同暴露情形下,危害物质致人体健康损害的潜在风险。在进行风险特征描述中向风险管理者所提供的信息或者建议可能是定性的,也可能是定量的。
定性描述通常将风险表示为高、中、低等不同程度;(半)定量描述以数值形式表示风险和不确定性的大小。化学物的风险特征描述通常是将膳食暴露水平与健康指导值(如ADI、TDI、ARfD等)相比较,并对结果进行解释。微生物的风险特征描述通常是根据膳食暴露水平估计风险发生的人群概率,并根据剂量反应关系估计危害对健康的影响程度。如果所评价的危害物质有阈值,则对人群风险可以以暴露量与ADI值(或其他测量值)比较作为风险描述。如所评价的物质的暴露量比ADI值小,则对人体健康产生不良作用的可能性为零;采用安全限值(margin of safety),当安全限值<1时,该危害物对食品安全影响的风险是可以接受的;当安全限值>1时,该危害物对食品安全影响的风险超过了可以接受的限度,应当采取适当的风险管理措施。如果所评价的危害物质没有阈值,对人群的风险是暴露量和危害程度的综合结果,即食品安全风险=暴露量×危害程度。
定性描述的内容包括:
①待评估物质不需要引起毒理学关注的说明或证据;
②评估物质在按规定使用前提下相对安全的说明或证据;
③避免、尽可能减少或降低暴露水平的建议。
定量描述信息通常包括:
①一般人群和重点关注人群膳食中待评估物质的暴露水平与健康指导值的比较;
②不同膳食暴露水平下的风险估计,包括极端膳食暴露水平下的风险估计;
③暴露限值(MOE)。
风险特征描述时,应注意包括所有的关键假设,并描述人体健康损害风险的特性、相关性和程度以及对消费者和风险管理部门的建议。风险特征描述过程应包括对在风险评估过程中由于科学证据的不足可能带来的任何不确定性进行明确的描述和解释。另外,若存在易感人群(包括高暴露风险人群、处于特殊生理状态或遗传易感因素),还应包括相关信息。
●风险特征描述的主要内容
风险特征描述主要包括评估暴露健康风险和阐述不确定性两个部分内容。
(1)评估暴露健康风险 即评估在不同的暴露情形、不同人群(包括一般人群及婴幼儿、孕妇等易感人群),食品中危害物质致人体健康损害的潜在风险,包括风险的特性、严重程度、风险与人群亚组的相关性等,并对风险管理者和消费者提出相应的建议。相应的方法包括基于健康指导值的风险特征描述、遗传毒性致癌物的风险特征描述和化学物联合暴露的风险特征描述。
(2)阐述不确定性 科学证据不足或数据资料、评估方法的局限性使风险评估的过程伴随着各种不确定性,在进行风险特征描述时,应对所有可能来源的不确定性进行明确描述和必要的解释。
●风险特征描述的主要方法
1.基于健康指导值的风险特征描述
对于有阈值效应的化学物质,FAO/WHO食品添加剂联合专家委员会(JECFA)、FAO/WH。农药残留联席会议(JMPR)、欧洲食品安全局(EFSA)等国际组织或机构通常是以危害特征描述步骤推导获得的健康指导值为参照,进行风险特征描述,也就是通过将某种化学物的膳食暴露估计值与相应的健康指导值进行比较,来判定暴露健康风险。
(1)如果待评估的化学物在目标人群中的膳食暴露量低于健康指导值,则一般可认为其膳食暴露不会产生可预见的健康风险,不需要提供进一步的风险特征描述的信息。以反式脂肪酸为例,根据国家食品安全风险评估中心(CFSA)的风险评估结果,我国居民的膳食反式脂肪酸平均供能比为0.16%,大城市为0.34%,均远低于WHO所设定的健康指导值(1%),因此可认为目前我国居民反式脂肪酸摄入风险总体较低。
(2)当待评估化学物的膳食暴露水平超过健康指导值时,若需要做进一步的具体描述,向风险管理者提供针对性的建议,则需要详细分析以下因素:
①待评估化学物的毒理学资料,如观察到有害作用的最低剂量水平(LOAEL)、健康损害效应的性质和程度、是否具有急性毒性或生殖发育毒性、剂量—反应关系曲线的形状;
②膳食暴露的详细信息,如应用概率模型获得目标人群的膳食暴露分布情况、暴露频率、暴露持续时间等;
③所采用的健康指导值的适用性,例如是否同样对婴幼儿、孕妇等特殊人群具有保护性。
以鱼类中的甲基汞为例,其健康指导值,即暂定的每周可耐受摄入量(PTWI)的推导是建立在最敏感物种(人类)的最敏感毒理学终点(神经发育毒性)的基础上,而生命其他阶段对甲基汞毒性的敏感性可能较低。因此当膳食甲基汞暴露量超过PTWI值时,JECFA认为风险特征应针对不同人群进行具体分析:对于除了孕妇之外的成年人,膳食暴露量只要不超过PTWI值的2倍,即可认为无可预见的神经毒性风险;而对于婴儿和儿童,JECFA认为其敏感性可能介于胎儿和成人之间,但因缺乏详细的毒理学资料,暂时无法进一步给出一个明确的不会产生健康风险的暴露值。另外,JECFA还指出,考虑到鱼类的营养价值,建议风险管理者分别对不同的人群亚组进行风险和收益的权衡分析,以提出具体的鱼类消费建议。
2.遗传毒性致癌物的风险特征描述
对于既有遗传毒性又具有致癌性的化学物质,一方面,传统的观点通常认为它们没有阈剂量,任何暴露水平都可能存在不同程度的健康风险;另一方面,通过试验获得的未观察到致癌效应的剂量水平可能仅代表生物学上的检出限,而不一定是实际的阈值水平。因此,对于遗传毒性致癌物,JECFA、JMPR、EFSA等国际机构不对其设定健康指导值。JECFA建议对食品中该类物质的风险特征描述采用如下方法和原则:
(1)ALARA(as low as reasonably achievable)原则 即在合理可行的条件下,将膳食暴露水平降至尽可能低的水平。其现实指导意义不大,无法向风险管理者和消费者提供有针对性的建议措施。
(2)低剂量外推法 对于某些致癌物,可假设在低剂量反应范围内,致癌剂量和人群癌症发生率之间呈线性剂量—反应关系,获得致癌力的剂量—反应关系模型,用于估计因膳食暴露所增加的肿瘤发生风险。例如,食品中黄曲霉毒素的风险评估中,JECFA根据所推导的黄曲霉毒素B1致癌强度的剂量—反应关系函数,对不同暴露水平致肝癌的额外发病风险进行了预测。该方法较为保守,通常会过高估计实际的风险。
(3)暴露限值(margin of exposure, MOE)法 MOE是动物试验或人群研究所获得的剂量—反应曲线上分离点或参考点[即临界效应剂量,如NOAEL或基准剂量低限值(BMDL)]与估计的人群实际暴露量的比值。风险可接受水平取决于MOE值的大小,MOE值越小,则化学物膳食暴露的健康损害风险越大。该法实用性和可操作性强,MOE法结果直观地反映了实际暴露水平与造成健康损害剂量的距离,易于判断和理解,可用于确定优先关注和优先管理的化学物。若采用一致的方法,可通过比较不同物质的MOE值以帮助风险管理者按优先顺序对各类化学物质采取相应的风险管理措施。然而,目前尚没有一个国际通用标准用来判定MOE值达到何种水平方表明危害物质的膳食暴露不对人体产生显著健康风险,这与不同机构评估过程中计算MOE值时所选用的数据类型、数据质量及化学物的毒理学资料等因素有关。除了遗传毒性致癌物,MOE法还可应用于对某些因数据不足暂未制定健康指导值的化学物的风险特征描述,如采用MOE法对丙烯酰胺、氨基甲酸乙酯、多环芳烃类等物质进行了风险特征描述,EFSA采用MOE法对铅进行了风险特征描述。
3.化学物联合暴露的风险特征描述
对食品中化学物风险评估的传统方法,以及风险管理者制定的管理措施都是基于单个物质暴露的假设而进行的。但实际情况可能是食品中存在多种危害化学物质,人们每天可通过多种途径暴露于多种化学物质下,而这种联合暴露是否会通过毒理学交互作用对人体健康产生危害,如何评估联合暴露下的人群健康损害风险,已逐渐成为风险特征描述的研究热点以及风险管理者所关注的问题。化学物的联合作用包括4种形式:剂量相加作用、反应相加作用、协同作用和拮抗作用。但根据以往的研究经验,除了剂量相加作用之外,若每种单体化学物的暴露水平均不足以产生毒性效应,那么各种化学物的联合暴露通常不会引起健康风险。因此以下主要对剂量相加作用及其对应的风险特征描述方法进行介绍。
在食品安全风险评估领域中,剂量相加作用和相应的处理方法是研究得较为深入的一种联合作用方式。该情形通常发生于结构相似的一组化学物间,若它们可通过相同或相似的毒作用机制引起同样的健康损害效应,当其同时暴露于人体时,即使每种物质的个体暴露量均很低而无法单独产生效应,但是联合暴露却可能因剂量相加作用而对人体产生健康损害风险。针对具有剂量相加作用的一类化学物,目前常用的风险特征描述的方法包括:
①对毒作用相似的一类食品添加剂、农药残留或兽药残留,建立类别ADI,通过将总暴露水平与类别ADI值比较进行风险特征描述,JMPR采用该方法对作用方式相同的农药残留进行评估;
②毒性当量因子(TEF)法,即在一组具有共同作用机制的化学物中确定1个“指示化学物”,然后将各组分与指示化学物的效能的比值作为校正因子,对暴露量进行标化,计算相当于指示化学物浓度的总暴露,最后基于指示化学物的健康指导值来描述风险。例如,JECFA在对二英类似物进行风险评估的过程中,采用了TEF法,以2,3,7,8-四氯代二苯并二英(TCDD)为指示物进行风险特征描述。
4.微生物危害的特征描述
比较而言,食品微生物危害的作用和效果都更加直接和明显,而这些微生物危害的界定和控制均有较大的不确定性。目前全球食品安全最显著的危害是致病性细菌。就微生物因素而言,由于目前尚未有一套较为统一的科学的风险评估方法,有关微生物危害的风险评估是一门新兴的发展中的科学。CAC认为危害分析和关键控制点(HACCP)体系是迄今为止控制食源性危害最经济有效的手段。
微生物危害主要通过两种机制导致人体得病:产生毒素造成症状从短期稍微不适至严重长期的中毒或者危及生命;宿主摄入感染活的病原体而产生病理学反应。对于第一种情况,可以进行定量风险评估,确定阈值。对于后一种情况,目前唯一可行的方法是对机体摄入某一食品产生损害的严重性和可能性进行定性的评估。
此外,还需提及预测食品微生物学。预测食品微生物学,就是通过对食品中各种微生物的基本特征,如营养需求、酸碱度、温度条件、需氧/厌氧程度以及对各种阻碍因子敏感程度的研究,应用数学和统计学的方法,将这些特性输入计算机,并编制各种细菌在不同条件下生长繁殖情况的程序。它可使我们在产品的初级阶段就可以了解该食品中存在的微生物问题,从而预先采取相应的措施控制微生物以达到食品质量和卫生方面的要求。掌握了预测食品微生物学,对针对食品中微生物危害因素进行风险评估有较大的价值。定量微生物风险评估应是预测食品微生物学的一个具体的应用。
综上所述,作为食品安全风险评估的最后一个部分,风险特征描述的主要任务是整合前三个步骤的信息,综合评估食品中危害化学物和微生物危害对目标人群健康损害的风险及相关影响因素,旨在为风险管理者、消费者及其他利益相关方提供基于科学的、尽可能全面的信息。因此,在风险特征描述过程中,不仅要根据危害特征描述和暴露评估的结果对各相关人群的健康风险进行定性和(或)定量的估计;还必须对风险评估各步骤中所采用的关键假设以及不确定性的来源、对评估结果的影响等进行详细描述和解释;在此基础上,若需要进一步完善风险评估,还有必要提出下一步工作的数据需求和未来的研究方向等。
8.2.2.5 小结
本部分介绍了食品安全风险评估过程中危害识别、危害特征描述、暴露评估和风险特征描述的基本术语、含义,食品安全风险评估各步骤的目的、内容、原则和方法。通过风险评估,可以有效避免食品安全事件造成的人身及财产损失,也使我国食品安全监管方式发生重大转变,从粗放式管理转变为科学的精细化管理,从被动的事后监管转为主动的事前预防或事中控制监管,能够最大限度保护人民群众的身体健康,最大限度地降低生命财产损失。自从我国食品安全监测、风险评估、风险管理和食品安全事故处置等新的监管体系推行以来,食品安全事故频发的势头已被遏制,食品安全的总体状况逐步改善并呈现稳中向好的态势。但食品安全信息纷繁复杂,在食品安全风险评估过程中,需要根据流行病学、动物试验、体外试验、剂量—反应评估等科学数据和文献信息确定人体暴露于某种食品危害后对健康造成不良影响的可能性与程度,以及可能处于风险之中的人群和范围。由于我国在风险评估领域起步较晚,因此在经费投入、人才储备和设备配置等方面仍然存在严重不足的问题,今后应在这些方面加强建设。
