新药Ⅵ期临床试验设计
新药上市后由申请人自主进行的应用研究阶段,一般是单臂,没有对照组,其目的是考察在医院临床实践中,广泛使用下的药物疗效和不良反应,评价在普通或特殊人群中的获益和风险关系,改进用药剂量等(改进给药剂量不能偏离药品说明书范围,否则需要重新申请注册新药)。Ⅵ期试验应注意考察长期疗效、不良反应、药物禁忌证以及药物使用时的注意事项,以便评估远期疗效,及时发现可能的远期副作用。此外,还应进一步考察对患者生活质量的影响。
设计案例
多中心、单臂、队列研究评价2型糖尿病患者使用DPP-4I的疗效和安全性的Ⅵ期试验。
【目的】针对2型糖尿病患者,评估DPP-4I(5 mg,每日1次,服用24周)的疗效及安全性研究。
【受试者人数】2 165人。
【主要终点指标】评估糖化血红蛋白从基线到用药6周、12周、24周的变化。(注:2型糖尿病患者饮食、运动或加用二甲双胍血糖控制不佳者,评价口服DPP-4I治疗24周后的糖化血红蛋白基线的变化。)(https://www.daowen.com)
【次要终点指标】受试者在6周、12周、24周达到糖化血红蛋白<7.0%占总受试者总数的百分比。空腹血糖从基线到用药6周、12周、18周、24周的变化。从基线到24周,餐后2小时血糖的变化。
【入选标准】18岁以上。男性或女性。研究程序之前,受试者签署知情同意书。糖化血红蛋白>7.5%且≤11.0%。患者应为从未用过药或单独使用二甲双胍,入组前至少持续8周为稳定剂量。未用过药是指没有接受过糖尿病治疗的患者[胰岛素和(或)口服降糖药物]。
【排除条件】怀孕或正在母乳的受试者。在筛查之前1年内使用胰岛素治疗(住院期间注射除外,或患有妊娠糖尿病除外)。以前使用过DPP-4I抑制剂或GLP-1类似药物。在第1次访视前8周内有用降糖治疗(二甲双胍除外),访视前12周不能用噻唑烷二酮类药物(TZD)。除替代疗法以外,使用糖皮质激素全身治疗(吸入性,局部注射和局部使用糖皮质激素可被允许)。
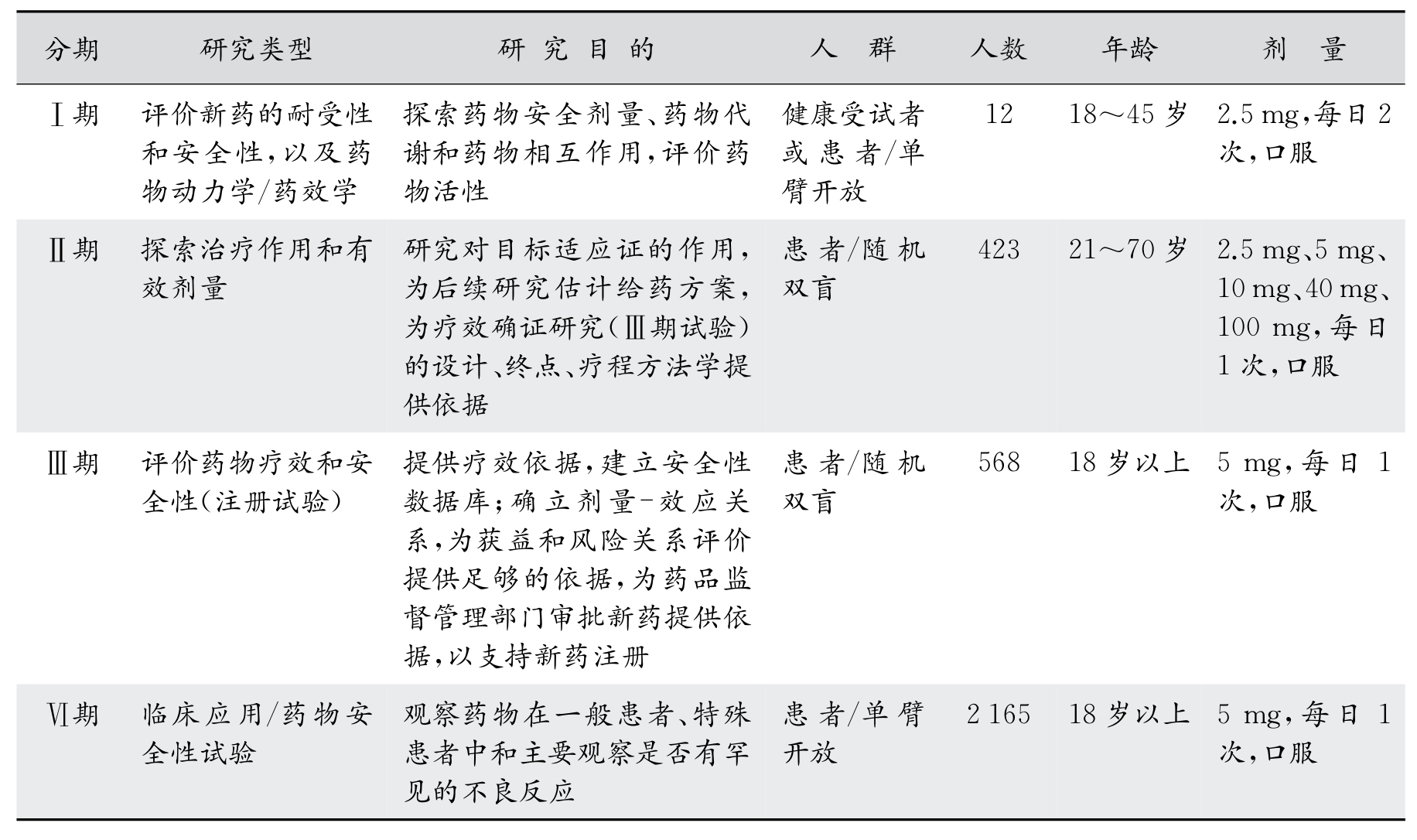
表4-11 Ⅰ期到Ⅵ期临床试验的类型、研究目的、受试人群和剂量变化的特点