二、数据库设计
2026年01月16日
二、数据库设计

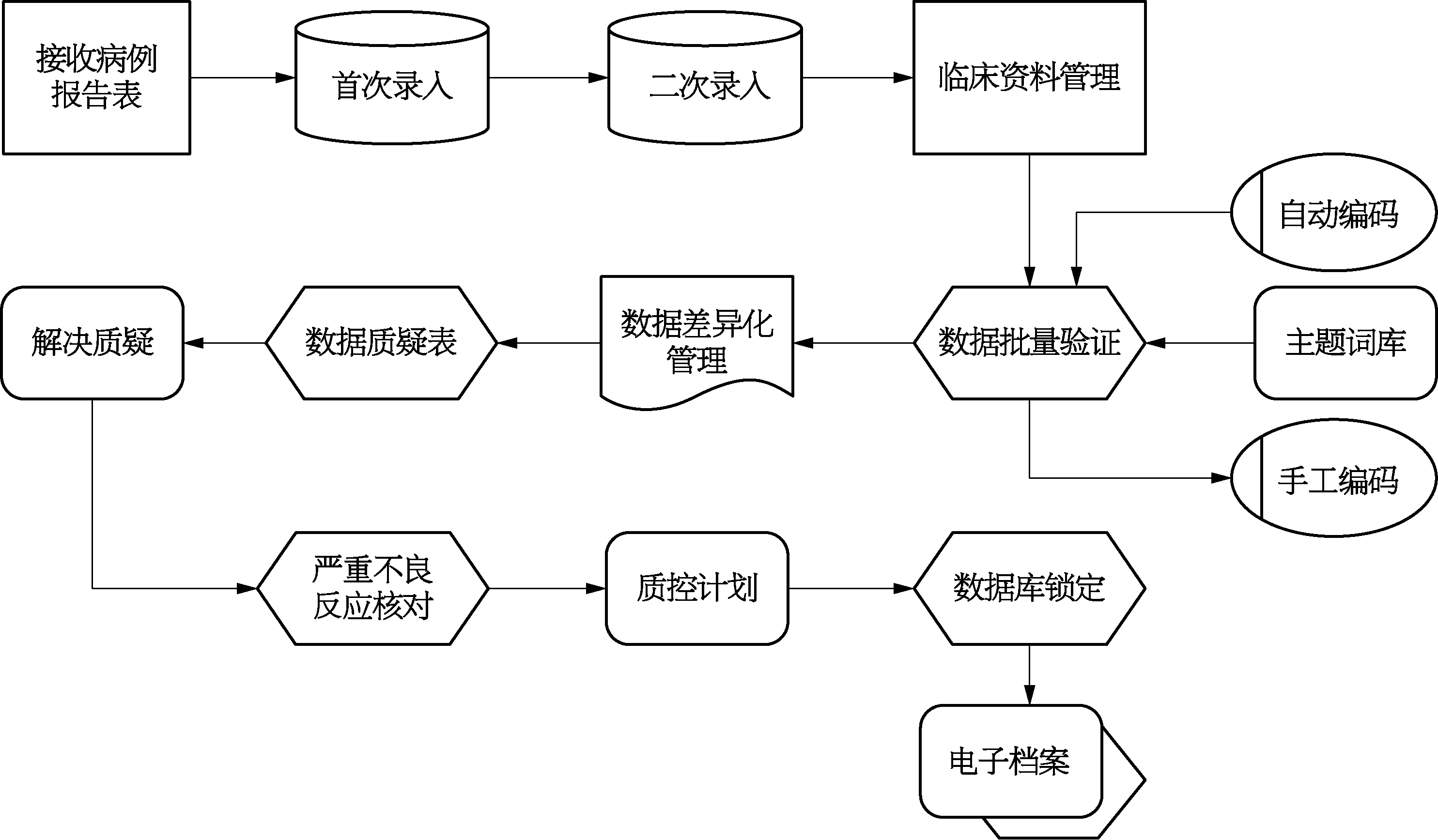
数据库是计算机化系统应用临床试验软件,使CDM能够适用于许多不同的临床试验(Fegan&Lang,2008),为了确保数据安全,要进行“系统验证”。按照GCP2020版第二章第十一条(三十九)“计算机化系统验证,指为建立和记录计算机化系统从设计到停止使用,或者转换至其他系统的全生命周期均能够符合特定要求的过程。验证方案应当基于考虑系统的预计用途、系统对受试者保护和临床试验结果可靠性的潜在影响等因素的风险评估而制定”。在使用数据库前对系统规范、用户要求以及法规遵从等几个方面进行评估(Kuchinke,et al.,2010)。在数据库中定义诸如目标、间隔、访问、调查人员、研究中心和患者等研究细节,以及合理地设计CRF以便数据输入。在获取实际数据之前,使用虚拟数据在输入界面进行测试。数据库设计和CRF的设计有密切联系。电子病例报告表(electronic case report form,eCRF)的优势是能将数据直接输入到能够相互关联的数据库。使用纸质CRF的话,先输入数据,而后再建立数据库中的数据关联。在这两种情况下,CRF上所获取的所有相互关联的数据都会输入到数据库。
表10-2 数据库部分示例表