药物个例安全性报告
药物安全和药物警戒工作中最基础的信息来源于每一个单独的不良事件报告,海量的报告经过专业人员的评估,形成安全性数据库,才有可能进行安全信号的监测和挖掘,对有意义的信号做更深入的研究,从而发现有价值的安全性问题,进而建立和完善风险管理计划,对可控风险进行合理管理,对风险大于利益的药物停止研发或撤市。因此,每一个药物个例安全性报告(Individual Case Safety Report,ICSR)都是重要的安全信息,需要认真评估。
ICSR的来源众多,有上市前Ⅰ~Ⅲ期的临床研究不良事件报告,上市后的通过医务工作者、患者、消费者等报告的自发性报告,还有文献报告、合作公司之间交流的报告等。根据当地的法律法规,不同来源的ICSR报告在报告的途径、对象、时限上会有不同。
一例ICSR是否是有效报告,一般来说需要满足四个要素:可确定的报告人、可确定患者(或者临床试验受试者)、可疑药物、不良事件。包含上述四项基本要素的报告称为有效报告,通过规定流程的评估,按照当地法律法规和国际共识,进行相应的报告和交流。而没有满足上述四项要素的报告称为无效报告,需要尽可能地与报告者联系以获得缺失的信息,如果获得足够信息可以作为有效报告,则做进一步评估。
另外,一些风险事件,即使没有发生不良事件,也可以构成有效报告,如怀孕或哺乳期用药、药物过量使用、错用、滥用、职业暴露、注射部位注射液溢出和缺乏疗效等。
ICSR评估中最重要的判断包括严重性判断、预期判断和因果关系判断。接下来简单介绍一下如何对严重性、预期性和因果关系做判断。
1.严重性(seriousness)判断 ICH E2D指南对严重不良事件(反应)定义如下:导致死亡;危及生命(指患者在事件发生时有死亡的风险,而不是说如果事件进一步发展将会引起死亡);患者需入院治疗或住院时间延长[仅指由于发生的不良事件(反应)需要住院或住院时间延长,对于原有计划的住院,如住院体检或择期手术不在此列];导致持续或显著伤残或功能不全;先天异常或出生缺陷;重要医学事件。
因此对事件的严重性判断是有一个基本统一的标准的,符合上述六项,可以判断为严重事件。但是在日常工作中,对一些事件的严重性判断依然是有难度的,需要有丰富的临床知识、实践经验和对法律法规的熟悉。比如对重要医学事件的判断的把握,需要仔细分析患者的原有病情、药物使用情况等。
2.预期性(expectedness)判断 根据ICH E2D指南,如果一个不良反应,其本质、严重程度、特异性或导致的临床后果与国家(地区)的产品信息(如产品说明书或产品特点概述)中的表述和描写不一致,即判断为非预期。如果药品上市许可证持有者(marketing authorization holder,MAH)不能明确预期性判断的,应把该不良反应作为非预期的处理。
因此只要不良反应比说明书或相关的产品信息(如临床研究中的研究者手册、公司的核心数据表等)中的不良反应部分的内容更具体、更严重、发生率更高,都应该考虑判断为非预期不良反应。例如说明书中列有肝炎,不良反应报告为爆发性肝炎,因事件更为具体应该考虑为非预期。或者说明书中列有脑血管意外,不良反应报告为脑血管意外死亡,因事件更严重应考虑为非预期。
3.因果关系(causality)判断 因果关系判断是ICSR评估中的至关重要的部分,它决定了不良事件是否和药物使用有关。由于个例报告的信息十分有限,对个例报告的因果关系判断往往比较困难。但是个例报告又是安全信号检测、风险评估的基础,它提供了实时、早期、来自临床的信号,并且为今后的汇总分析提供确凿证据,所以需要有医学背景,最好是有实际临床经验的专业人员做因果关系判断。
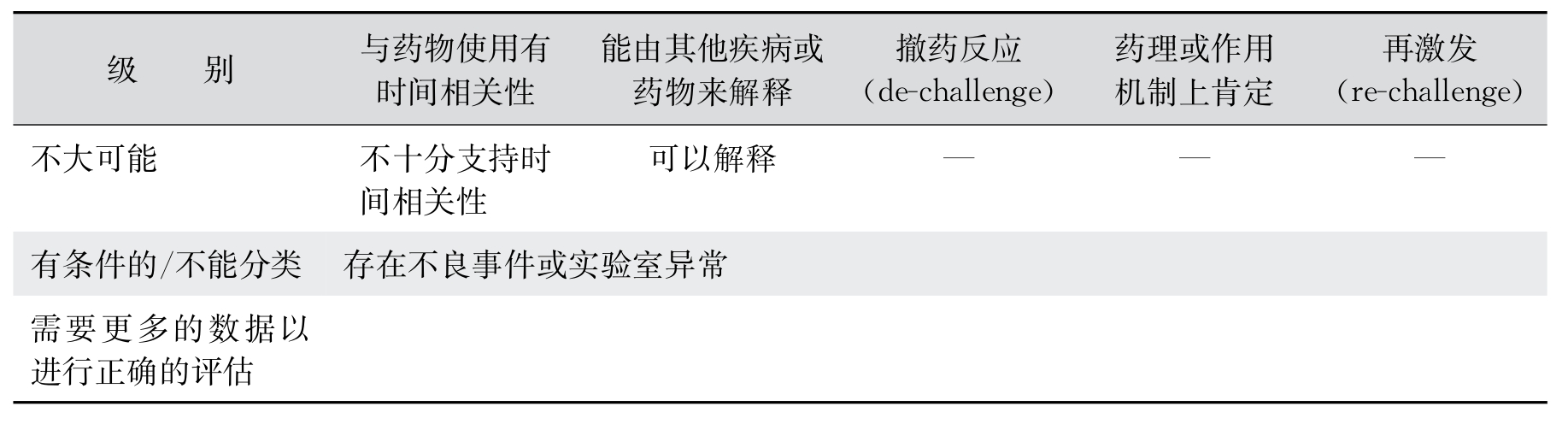
因果关系判断目前依然没有一个通用的标准,还是相对比较主观的一项判断,需要评估者综合多种因素做出最佳的可能性判断。这里简单介绍一下WHO UMC推出的一项标准化的评估方法。这项评估方法是把ICSR的因果关系分为六个级别,分别是:肯定(certain)、很可能(probable)、可能(possible)、不大可能(unlikely)、有条件的/不能分类(conditional/unclassified)、不能评估/不能分类(unassessable/unclassified)。对不良事件或实验室异常的具体评估标准如表11-1。
表11-1 不良事件或实验室异常的具体评估标准
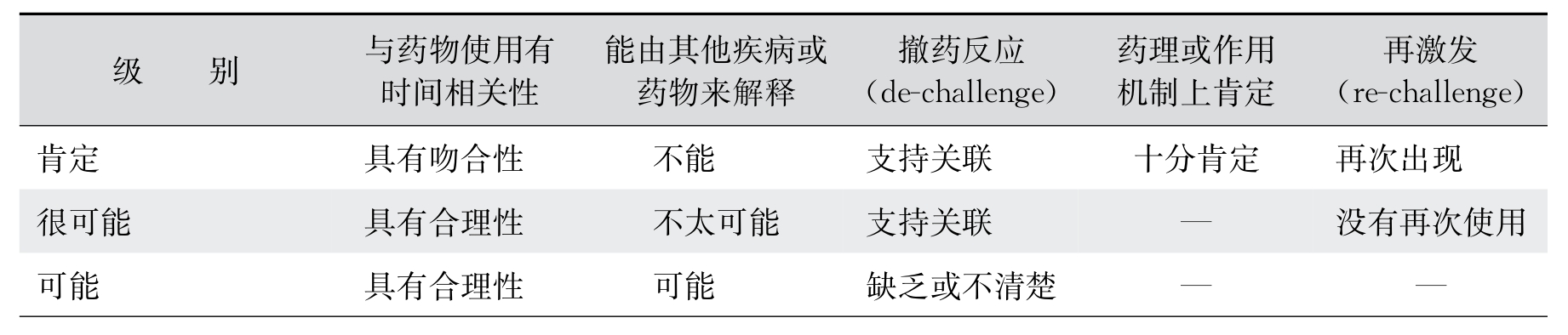
(续表)
除了上述UMC评估标准外,CIOMSⅥ临床试验安全信息管理工作组提出了对上市前临床试验中的ICSR因果关系判断使用简单的二分法作判断,即对报告的不良事件与可疑药物的因果关系判断为“相关(related)”或者“不相关(unrelated)”。此关系评估中的关键点是药物的使用和不良事件的发生存在或不存在合理的因果关系,必须有充分的证据、事实来合理地支持最终判断。
