检查和最后审定临床试验文件
2026年01月16日
一、检查和最后审定临床试验文件

从数据库设计的角度对方案进行审查,以确保数据库与方案的一致性。在这次审查中,CDM会确定要收集的数据和收集访问时间表的频率。然后,由CDM设计病例报告表(CRF),这也是将方案的内容转换生成数据的第一步。数据字段应明确定义并在整个流程中保持一致。输入的数据类型应在CRF中标出。例如,如果体重要求保留两位小数点,则数据输入字段应在小数点后放置两个数据框。同样,在数据字段的旁边也应提到必须进行测量的单位。CRF的设计应该简洁明了、定义明确以及方便用户使用(除非用户是输入CRF数据的人员)。此外,还应提供CRF填写说明(称为CRF的完成指南),以便使研究者获取无差错的数据。CRF注释是根据SDTMIG或内部所遵循的规则来命名变量的。注释是CDM工具中用来表示临床试验中的变量的编码术语。表10-1中提供了一个带注释的CRF的示例。在分类变量问题(如变量是性别,男性或女性)中,所有可能的选项都会被编码。
表10-1 带注释的CRF的示例表
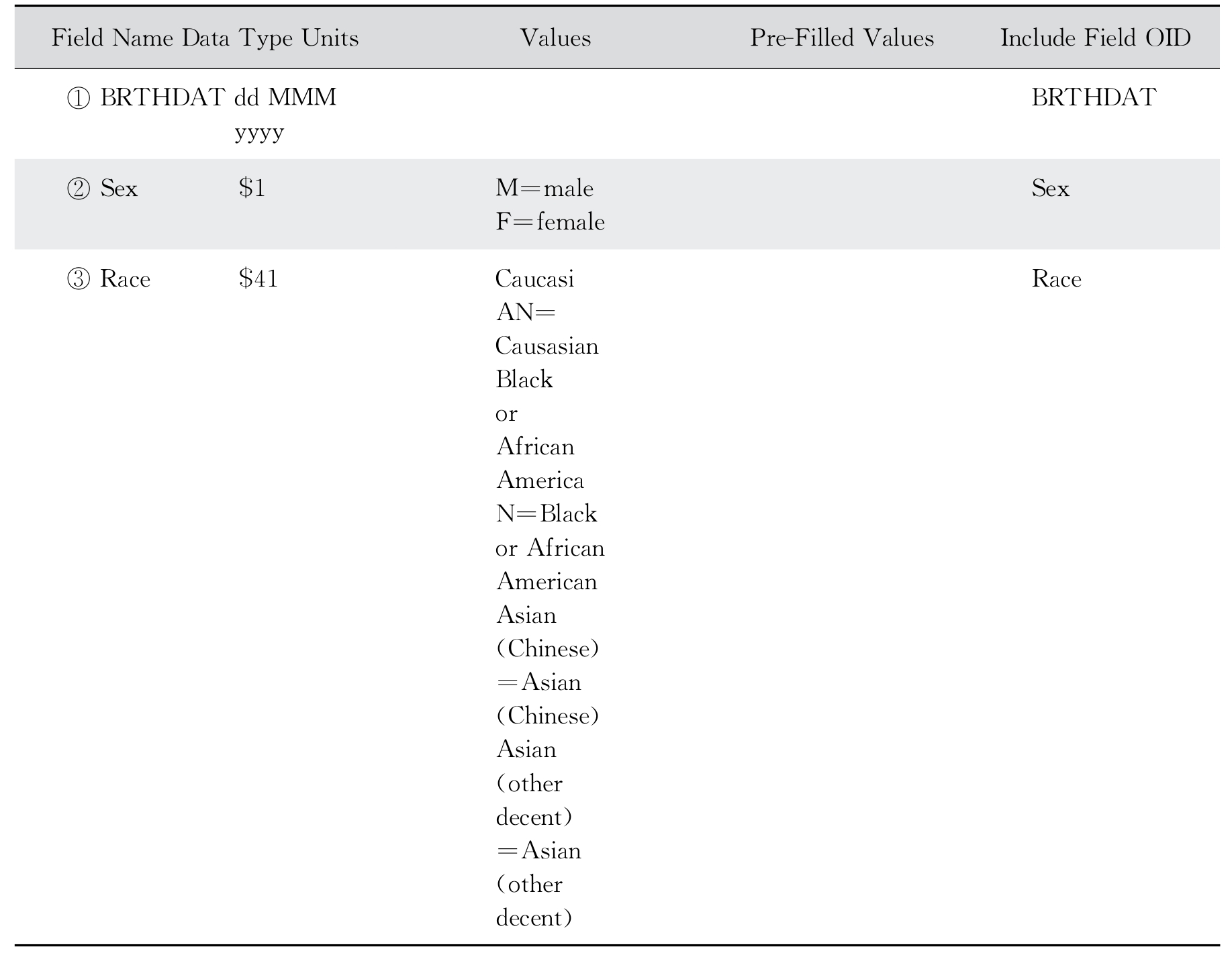
在此基础上,定一个数据管理计划(data management plan,DMP)。在此计划中,提供了处理数据的流程图,并描述了在试验中应遵循的CDM过程。CDM流程清图如图10-3。该系统描述了数据库设计、数据输入和数据跟踪指南、质量控制措施、严重不良事件协调准则、差异管理、数据传输/抽取以及数据库锁定指南。同时,还准备了一个数据验证计划(data validation plan,DVP),其中包括了要执行的所有编辑检查以及派生变量的计算。DVP中的编辑检查程序有助于通过识别差异来清理数据。
