第四节 ICH
20世纪60年代沙利度胺的悲剧促使全球的监管机构意识到,对药品进行独立评估的重要性。从此之后各种关于新药安全性、质量和有效性的法规和指导原则快速出台。与此同时,药品生产企业在全球范围内寻求新的市场,但各国之间的药品监管和技术要求不同,导致药物研发成本逐年上升和新药上市延迟。20世纪80年代,欧盟委员会(EC)开创性地进行监管要求的协调工作。同时,欧洲、日本和美国也就法规协调的可能性进行了讨论。1990年在布鲁塞尔欧洲制药工业协会联合会(EFPIA)的一次会议上,ICH(International Conference on Harmonization)正式诞生。
ICH成立后,逐步在制定安全性、质量和有效性指导原则,多学科专题,包括MedDRA(药事管理的标准医学术语集)和CTD(通用技术文件)上取得了重大进展,并积极在非ICH地区推行其指导原则。2015年10月,ICH进行了一项重大的组织改革,将名称从会议(conference)改为理事会(council),正式名称为International Council for Harmonisation,成为一家依据瑞士法律成立的国际性的非营利性协会,不过仍旧保留了ICH这一缩写,成为一家独立的法人实体,可以提供更稳定的运营,宗旨是通过技术要求的国际协调提高公众健康。这些技术标准有利于及时为患者提供新药品并保证患者可持续获得已获批药品,防止人体临床试验的不必要重复,以高效和具成本效益的方式研发、注册和生产安全、有效和高质量的药品,及在不折损安全性和有效性的前提下尽量少的使用动物实验。ICH的主要任务及目标是在药品注册与注册维护的技术指导原则和要求的解释与应用中为实现更大程度的协调提出建议,就药品技术要求的协调在监管机构和医药行业间构建科学问题对话,出于国际视角,为保护公众健康做出贡献,监测与更新协调的技术要求,使研发数据更大程度的相互接受。因治疗的进步和药品生产新技术的发展,通过对需要议题的协调,避免未来要求的不同,促进采纳新的或改善的技术研究与开发方法,更新或替代目前作法。通过协调的指导原则及其使用方面信息的传播、交流及培训,鼓励通用标准的实施与接轨。制定ICH监管活动医学词典(MedDRA)术语的政策,同时确保MedDRA作为方便人用药品国际监管信息分享的标准化词典的科学与技术维护、开发和传播。时至今日ICH已经被世界大多数国家和先进组织认可,ICH的技术指导原则已经在指导全人类健康事业的发展上发挥了不可或缺的作用。(国家药品监督管理局,2017,2018)(ICH工作办公室专栏,药品审评中心)
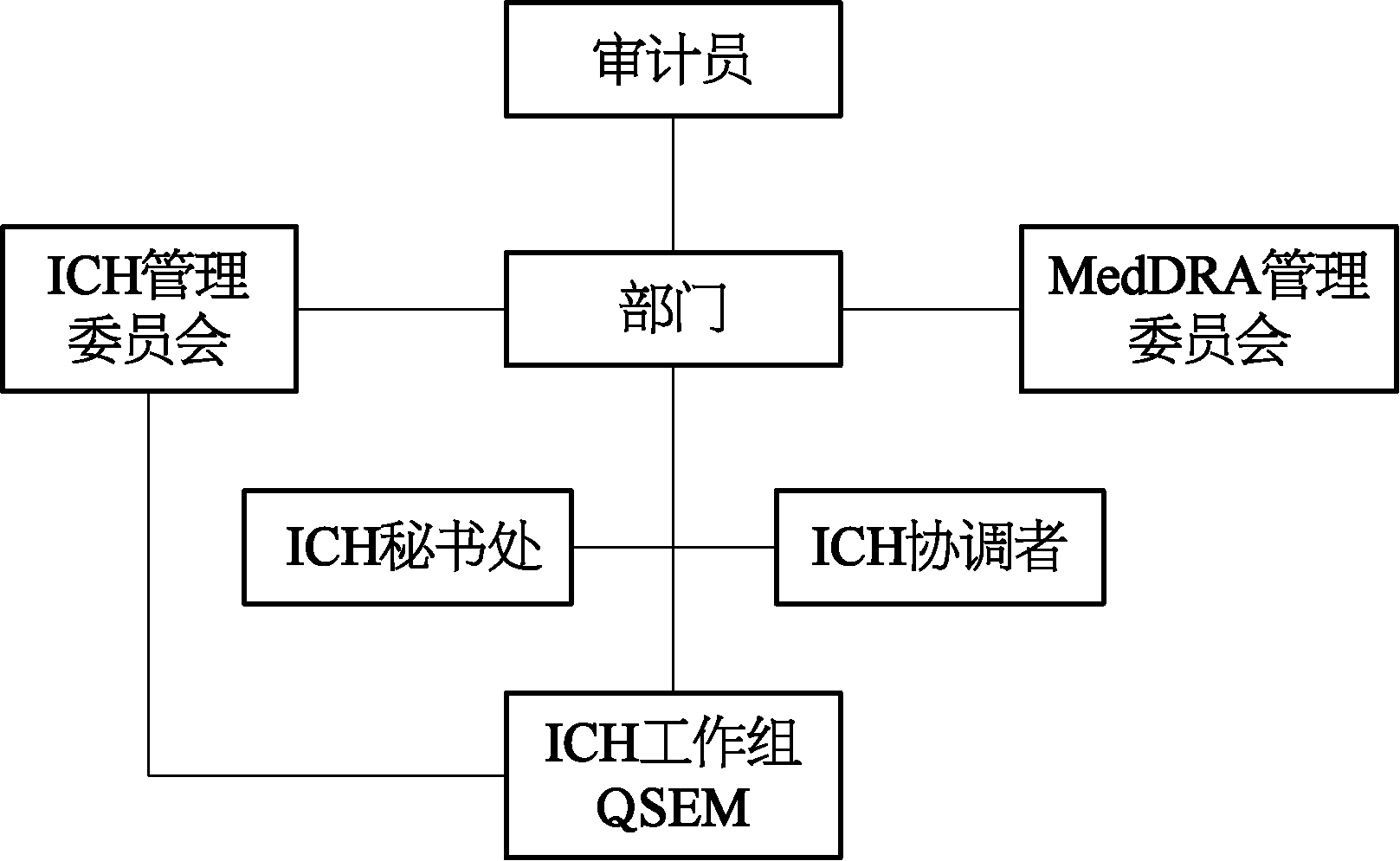
图12-2 ICT架构
ICH 2015年改革后的架构如图12-2。
ICH大会(ICH Assembly)是ICH的总体管理机构,由ICH成员(member)和观察员(observer)组成,ICH大会每年召开2次会议,旨在对一些事项做出决策,包括协会章程、新的成员或观察员的接纳,以及ICH指导原则等,对一些问题还会进行表决。
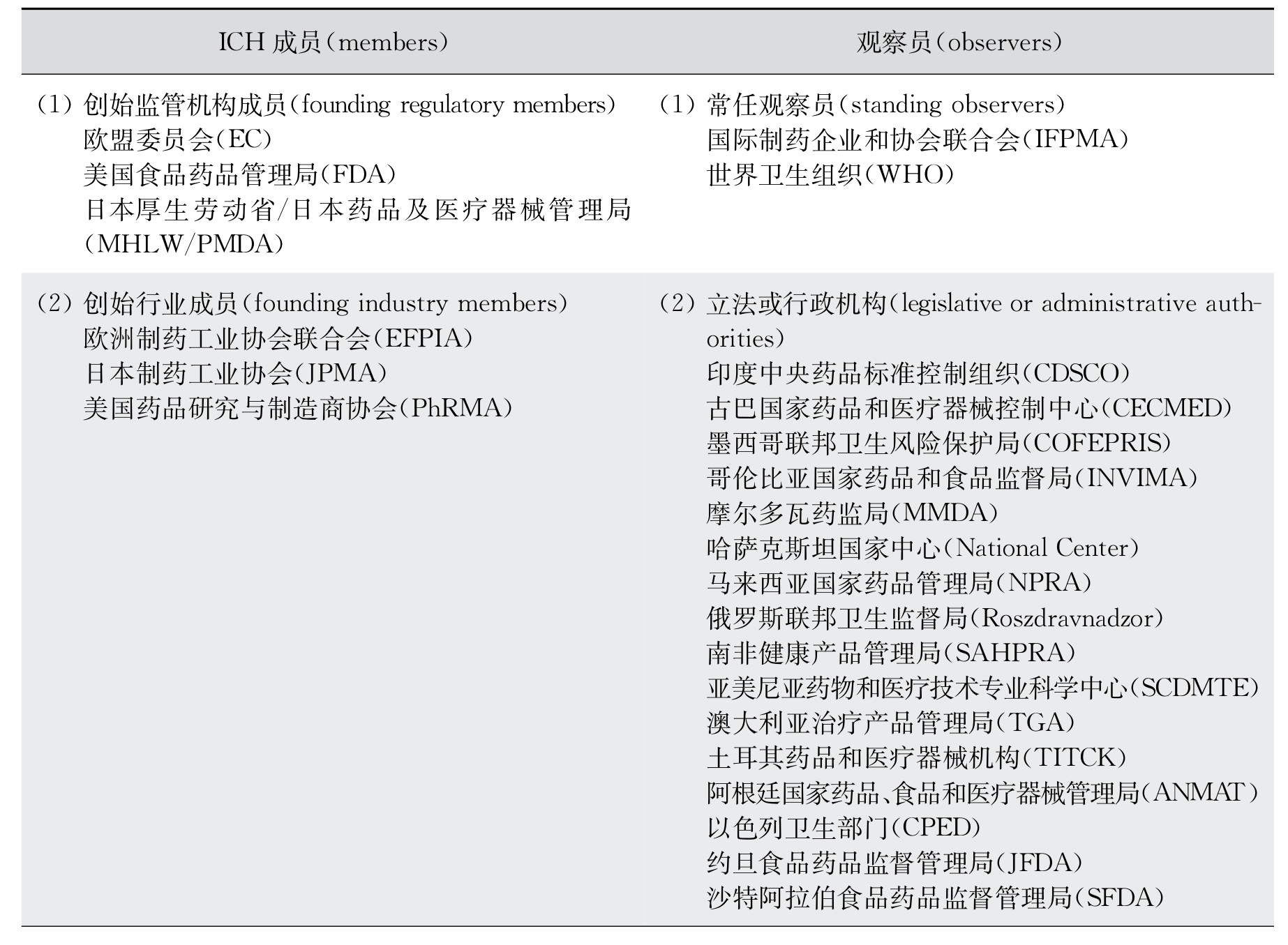
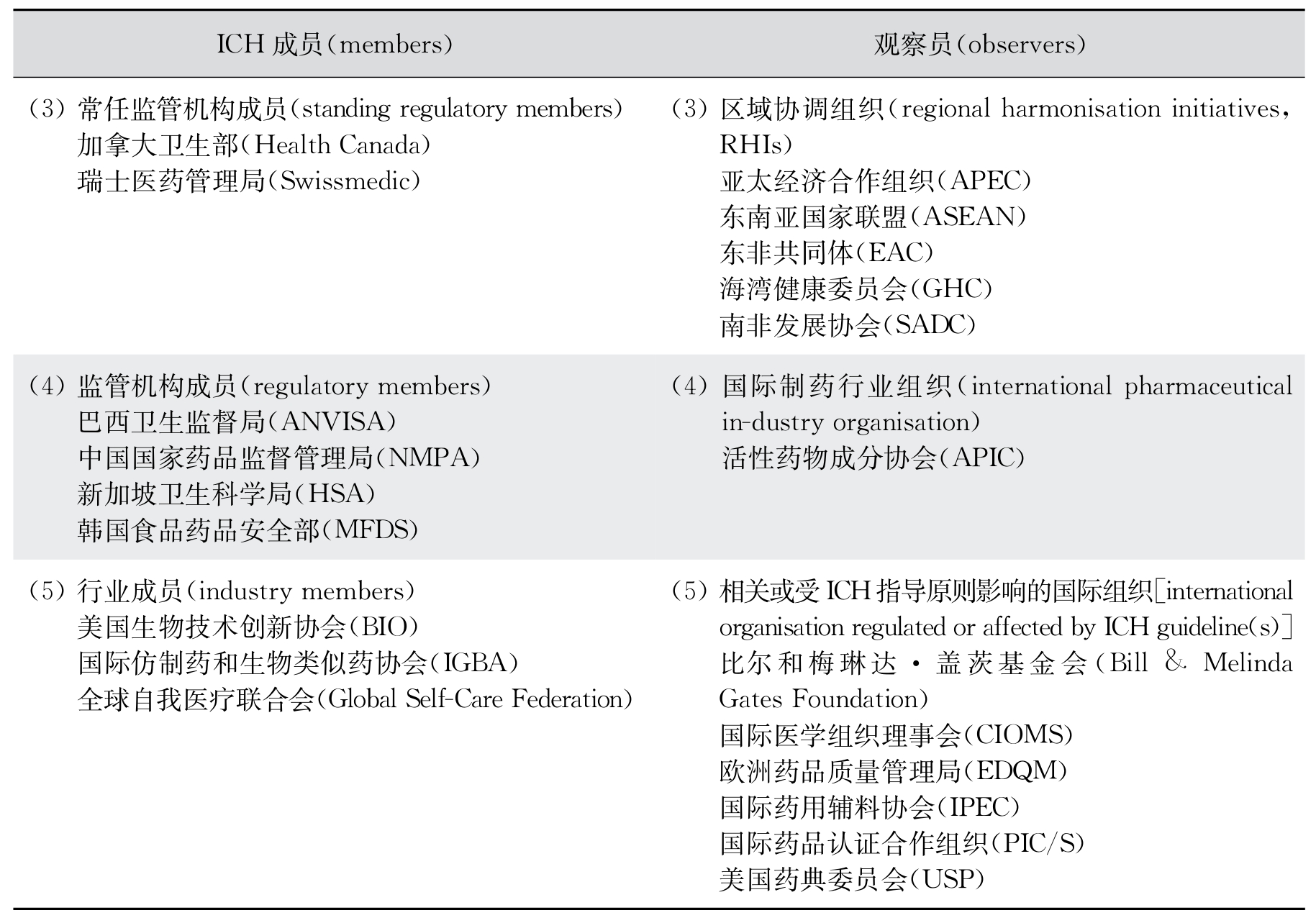
我国药品监督管理部门于2017年5月以成员身份加入了ICH,于2018年6月当选为管理委员会成员。目前ICH的成员和观察员名单如表12-1。
表12-1 ICH成员和观察员
(续表)
ICH管理委员会(ICH Management Committee)代表所有ICH成员监督ICH运营,包括行政、财务和工作组的工作。ICH管理委员会还负责向大会提交建议和提案,供大会讨论。
ICH管理委员会成员原来包括:6个ICH创始成员(EC、EFPIA、美国FDA、JPMA、MHLW、日本PMDA、Ph RMA)、常设监管机构成员(加拿大卫生部、瑞士Swissmedic)、常设观察员(IFPMA、WHO)。
从2018年6月开始直到2021年6月的再次选举,巴西卫生监督局(ANVISA)、美国生物技术创新协会(BIO)、新加坡卫生科学局(HAS)、国际仿制药和生物类似药协会(IGBA)、韩国食品药品安全部(MFDS)和中国国家食品药品监督管理局(NMPA)推举为管理委员会成员。
ICH管理委员会是ICH成员中的一个特别的小组,其职责主要是代表所有成员监督ICH运营的各个方面,包括行政、财务以及监督工作组的工作。ICH大会是ICH最大的也是最主要的机构,由所有成员组成;管委会是对ICH大会进行监督的机构,负责认证、财务、大会的运行,以及对指导原则的制定和修订等提出建议,协调并进行决策。在ICH指导原则的实施上,管理委员会也做了大量的工作。每家监管机构对于ICH指导原则都有自己的解读方式,而且还需要将其纳入本国法律法规体系中,为此ICH管委会专门开展讨论,并对各个国家的实施情况进行监督,同时也提供支持、培训和解释工作,帮助新成员的实施。作为ICH改革的一个举措,管理委员会成员也进行了扩充。比如在2018年6月,我国国家药品监督管理局通过选举,与其他5个机构一并成为ICH管理委员会新成员。加入管委会不仅有利于助推药品审评审批制度改革,也有利于扩大ICH规则国际影响,加快实现药品可及性,推动中外医药产业交流,是一项双赢互利的工作。
MedDRA管理委员会(MedDRA Management Committee)负责指导MedDRA,由EC、EFPIA、美国FDA、JPMA、MHLW、日本PMDA、PhRMA、英国MHRA、加拿大卫生部和WHO(作为观察员)组成。ICH秘书处(ICH Secretariat)设在瑞士日内瓦,负责日常管理,协调ICH活动,为ICH大会和管委会以及工作组提供支持。ICH协调员(ICH Coordinators)是ICH秘书处的主要联络人,协助ICH管委会和(或)大会与ICH工作组之间的沟通。ICH工作组(ICH Working Groups)为各个技术主题设立,包括专家工作组(EWG)、实施工作组(IWG)、非正式工作组和讨论组。ICH成员和观察员根据大会的规则和标准操作程序制定专家参加工作组。管委会会持续监督工作组的工作。ICH大会任命一家审计公司担任审计员(auditors),任期2年,可再次任命。
ICH最主要的工作是发布ICH指导原则,这些指导原则广泛地被ICH的监管机构成员和非ICH成员所采用,成为药物研发和注册国际互认的基础。ICH的指导原则按类别分为质量(Q)、安全性(S)、有效性(E)和多学科(M)指导原则四类。ICH鼓励所有监管机构实施所有的ICH指导原则,不过由于ICH各个指导原则的重要性并不完全相等,且监管机构的实施需要时间,因此该组织将ICH的指导原则分成三级。根据最新的ICH大会议事规则(assembly rules of procedure),三个级别的ICH指导原则:一级指导原则三个,Q1、Q7和E6,一旦成为监管机构成员,就必须实施。二级指导原则E2A、E2B、E2D、M4和M1,需要优先实施的指导原则,在成为ICH成员后5年内实施。三级指导原则为其余的指导原则,应该尽快地实施,并向ICH提交实施的时间表。所有ICH指导原则的制定、撤回和修订都有专门的程序。
我国国家药品监督管理局于2017年7月12日成立ICH工作办公室,设在药品审评中心,成员单位直属单位和行业协会,包括中国食品药品检定研究院、国家药典委员会、国家药品监督管理局药品审评中心、国家药品监督管理局食品药品审核查验中心、国家药品监督管理局药品评价中心、国家药品监督管理局信息中心、中国食品药品国际交流中心、中国药学会。主要负责ICH工作统筹协调,确保各项工作有序开展,ICH相关会议组织管理,ICH技术指南的起草、转化与实施、培训,与ICH联络、协调转化实施。国家药品监督管理局药品审评中心已经就这些原则的翻译和整理做了大量工作,并在其网站上发布。
