参考文献
第9章 神经调控
第1章的学习中,我们了解到,神经元活动时会伴随膜电位的变化,即由静息电位变为动作电位,同时动作电位会受到细胞膜两侧的电压和离子的通透性,特别是钾离子、钠离子通透性的影响。因此,如果我们给予适当的刺激影响这些因素,便可能引起细胞的反应,继而引起脑活动变化。
对神经系统施加外部刺激是一种新兴的治疗和康复手段,称为神经调控。本章对神经调控技术进行介绍,包括其定义与发展过程、常见类型及主要应用。
9.1 神经调控的定义及发展
2016年,世界卫生组织(WHO)将神经精神疾病列为最常见的难治性疾病。全世界约有10亿人正在遭受神经精神疾病的影响。全球范围的统计数据显示,神经精神疾病占总体生命损失年负担的42%。
基于这一现状,神经精神疾病治疗方法的研发显得尤为重要。目前已有多种药物用于治疗神经精神疾病,然而仍然有相当一部分患者病情无法得到缓解,并且很多患者有明显的服药副作用。以全球第二大常见神经系统疾病——帕金森病为例,药物治疗在早期可以取得显著疗效,但随着患病时间延长,疗效逐渐减弱,在“蜜月期”后更是无法起到作用,只能通过其他方式进行替代干预。随着对于大脑研究的深入,研究人员开始基于神经元活动及信号传递原理,通过向大脑外加刺激的方式来提高局部神经元兴奋性,或者通过改变突触可塑性重建神经环路,达到纠正脑功能紊乱,从而治疗疾病的效果。
世界神经调控学会(International Neuromodulation Society,INS)将神经调控定义为基于植入性或非植入性方法,采用电刺激或将药物直接递送到目标脑区的方式,改变或调节中枢神经、外周神经或自主神经系统活动,进而改善患者症状、提高生命质量的技术。
现代神经调控技术的应用始于20世纪60年代,当时麻省理工学院的加拿大科学家Melzack和英国科学家Wall提出疼痛闸门控制理论,由于弱电神经刺激技术的研究早在20世纪初便开始,因此便尝试将电极植入背部,通过脊髓刺激来缓解疼痛。随着脊髓刺激的应用,神经调控的概念逐渐成熟起来,相继出现了脑深部电刺激、周围神经刺激以及脑皮层刺激等治疗技术。
神经调控技术发展到今天,已经融合了科技、医疗和生物工程等技术,成为一个新兴的领域。相关技术发展迅速,刺激形式已经不限于电刺激,应用任何可使神经细胞产生反应的物理能量如声、光、磁等,均可称为神经调控技术。多种物理形式的调控技术为病人提供了新的、更多的治疗选择,有助于根据不同疾病的特点制定最优的治疗方案。
9.2 电刺激神经调控
根据动作电位的形成机理可知,当膜电位去极化到一定程度后,会激活膜上的电压门控通道蛋白,使大量钠离子流入细胞内,形成动作电位。若我们外加刺激改变膜电位,使膜上的电压门控通道蛋白开启,便可人为控制动作电位的产生,进而影响神经元及神经网络的活动。
电刺激神经调控是一项常见的调控技术,主要有两种实现方式:一种是将刺激电极植入目标位置的侵入式深部脑刺激(deep brain stimulation,DBS),另一种是将刺激电极置于头皮上方的非侵入式经颅电刺激。
9.2.1 深部脑刺激
深部脑刺激,俗称“脑起搏器”,是一种通过植入电极将电脉冲发送到大脑中特定区域,调节该区域的功能活动,从而改善临床症状的技术。
如图9.1(a)所示,DBS系统的构成主要有三个部分:刺激电极、刺激器和连接线。其刺激电极一般为四接触刺激电极,通过立体定位方式植入目标区域,电极外观如图9.1(b)所示。通过调整阳极和阴极电极触点的数量和配置,以及刺激电压或电流来调整电刺激场的形状和范围。刺激电极通过皮下植入的线连接到称为植入式脉冲发生器(implantable pulse generator,IPG)的刺激器上,该刺激器放置在锁骨下方的胸壁上。通过手持设备与IPG的无线通信实现刺激参数调节,参数主要包括脉冲的持续时间(称为脉冲宽度)以及脉冲频率等,具体使用的参数主要根据经验以及患者的反应,以最大限度地缓解症状并副作用最小化为原则。
大多数DBS靶点是深部脑结构(包括白质束)而不是皮层区域,对于不同疾病,电极植入位置也不相同。DBS最常见的植入位置是与帕金森病相关的丘脑底核(subthalamic nucleus,STN)附近。1994年,底丘脑核的深部脑刺激首次用于PD的治疗实验,证明DBS在消除PD患者过度和不足的运动症状方面非常有效。
随着硬件技术的提高,结合影像学技术,DBS的定位准确性和治疗效果也逐渐得到提高。目前DBS常用于治疗特发性震颤和肌张力障碍等运动症状,也可用于治疗强迫症和抑郁症等精神疾病。虽然侵入式DBS可以对目标位置进行精准刺激且疗效比较显著,缺点也显而易见:一方面,通过有创手术向患者颅内植入电极,手术难度较高,存在严重并发症和副作用的风险,如出血、感染,以及幻觉和认知功能障碍等,并且给刺激器更换电池还会对患者造成二次伤害;另一方面,手术费用较为昂贵,使得DBS应用群体比较有限。尽管如此,当常规治疗失败时,DBS还是可以作为某些神经系统疾病如PD治疗的最终选择。
9.2.2 经颅电刺激
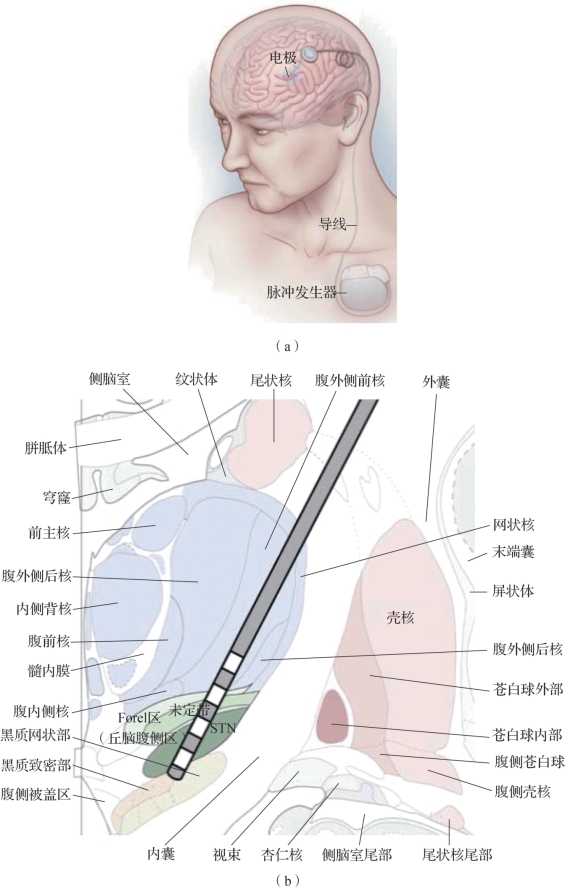
图9.1 DBS系统(书后附彩插)
(a)DBS系统构成(摘自Michael 2012[1]);(b)四接触刺激电极样式(摘自Benabid 2002[2])
经颅电刺激通过附着在头皮表面的电极施加电流刺激,电流在电极间流动的过程中会穿过头皮、颅骨和脑脊液到达大脑皮质,调节皮质组织区域内神经元的膜极性,进而影响神经元兴奋性、改变神经元活动。其系统构成如图9.2所示。为保证安全性和有效性,施加的刺激电流强度一般不超过2 mA。刺激电极常使用盐水浸泡的海绵或凝胶电极,接触面积常保持在20~35 cm2(避免局部电流密度过大使患者产生灼烧感或刺痛感)。
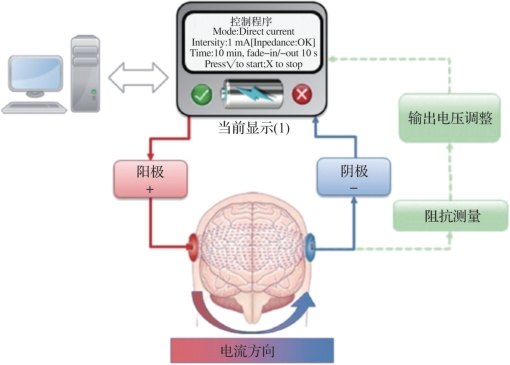
图9.2 tES系统构成(摘自Fertonani,et al.2017[3])(书后附彩插)
经颅电刺激可以追溯到古希腊时期,当时的医师通过电鳗放电来治疗头痛及关节疾病,达到镇定止痛和舒筋活血的目的。虽然电疗法的机理不明,治疗效果却很好。1902年,基于电生理学的研究,基于弱电的神经刺激技术作为一项专业的科学研究和治疗手段再次被提出并受到广泛关注。与DBS相比,经颅电刺激可避免手术对患者的创伤,并且治疗费用较低。随着研究的不断深入,通过改变刺激电流参数及刺激电极排列,经颅电刺激在刺激靶点位置控制、靶点聚焦性控制等方面都有了一定的提升,目前已经在神经系统疾病康复方面得到了较为广泛的应用。
1.经颅电刺激原理
经颅电刺激包含经颅直流电刺激(transcranial direct current stimulation,tDCS)和经颅交流电刺激(transcranial alternating current stimulation,tACS)两类。
经颅直流电刺激的刺激电极连接在刺激器的正负极上,作为电流的输入/接收端(阳/阴极)。对于直流电刺激来说,阳极和阴极下电场方向不一致。局部的阳离子有向阴极下方聚集的趋势,而阴离子则趋向于聚集在阳极下方,这使得阳极刺激下静息膜电位容易去极化,进而增强神经元兴奋性,并允许更多的神经元自发放电。而阴极刺激下静息膜电位会超极化,使得神经元自发放电减少,降低神经元兴奋性。
根据刺激效果,tDCS常被分为阳极和阴极。阳极增加刺激脑区兴奋性,电极置于目标区域正上方头皮处,阴极则降低刺激脑区兴奋性,电极常被置于阳极对侧的眼眶上方或对侧三角肌上。
经颅交流电刺激由于使用的是交流电,电极没有正负极之分,同时电极下方电场的性质会随时间变化,因此作用机理与tDCS不同。tACS通过给特定脑区施加外加刺激会使脑区振荡同步化(entrainment),即特定频率的外部刺激使得脑内相应频率的神经振荡同步化,使神经活动与外界刺激产生相位锁定,达到调节神经活动的效果。计算模型表明,tACS可能通过神经振荡-外界节律同步化的作用改变神经可塑性,提高脑区或脑网络中特定的活动频率,图9.3显示了向100个神经细胞组成的神经网络施加tACS后计算得到的局部场电位。在没有外界干预的情况下,脑电信号虽然也有一定的节律,但其在时域上的节律特征并不十分明显,而通过观察图中的结果可以看到,施加电刺激后脑电活动会在外加电流的诱导下跟随其节律而活动。
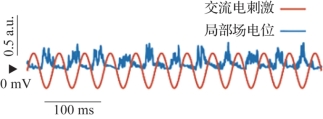
图9.3 基于计算模型的tACS效果(摘自Negahbani,et al.2018[4])(书后附彩插)
而在神经元通信的机制研究中,目前广为接受的是一致性通信(communication-throughcoherence,CTC)假说,指的是两个神经元群体之间的神经元通信在机制上依赖于它们之间的一致性,如果缺乏一致性将会阻止神经元通信。因此,通过外加tACS使局部神经元活动一致可以增强局部通信,进而增强神经元连接,纠正大脑异常的神经活动。
对于交流电刺激,频率是十分重要的参数,研究表明不同频率的刺激对人脑细胞作用产生的效果不同。电刺激使用的频段主要分为三个区间:①频率在1 kHz以下的低频电流。这种电流在人体内可引起离子和带电微粒的迅速移动,可对感觉神经和运动神经产生明显的刺激作用。②频率为1~100 kHz的中频电流。单纯的中频电流无法使细胞产生反应,因此时常被调制为低频电流使用,使其具有低频电流的刺激效果。③频率在100 kHz以上的高频电流。高频电流主要依靠内生热对人体产生作用。
除频率外,交流电刺激还可以应用不同的刺激波形,而且不同波形的刺激效果也不完全相同。最常用的波形为正弦波,后来的研究发现,锯齿(三角)波也有比较好的效果:与正弦波相比,三角波的电流变化率较高,而电流变化率是引起神经活动的因素之一,因此能够引起更强的神经活动。另外通过EEG分析脑活动时,若使用正弦波刺激,刺激波形会叠加在原始脑电中,同时因其频率处于脑电范围内而难以去除,而三角波特征明显,并且在脑电图中容易去除,有利于脑电信号的分析。在其他研究中还有使用脉冲波、指数曲线波和梯形波等,这些特殊波形的作用机制仍需进一步探明。
2.经颅电刺激技术的改良
传统的经颅电刺激虽然在临床应用和研究中已被证明有一定的效果,但考虑到电刺激的安全性,常使用比较大的刺激电极,刺激范围往往较大,而且仅对皮质表面有刺激作用,无法对脑深部或者面积较小的靶点区域进行刺激。因此需要对传统电刺激进行改善,如电极类型、电极排布及刺激范式等。
高精度经颅电刺激(high-definition tES,HD-tES):高精度经颅电刺激使用多个尺寸较小的圆形电极,代替了以往面积较大的圆形或方形电极。典型的电极排布如图9.4所示,图中颜色相同的电极连在电刺激器的一端,不同颜色电极的电流总和保持一致。图9.4(a)所示为最典型的4×1电极,图中一侧的4个蓝色电极电流相等,均为绿色电极的1/4。图9.4(b)所示为环形电极排布。研究表明刺激可以更集中在中心附近,与传统方式相比极大地缩小了作用范围。
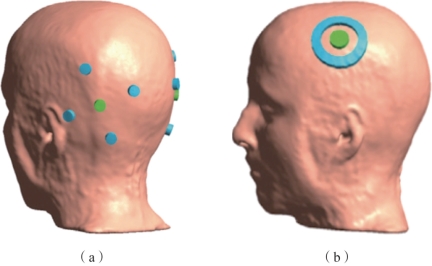
图9.4 HD-tES电极排布(摘自Saturnino,et al.2017[5])(书后附彩插)
调幅经颅交流电刺激(amplitudemodulation-tACS,AM-tACS):调幅经颅交流电刺激的研发最初是受到听觉、视觉和机械感觉系统中神经元的包络解码特性的启发,因为人脑在处理听觉等信号时可以在高频信号中提取其中低频的成分。基于这一特点,研究人员通过将低频信号调制为高频信号对大脑进行刺激,起到调节作用。此外,AM-tACS还有其他显著优点:首先,与应用锯齿波的tACS类似,AM-tACS输入的信号本质是高频信号,因此可以比较容易地分离出刺激信号和脑电信号;其次,由于高频电信号无法直接影响细胞电活动,因此施加刺激时皮肤的感觉较弱。
干扰电刺激:AM-tACS将低频信号调制为高频信号是通过调制器实现的,但实现方式并非唯一,通过两个高频信号相加可以得到相同的形式。基于这一原理,研究人员提出了干扰电刺激疗法。
干扰电刺激早在20世纪五六十年代便已提出,被用于促进血液循环和止痛。它通过输入两路,将两组不同频率的高频电流输入人体,在交叉部位形成低频调制的干扰场,从而能以无创的方式对大脑深部进行刺激,作用效果如图9.5所示。最新的研究结果显示,科学家通过在小鼠头上布置电极来施加干扰电刺激,能够在不引起上皮质产生电活动的情况下刺激到大脑深部结构,并且能够可控地影响小鼠的活动。
与其他方法相比,这是目前能够以无创方式对大脑深部进行刺激的最佳方法,不过也有研究表明,虽然该方法能够对大脑深部进行刺激,但其刺激效果相对微弱,仍需进一步研究和改善。
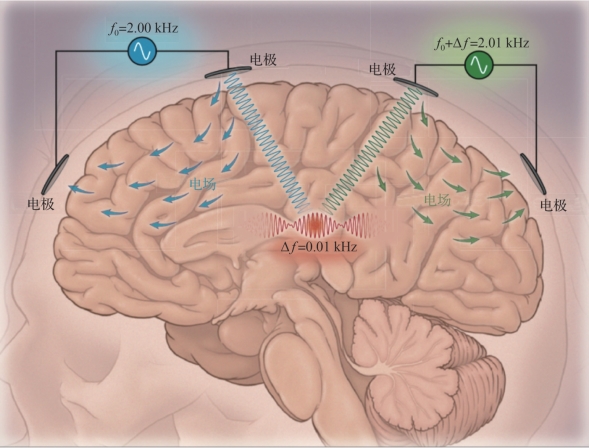
图9.5 干扰电刺激作用效果(摘自Phim ister,et al.2017[6])(书后附彩插)
9.3 磁刺激神经调控
虽然电刺激是影响神经细胞活动最直接的方式,但考虑到侵入式电刺激对人体创伤较大,非侵入式电刺激的能量在传导过程中损失较多,同时电流在组织内传导的路线十分复杂,研究人员便试图利用其他形式的刺激在人体内诱导电流,磁刺激技术应运而生。
经颅磁刺激是基于法拉第电磁感应原理,通过外部变化的磁场在大脑中诱导产生电流[7]。1985年,英国谢菲尔德大学的学者Anthony Barker在《柳叶刀》杂志发文称,将平面线圈置于运动区头皮上,可在被试对侧手上记录到清晰的运动诱发电位(motor evoked potentials,MEP)。TMS也被称为“基于电磁感应对大脑进行的无电极电刺激”。TMS系统的构成如图9.6所示,除导航系统及其他辅助设备外,包括两个主要部分:一个是控制刺激输出的刺激器,另一个是用于产生变化磁场的线圈。施加磁刺激时,刺激器向线圈发送电流脉冲产生垂直于线圈平面的磁场,该电脉冲在短时间(<1 ms)内增长到峰值强度并减小到零,磁场强度同样会在上升到峰值(高达约2.5 T)后迅速下降。由于非铁磁性物质的磁导率μ近似于真空磁导率μ0,因此这个快速波动的磁场可以不受阻碍地穿过受试者头皮和头骨,并在大脑中感应出一个电流,其性质由磁场变化率决定。该电流在与线圈平行的平面内流动,但与原始电流的方向相反。
TMS应用的刺激为脉冲型刺激,可分为单相和双相。通过调节刺激间隔、刺激持续时间等参数,可以组合成各种各样的刺激范式。典型的刺激范式有单脉冲磁刺激、双脉冲磁刺激和重复磁刺激三种。
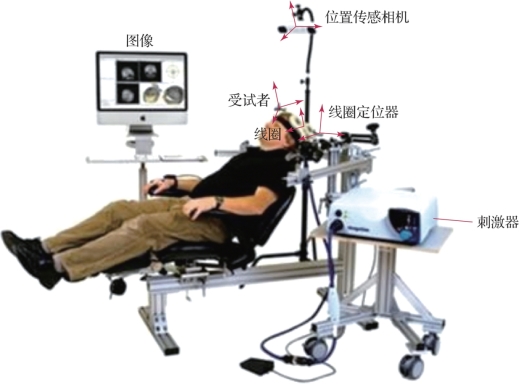
图9.6 TMS系统的构成(摘自Transcranial Magnetic Stimulation[8])(书后附彩插)
单脉冲磁刺激:单脉冲磁刺激每次将一个单独的脉冲应用于特定的皮质区域,可用于诊断和探测皮质对每个脉冲的反应。当应用于初级运动皮质时,单脉冲磁刺激可以诱发对侧肌肉活动,通过肌电图记录MEP,可以作为TMS效应的量化,用于测量运动阈值、皮质的兴奋性和功能区定位。
双脉冲磁刺激:又称配对脉冲刺激,是以极短间隔在同一个刺激部位连续给予2个不同强度刺激,或在2个不同部位应用2个刺激线圈分别给予不同强度脉冲刺激,多用于研究皮质易化及抑制作用,也可用于评估其功能连接性。
重复磁刺激(repetitive TMS,rTMS):rTMS利用脉冲序列诱导皮质活动,其效应持续时间超过刺激持续时间。研究结果显示,1 Hz以下的刺激会导致刺激区皮质活动受抑制,而大于1 Hz的刺激会增强刺激区皮质活动。θ爆发式刺激(theta burst stimulation,TBS)是在rTMS基础上开发的一种快速刺激范式,其刺激频率在θ频段内。其常用刺激范式包括间歇性刺激和持续性刺激两种,间歇性刺激可产生兴奋作用,而持续性刺激可产生抑制作用。
除了不同的刺激范式外,线圈也是影响TMS作用效果的重要因素,不同的线圈类型会导致刺激区域的大小不同。刺激线圈由一个或多个绝缘性良好的铜线圈组成,线圈常封闭在塑料模具中,可有各种形状和尺寸,如图9.7所示。每个线圈的几何形状决定了感应电场的形状、强度和整体焦点,从而决定了刺激区域的形状、强度和整体焦点。
图9.7(a)所示为圆形线圈。圆形线圈是最古老、最简单的TMS线圈。单个线圈产生垂直于线圈的球形磁场。这类线圈尽管聚焦性不是很强,但很适用于单脉冲刺激范式。
图9.7(b)所示为8字形线圈,也称蝶形线圈。8字形线圈通过将两个圆形线圈相接形成。虽然每个线圈单独使用时聚焦性不是很强,但是线圈接触点处的叠加磁场比周围区域更强,因此刺激区域在空间中容易确定。这种类型的线圈是大多数临床和科研的最优选择。仿真建模结果显示,一个小的8字形线圈(每个线圈直径4 cm)可以实现大约5mm3的空间分辨率。
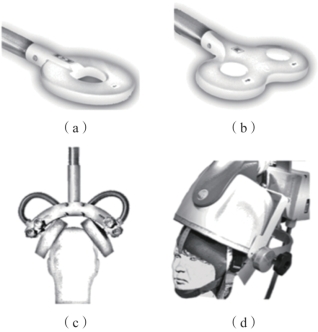
图9.7 不同形状的刺激线圈(摘自Transcranial Magnetic Stimulation[8])
(a)圆形线圈;(b)8字形线圈;(c)双锥线圈;(d)Hesed线圈
图9.7(c)所示为双锥线圈。双锥线圈是最早出现的深部线圈,其构成类似于8字形线圈,但两个线圈(称为“翼”)不共面,而是呈一定角度。这种线圈通常可诱发较大的电场强度,常用于刺激下肢运动代表区或通过刺激内侧额叶达到激活前扣带回皮质的目的。
图9.7(d)所示为Hesed线圈,简称H型线圈。H型线圈是由比利时科学家Yiflach Roth和Abraham Zangen等提出的,通过具有多个平面的更复杂的线圈设计来实现的,产生磁场的衰减函数较为平缓,使得电流可以更深地进入大脑。H型线圈旨在刺激更深的皮质层。研究表明,H型线圈能够刺激皮质表面以下6 cm的神经结构。目前FDA已批准H型线圈用于治疗耐药性抑郁症。
除了以上较为典型的线圈类型外,研究人员也会根据具体的需求设计线圈,如用于深部刺激的H型线圈,由处在平行平面上的一大一小两个线圈构成,以及可以实现集中刺激的四叶草型线圈等。
自1985年开始,科学家对磁刺激的研究也不断深入,世界上第一个TMS装置是在1985年开发,最初用于诊断和研究,后来用于治疗。其在发展过程中通常与神经科学技术相结合,不仅用于评估大脑活动与行为之间的因果关系、皮质内和皮质间的相互作用[9],以及各种神经精神疾病的神经生理学基础等,还应用于调节大脑活动,在一系列神经精神疾病如抑郁症、慢性疼痛和癫痫的治疗中显示出较好的应用前景。
9.4 声刺激神经调控
随着科学研究的逐渐深入,研究人员发现,虽然电活动是神经元活动的主要形式,但给予其他类型的物理刺激,如机械波的力学效果、光照和温度等,也可以改变细胞活动,于是本质为机械波的声音信号便被开发出了新的用途。
对人体的声刺激主要分为两类:一类是频率超出人类听觉范围,直接作用于神经细胞的超声刺激;另一类是频率在人类听觉范围内,作用于人体听觉器官的声音刺激。
9.4.1 经颅超声刺激
经颅超声刺激(transcranial ultrasound stimulation,TUS)与TMS的作用方式类似,通过外部的刺激器将超声信号输入颅内从而调节神经细胞活动。一般认为,TUS的作用机制是基于超声和神经细胞膜之间的机械相互作用。研究显示,神经元上存在着一部分机械敏感性(mechanosensitive,MS)离子通道,它是一类开放情况随细胞膜张力变化呈现相应变化的离子通道,一些神经递质受体也有类似特性。虽然也有研究认为神经元产生活动是因为细胞膜的电特性,与平行板电容器类似,当超声(机械波)作用于膜上时,膜结构会发生瞬时改变,因此瞬时的膜电容变化进而引起电流,可能会激活电压门控的钠通道和钾通道。虽然超声的具体作用机制尚未明确,但在体外小鼠大脑和海马切片研究中发现,低强度、低频超声能够激活电压门控的钠通道和钙通道,说明超声确实可以引起离子通道的变化。
除了改变离子通道通透性外,超声还被认为会使细胞膜产生孔隙进而改变细胞膜通透性。超声作用时,液体中的微小泡核被激活,这些泡核即空化泡,空化泡会发生振荡、生长、收缩、崩溃,在崩溃瞬间产生高温高压和激流,使细胞膜穿孔,从而增加细胞膜通透性。超声强度适宜时孔隙会在一定时间内完成自我修复,不会损伤细胞,但超声强度很大时会破坏膜蛋白或造成膜破裂等不可逆的损伤。
超声刺激可用于调节局部的神经活动。1929年,美国动物学家Harvey在实验中对蛙神经和乌龟的肌肉进行超声刺激,首次发现高频超声能够调节可兴奋细胞的活动,目前使用TUS也可增加MEP幅度。在超声刺激的发展过程中也出现了各种类型的刺激模式,其中经颅聚焦超声刺激(transcranial focused ultrasound stimulation,tFUS)显示出了较为明显的应用价值。聚焦超声通过MRI进行高精度定位,将多路超声信号聚焦在目标位置进行调节[10],依据超声强度大小可分为高强度聚焦超声(high-intensity focused ultrasound,HIFU)及低强度聚焦超声(low-intensity focused ultrasound,LIFU)。
高强度聚焦超声的峰值功率一般在1 000 W/cm2以上,能够在聚焦区域产生损毁效果,目前用于肿瘤热消融和脑神经核团毁损治疗。一项应用HIFU损毁内囊前肢的研究显示,患者强迫、焦虑及抑郁症状均逐渐改善。该技术由于对脑组织进行不可逆的损毁,因此存在一定的安全隐患。
低强度聚焦超声利用能量约为HIFU万分之一(30~500 mW/cm2)的超声力学效应,实现对神经元和神经环路的刺激和调控。不同参数的超声可对特定脑区产生兴奋或抑制作用。另外LIFU技术有两大特点:一是可用于促进药物在特定脑区中的递送。聚焦超声可使血脑屏障靶向开放,因此可以通过非侵入的方式促进基因治疗与重组腺相关病毒的传递,并可能用于光遗传学神经调节。二是可以促进药物的局部释放,最大限度地减少药物对其他大脑区域的影响。聚焦超声可以作用于对局部温度或压力变化敏感的载体(如微泡、脂质体等),在特定位置释放药物。动物静息态fMRI的研究表明,tFUS神经调节的作用可在刺激后持续长达2 h,开辟了探索在线效应以及持久效果的新方法。
与非侵入性电刺激和磁刺激相比,理论上超声刺激具有更高的空间分辨率,并且聚焦超声可以刺激到深层结构。但由于颅骨为多层、充液和多孔非均匀性的复杂结构,聚焦超声穿过颅骨后会发生显著相位畸变和能量衰减,因此若想取得更好的调控效果,对于超声刺激的研究还应进一步深入。
9.4.2 作用于听觉器官的声音刺激
除了直接作用于神经系统的超声刺激外,适当的声音刺激被听觉器官接收后同样可以影响人体活动。研究表明,听觉系统和运动系统在皮质间、皮质下和脊髓水平上具有丰富的连接,因此听觉系统接收到的信号会投射到大脑运动结构,运动反应和节奏信号之间会产生同步化效应。
最常用的声音刺激为节律性听觉刺激(rhythm auditory stimulation,RAS)。节律被定义为基于时间规律的能量释放模式,由音符、节拍、重音和乐句组合组成。节律性听觉刺激是运用带有韵律的听觉节拍刺激来同步患者的言语和动作,最早用于口吃者的治疗,直到1997年第一次用于脑卒中偏瘫患者的步态训练。研究证明,音乐和声音的节律性刺激可以作为康复手段,对脑卒中、帕金森病、创伤性脑损伤等患者的步速、步幅和节奏均有积极影响。另外由于刺激是被动式给予,无须患者配合,即使患者没有运动动作或意图,或者对于因小脑损伤无法有意识地发现节律变化的患者,都会引起其听觉系统以及运动皮层和辅助运动区的神经活动。
节律性听觉刺激是神经音乐治疗(neurologicalmusic therapy,NMT)的一种。神经音乐刺激被认为可以调节人的情绪,后续的研究表明使用听觉刺激增强睡眠期间的慢波振荡可增强记忆。目前的神经音乐刺激已发展出许多类型,其作用也不单单是改善运动[11],还有增强感觉和认知等的功能。目前音乐疗法已发展为一项特色康复疗法,相关研究和应用还在进一步深入[12]。
9.5 光刺激神经调控
与声刺激类似,光刺激也可分为两类:作用于视觉器官的光刺激和作用于神经细胞的光刺激。最常用的作用于视觉器官的光刺激是以闪烁形式呈现的稳态视觉诱发电位,这部分在第7章有介绍。SSVEP可作为脑电信息分析的重要指标,常用于脑机接口技术。另外,闪烁刺激对某些神经系统疾病也有一定效果。研究表明,将小鼠暴露于40 Hz闪烁光的环境下可以改善其认知功能并逆转与阿尔茨海默病相关的神经变性过程,有望在阿尔茨海默病患者的治疗中取得突破。
作用于神经细胞的光刺激主要有两类,一类是基于光遗传学的光调控,一类是基于红外光的光调控,两种方式分别依赖于光化学机制和光热机制。
9.5.1 光遗传技术
光遗传学是结合光学与基因编辑等工程技术的交叉学科,其主要是借助基因工程技术,将外源光敏蛋白的基因靶向导入特定类型的细胞中,使得这些细胞具有响应光刺激的能力,实现对神经元活动的控制。
光遗传技术的实现需要三个步骤:确定合适的光敏蛋白、向神经元导入光敏蛋白、施加适当的光刺激。确定光敏蛋白时,根据研究需要可选择光激活性通道蛋白或光抑制性通道蛋白。目前光遗传学中常用的激活性光敏蛋白是视紫红质通道蛋白-2(channelrhodopsin-2,ChR2),它是一种非选择性阳离子通道蛋白,对波长为472 nm附近的蓝光敏感,自1991年从莱茵衣藻中发现后被许多实验室关注。在接受蓝光刺激后,ChR2可以快速形成光电流,使细胞发生去极化反应,进而引起神经元兴奋。常用的抑制性通道蛋白为盐系菌视紫红质通道蛋白(halorhodopsin,NpHR)。NpHR是一种氯离子通道蛋白,对波长为593 nm左右的黄光敏感,能够在激活状态促使氯离子流入细胞膜,引起神经元超极化,从而抑制神经元活动。
为使光敏蛋白在神经元中表达,需要通过基因载体将光敏蛋白基因靶向导入神经元中,慢病毒载体(lentiviral vector,LVV)和腺相关病毒载体(adenovirus associated virus vector,AVV)是光遗传学中最常用的病毒载体。近年来,随着生物技术的发展,研究者通过优化现有光敏蛋白的动力学参数或人工合成新的光敏蛋白,同时对病毒载体进行不断改造,成功地将蛋白的光敏感性、表达效率和表达的特性提高到了一个新的层次,这使得光遗传学可以快速且特异性地控制神经元的优势得到更好的发挥。
通过施加不同波长的光刺激可以达到激活或抑制的调控效果。由于所使用的光刺激频段在可见光范围内,无法直接从颅外传导至颅内,因此一般会通过植入光纤的方式进行刺激传输。在小鼠实验中,研究人员尝试去除部分颅骨后用氧化锆制成透明的“窗口”,以避免植入电极,在头骨上安放LED发射光线便可以实现刺激,不过这种方式只能刺激到大脑皮层的浅表区域。2018年,日本的一项研究表明,向脑内注射一种纳米颗粒便可以无须植入电极,这种颗粒称为上纳米转换颗粒。刺激时使用容易穿透人体的近红外光进行,而上转换纳米颗粒的特性在于可以在一侧接收到红外光后在另一侧发出蓝光和绿光,这样便可以通过刺激光敏蛋白达到调节神经活动的目的。
基于光遗传学的神经调控,最大优势在于在时间和空间维度上都具有很高的精度,使得神经组织可以在单个神经元尺度上进行人为干预。光遗传学神经调控自2005年被提出以来一直受到广泛关注。2010年,光遗传学被跨学科研究期刊《自然-方法》选为所有科学和工程领域的“年度方法”。然而,光遗传学最大的缺陷在于,必须依赖基因编辑技术修饰神经元,故而光遗传学当前较难直接应用于人体研究。
9.5.2 基于光热特征的调控技术
光作用于人体或细胞时,除了会与光敏感通道发生作用外,不可避免地会产生热效应。研究表明,细胞内环境的温度也会影响细胞活动,因此基于光的热效应特征也被用于调控神经活动。
光热效应的本质是能量传递,研究其分子机制的关键是找到获得光能量的受体。目前利用光热效应进行光调控的技术主要是近红外光调控技术,与其他波段的光相比,生物体对近红外波段的光有较高的吸收系数,因而能够吸收更多的能量。生物体内的近红外光受体主要有两类:一是线粒体中的细胞色素C氧化酶,另一种便是存在于各类结构中的水分子。细胞色素C氧化酶主要吸收810~950 nm的红外光波段,以增强线粒体活动,产生更多的ATP和活性氧,从而促进细胞代谢活动;而水分子主要吸收950 nm及以上波长的红外光能量。研究表明,红外光激活神经元的原理是光热效应直接或间接影响跨膜离子通道的活动,从而引发动作电位[13],而光热效应的主要介导物便是离子通道中的水分子。例如,在一项红外光刺激对听神经激活效应的研究中,便发现了名为TRPV1(辣椒素受体)的热敏离子通道,这种离子通道中的薄纳米水层是该热敏离子通道感受红外光刺激的关键。
早期的研究通过直接改变温度同样能够对离体神经元电活动产生影响,很好地支撑了光热效应的观点。此外,相较于直接通过温度变化对神经元进行刺激,光热效应引起的刺激具有更高的空间分辨率,便于实现靶向调控。目前使用红外光的神经调控技术在外周神经刺激方面已经取得卓有成效的进展,研究者们正在试图将其应用于中枢神经系统的调控。红外神经调控由于无须依赖生物学手段进行外源光敏蛋白转导,故而更有希望成为非侵入式光调控手段,应用于临床疾病的治疗[14]。
9.6 小 结
本章主要对神经调控技术进行介绍,根据应用的不同物理能量形式,将调控技术分为电、磁、声、光四个部分,每种刺激由于物理性质不同,能够达到的刺激效果也有所差异。每一种刺激方式都有优势和局限性,尚未有一种效果极佳的方式可完全替代其他方式中的任何一种。也有研究团队尝试将多种调控方式进行结合,如Norton在2003年最先提出的经颅磁声刺激(transcranialmagneto-acoustic stimulation,TMAS),该方法不同于利用电磁场变化诱导产生电流的刺激,而是基于导电组织的磁声耦合效应,利用聚焦超声束打入置于静磁场中的组织,引起组织内部导电粒子振动,振动粒子在磁场中受到洛伦兹力的作用,在超声聚焦区域耦合形成局部感应电流。该方法理论上可以利用超声的高聚焦特性实现高空间分辨率的无创电刺激,但还需进一步验证。
另外,本章介绍调控方式时主要以大脑为作用对象,实际上神经调控也可以作用于周围神经系统如脊髓刺激,通过为脊髓施加轻微的电脉冲缓解疼痛便是一种很好的非药物疗法;还有功能性电刺激,可用于在瘫痪患者的肢体中促进肌肉收缩,产生诸如抓握、行走、膀胱排尿和站立的动作,促进机体康复;对于部分功能完全丧失的患者,可用来开发辅助设备代替原功能丧失的器官等。
目前神经调控技术还处于发展阶段,有许多亟待解决的问题,不过随着技术的发展和研究的深入,神经调控技术将逐步趋向成熟,在临床疾病治疗上将会有更加广泛的应用。
参考文献
[1]MICHAEL SO.Deep-brain stimulation for Parkinson's disease[J].New England journal of medicine,2012,367(16):1529-1538.
[2]BENABID A L,BENAZZOUSA,POLLAK P.Mechanisms of deep brain stimulation.[J].Movement disorders,2002,17(Supplement3):S73-S74.
[3]FERTONANIA,MINIUSSIC.Transcranial electrical stimulation:what we know and do not know aboutmechanisms[J].Neuroscientist a review journal bringing neurobiology neurology&psychiatry,2017,23(2):109-123.
[4]NEGAHBANIE,KASTEN F H,HERRMANN C S,et al.Targeting alpha-band oscillations in a corticalmodelwith amplitude-modulated high-frequency transcranial electric stimulation[J].Neuroimage,2018,137:3-12.
[5]SATURNINO G B,MADSEN K H,SIEBNER H R,et al.How to target inter-regional phase synchronization with dual-site transcranial alternating current stimulation[J].Neuroimage,2017,163:68-80.
[6]PHIMISTER EG,LOZANO A M.Waving hello to noninvasive deep-brain stimulation[J].New England journal ofmedicine,2017,377(11):1096-1098.
[7]NAHAS Z.Handbook of transcranial magnetic stimulation[J].Journal of psychiatry&neuroscience,2003,28(5):373-375.
[8]HORVATH J C.Transcranial magnetic stimulation[J].Neuromethods,2014,89(1):235-257.
[9]ALIM M,SELLERSK,FROHLICH F.Transcranial alternating current stimulation modulates large-scale cortical network activity by network resonance[J].Journal of neuroscience,2012,3(12):608-610.
[10]NORTON S J.Can ultrasound be used to stimulate nerve tissue?[J].Biomedical engineering online,2003,2(1):6.
[11]CHEN J L,PENHUNE V B,ZATORRE R J.Listening to musical rhythms recruits motor regions of the brain[J].Cerebral cortex,2008,18(12):2844-2854.
[12]THAUT M H,HOEMBERG V.Handbook of neurologic music therapy[M].Oxford:Oxford University Press,2014.
[13]TSAISR,HAMBLIN M R.Biological effects and medical applications of infrared radiation[J].Journal of photochemistry&photobiology B:biology,2017,170:197-207.
[14]JEAN D,LUIS H,KATRIEN M,et al.And then there was light:perspectives of optogenetics for deep brain stimulation and neuromodulation[J].Frontiers in neuroscience,2017,11:663.
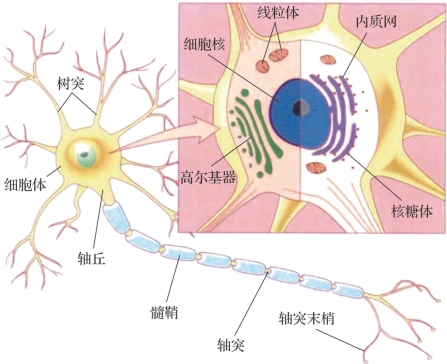
图1.2 神经元的基本结构(摘自《认知神经科学:关于心智的生物学》[1])
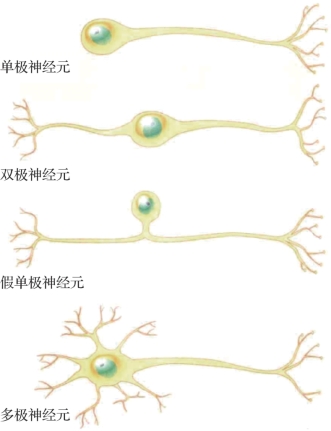
图1.3 各种神经元形态(摘自《认知神经科学:关于心智的生物学》[1])
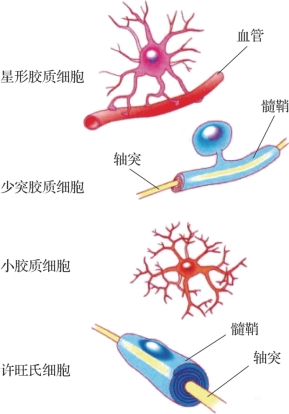
图1.4 各胶质细胞的主要结构(摘自《认知神经科学:关于心智的生物学》[1])(https://www.daowen.com)
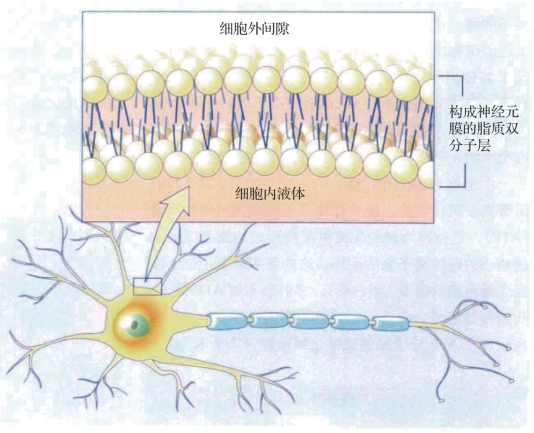
图1.5 细胞膜结构图(摘自《认知神经科学:关于心智的生物学》[1])
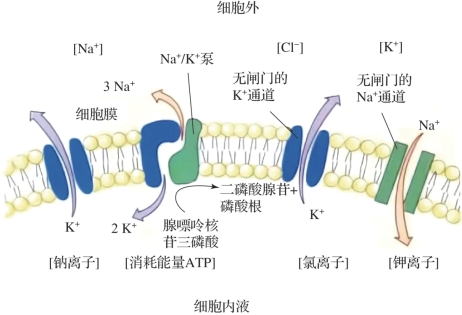
图1.6 神经元膜内的离子通道(摘自《认知神经科学:关于心智的生物学》[1])
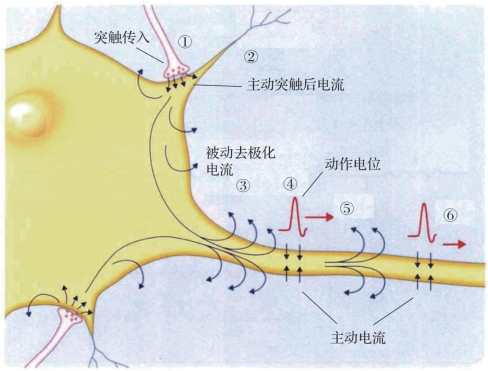
图1.7 动作电位(摘自《认知神经科学:关于心智的生物学》[1])
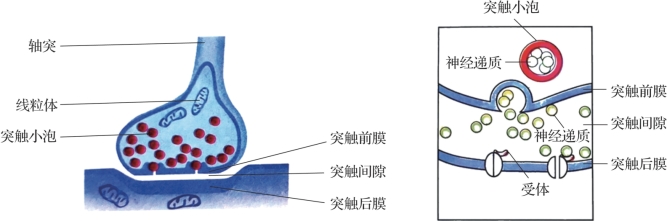
图1.8 突触的基本结构(《高中生物必修3》[7])
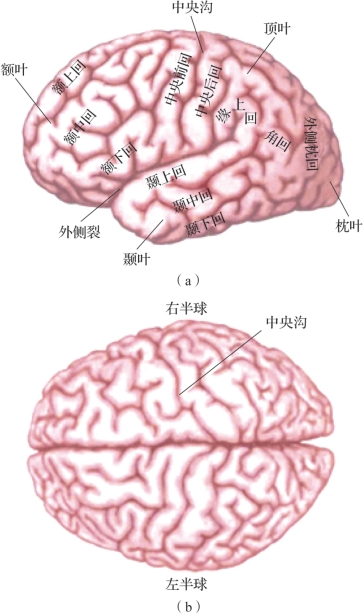
图2.1 大脑皮质(摘自《认知神经科学:关于心智的生物学》[2])
(a)人类左侧大脑半球的外侧面;(b)人类大脑皮质的俯视图(背面观)
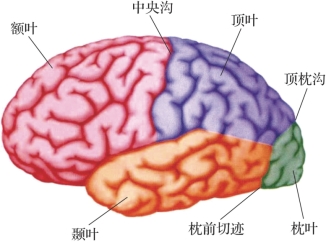
图2.2 左半脑的侧面观(摘自《认知神经科学:关于心智的生物学》[2])
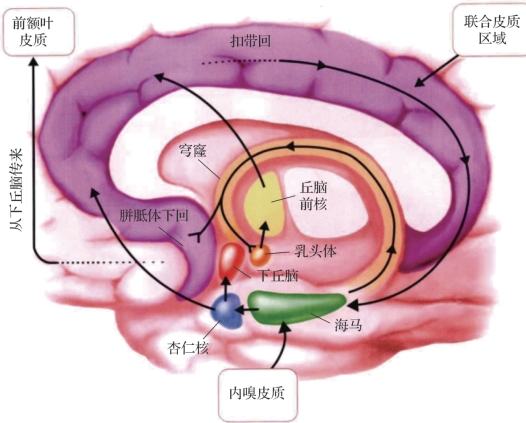
图2.4 右半球内侧面示意边缘系统的主要联系(摘自《认知神经科学:关于心智的生物学》[2])
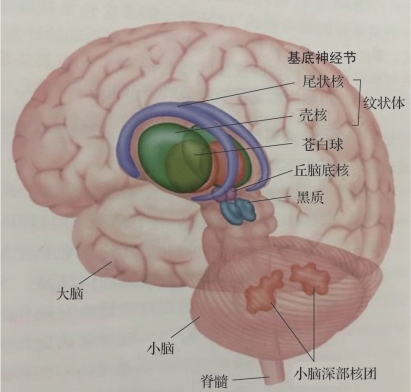
图2.5 基底神经节(摘自百度图片)
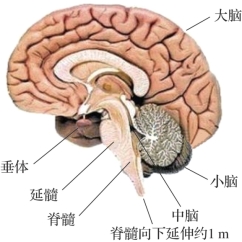
图2.9 脑干、小脑及脊髓(摘自百度图片)
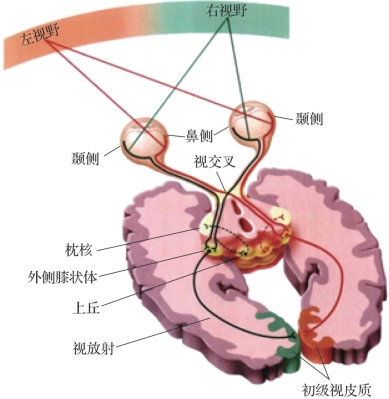
图3.1 视觉系统的初级投射通路(摘自《认知神经科学:关于心智的生物学》[1])
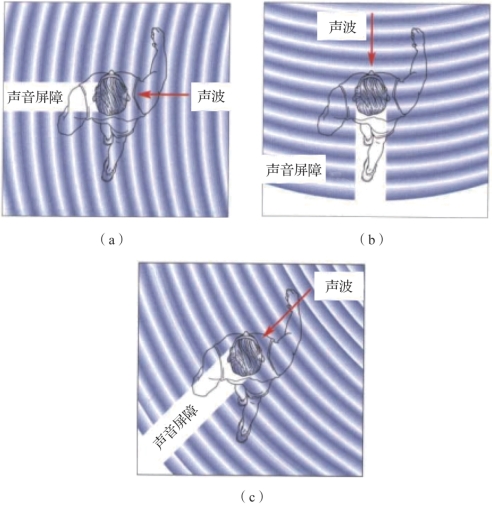
图3.2 两耳强度差作为判定声源位置的依据(摘自Neuroscience:Exploring the Brain[2])
(a)当高频声音来自右侧时;(b)当声音来自正前方;(c)当声音来自斜向方
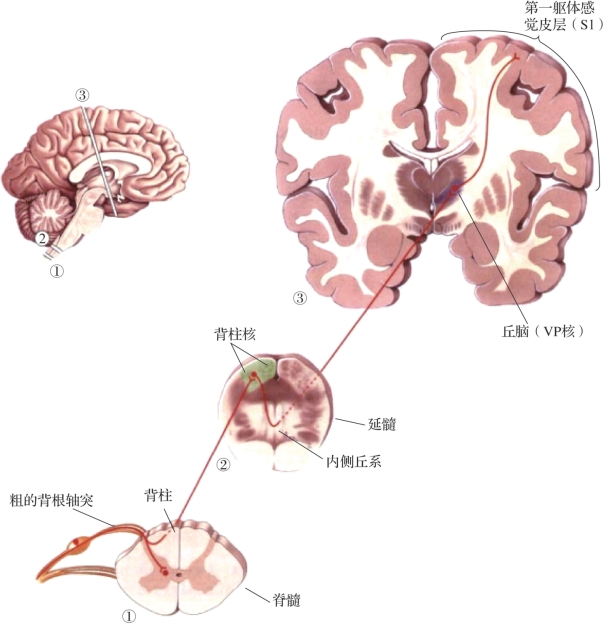
图3.3 背柱-内侧丘系通路(摘自Neuroscience:Exploring the Brain[2])
注:①~③表示对应位置的横切面。
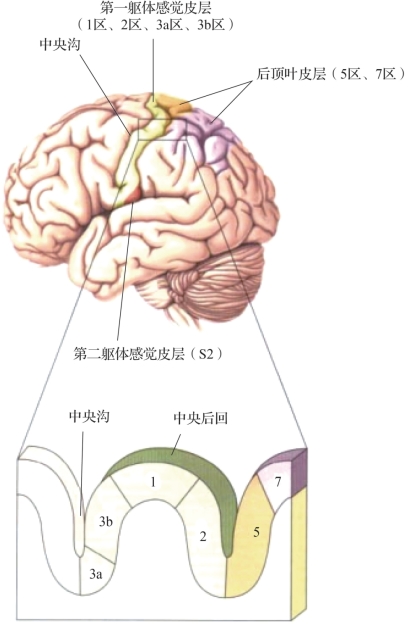
图3.4 皮层躯体感觉区(摘自Neuroscience:Exploring the Brain[2])
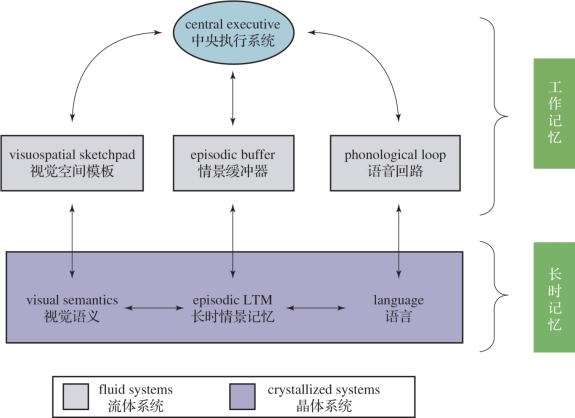
图3.11 Baddeley修正后的工作记忆模型(摘自百度图片)
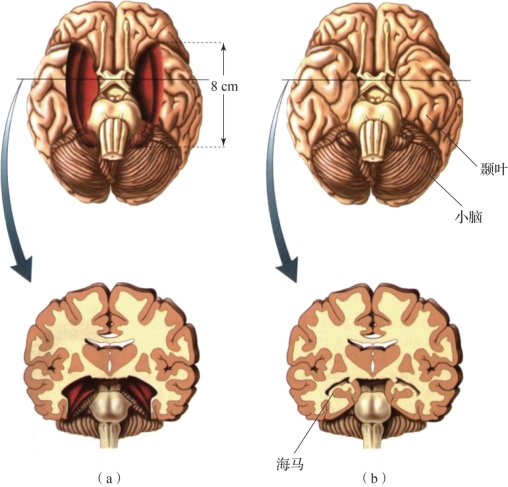
图3.12 病人H.M.的大脑以及正常人的脑(摘自Neuroscience:Exploring the Brain[2])
(a)病人H.M.的大脑;(b)正常人的脑
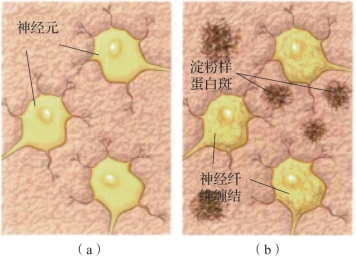
图3.13 正常人和阿尔茨海默病患者的皮质
(a)正常人;(b)阿尔茨海默病患者
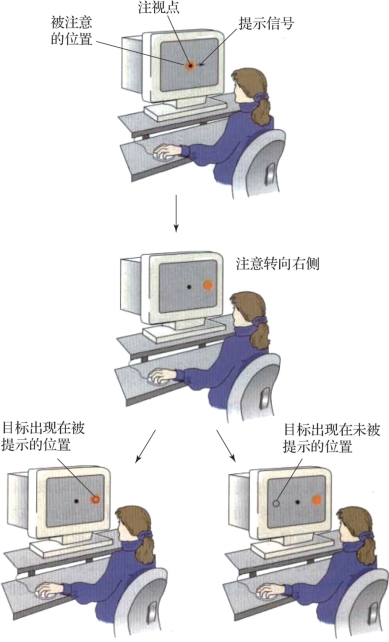
图3.14 实验过程(摘自Neuroscience:Exploring the Brain[2])
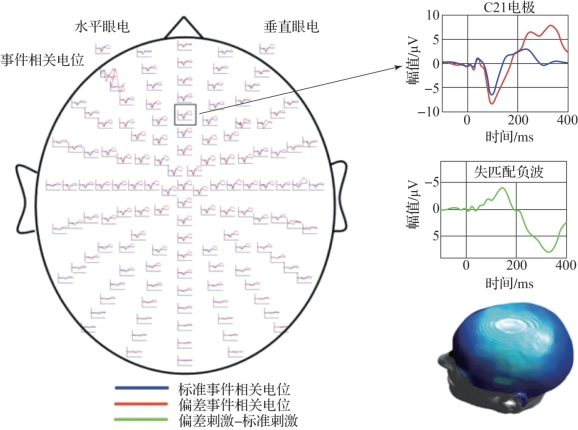
图4.5 失匹配负波(摘自Garrido et al.2007[6])
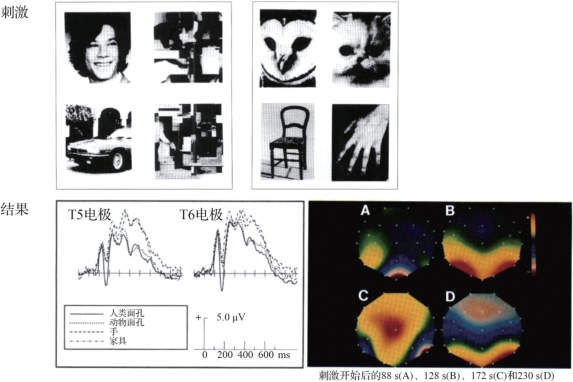
图4.6 N170(摘自Bentin et al.1996[7])
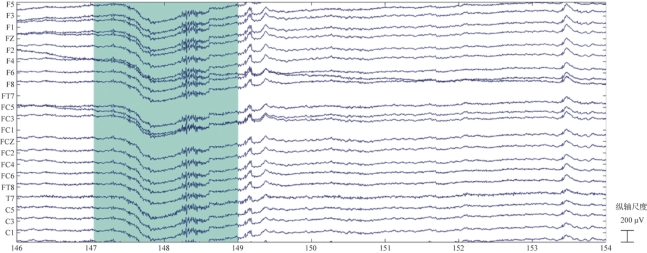
图4.8 信号坏段
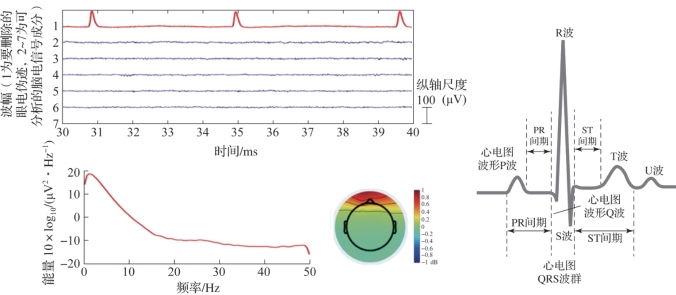
图4.9 噪声干扰源
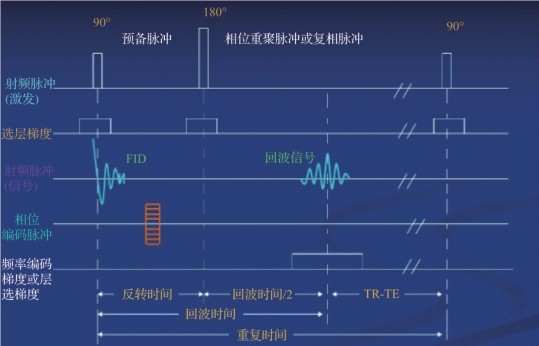
图5.11 自旋回波时间序列
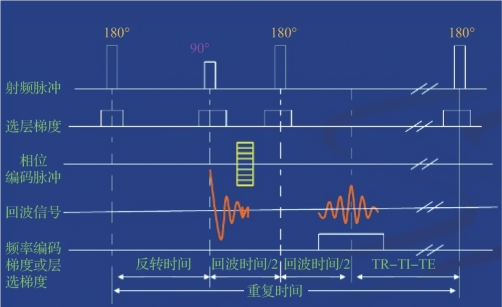
图5.14 反转恢复序列时序图
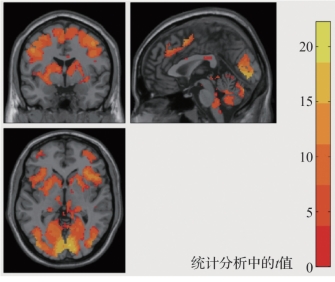
图5.18 SPM绘制的赌博任务激活脑区的示意图
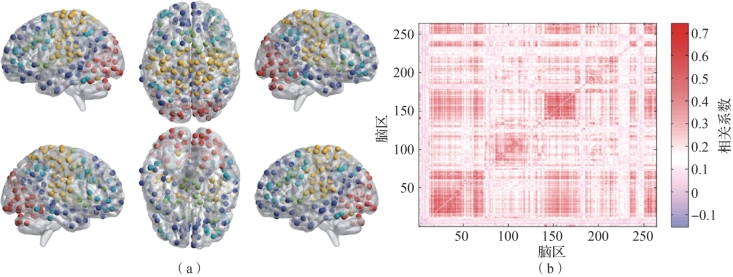
图5.19 Power等划分的264个功能脑区及其皮尔逊功能连接矩阵
(a)Power等划分的264个功能脑区;(b)皮尔逊功能连接矩阵
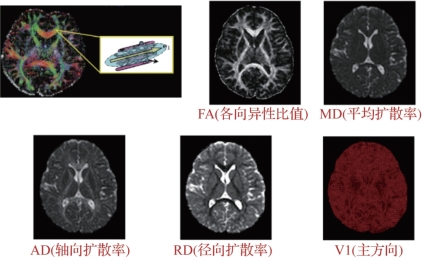
图5.28 基于体素的扩散指标示意图
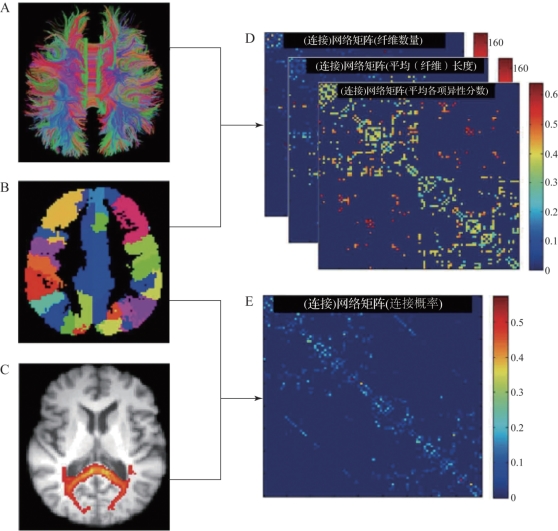
图5.32 脑白质网络构建示意图(摘自Cuiet al.2013[7])
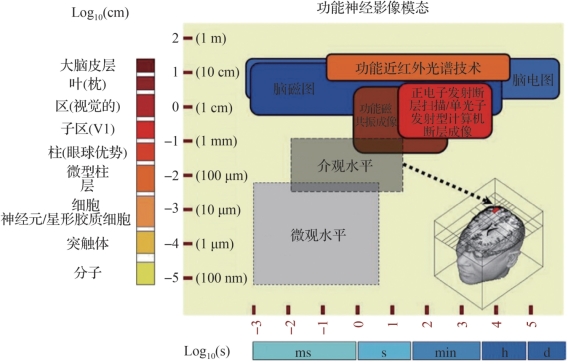
图6.2 常用无创功能神经影像模态的时空分辨率(摘自Uluda ,K.,et al.2014[1])
,K.,et al.2014[1])
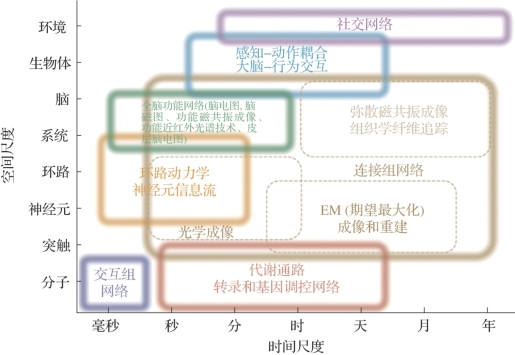
图6.3 多空间和时间范围的网络(摘自Bassett,D.S.,et al.2017[2])
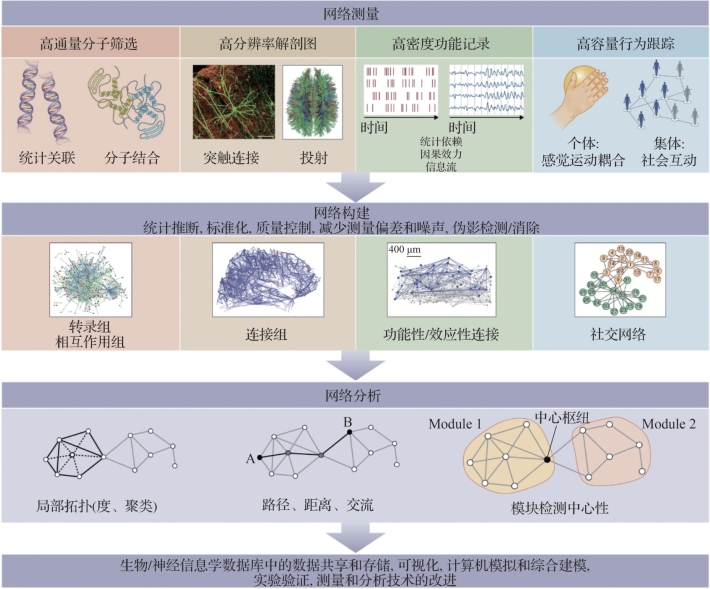
图6.4 网络测量、构建和分析(摘自Bassett,D.S.,et al.2017[2])
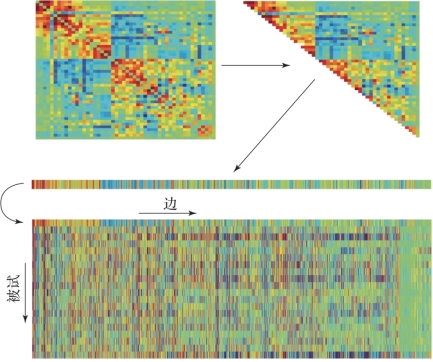
图6.5 用于组水平分析的矩阵(摘自Bijsterbosch,J.2017[3])
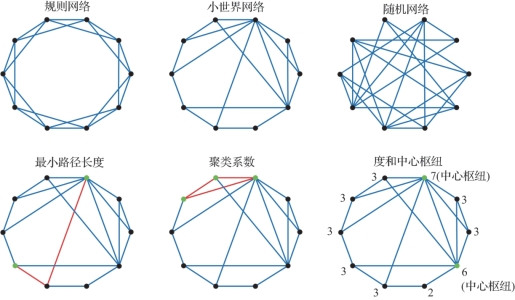
图6.6 计算网络功能的指标(摘自Bijsterbosch,J.,et al.2017[3])
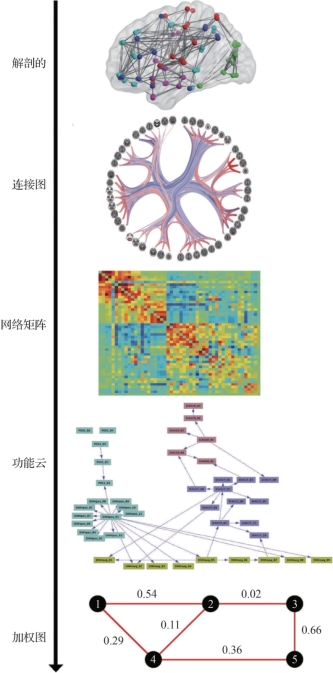
图6.7 脑网络可视化(摘自Bijsterbosch,J.,et al.2017[3])
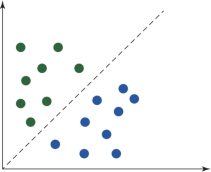
图6.8 线性可分数据
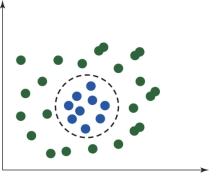
图6.9 非线性可分数据
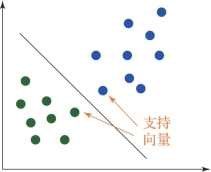
图6.10 支持向量
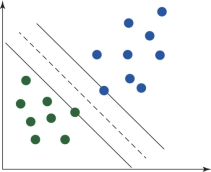
图6.11 情况1
图6.12 情况2
图6.13 聚类
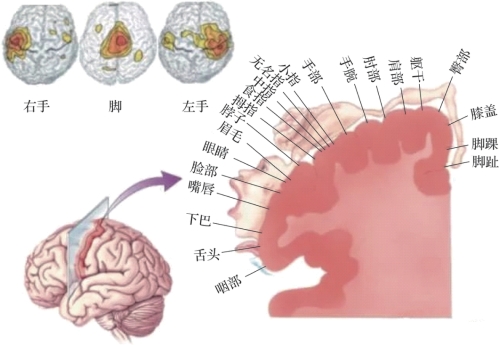
图7.1 感觉运动脑区和手脚运动的对应关系(摘自Neuroscience:exploring the brain 2001[1])
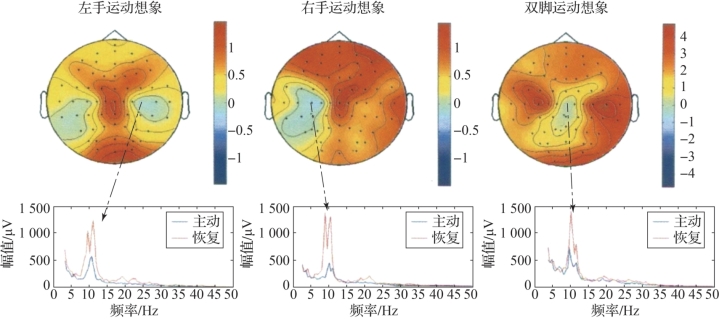
图7.2 想象左手、右手、双脚运动时C3和C4导联的脑电信号频谱图(摘自《认知建模和脑控机器人技术》[2])
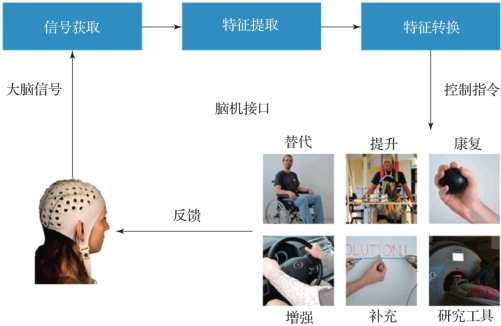
图7.6 脑机接口系统的基本组成及应用(摘自BNCIHorizon 2020:towards a roadmap for the BCI community[5])
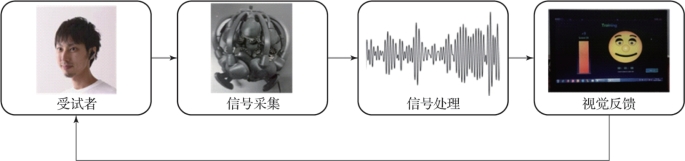
图8.1 基于脑电信号的视觉神经反馈系统
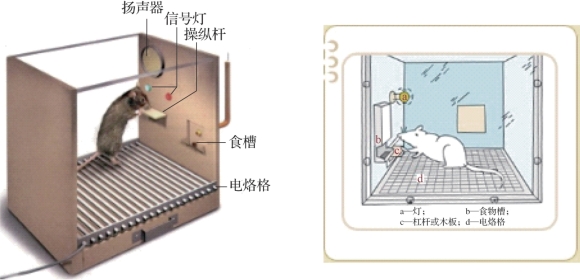
图8.2 斯金纳箱实验(摘自《心理学大辞典》[1])
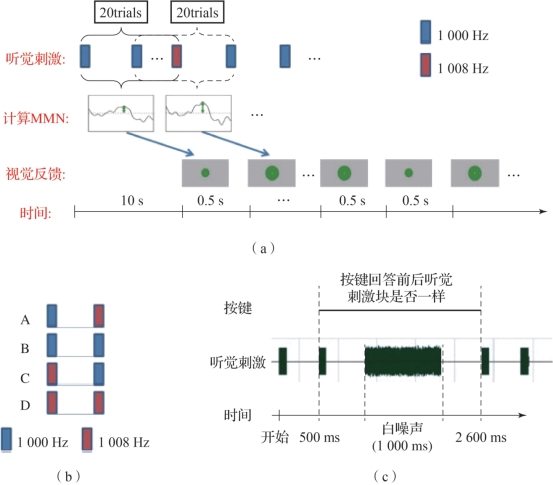
图8.5 听觉失匹配负波作为神经反馈的特征进行实时训练(摘自Chang,M.,et al.2014[4])
(a)实验设计示意图;(b)四种组合刺激设置;(c)听觉刺激与按键说明
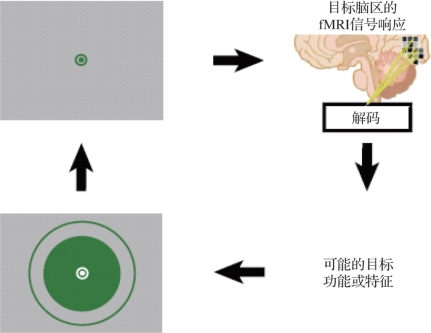
图8.6 典型的解码神经反馈模型(摘自W atanabe,T.,et al.2018[5])
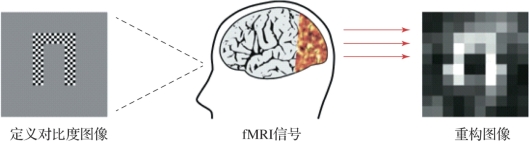
图8.7 初级视觉皮层解码(摘自M iyawaki,Y.,et al.2008[6])
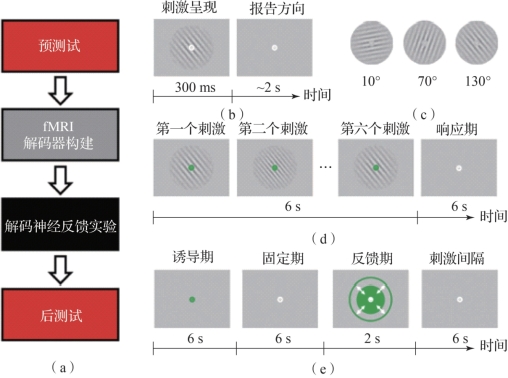
图8.8 应用解码神经反馈技术研究早期的视觉区域可塑性(摘自Shibata,et al.2011[7])
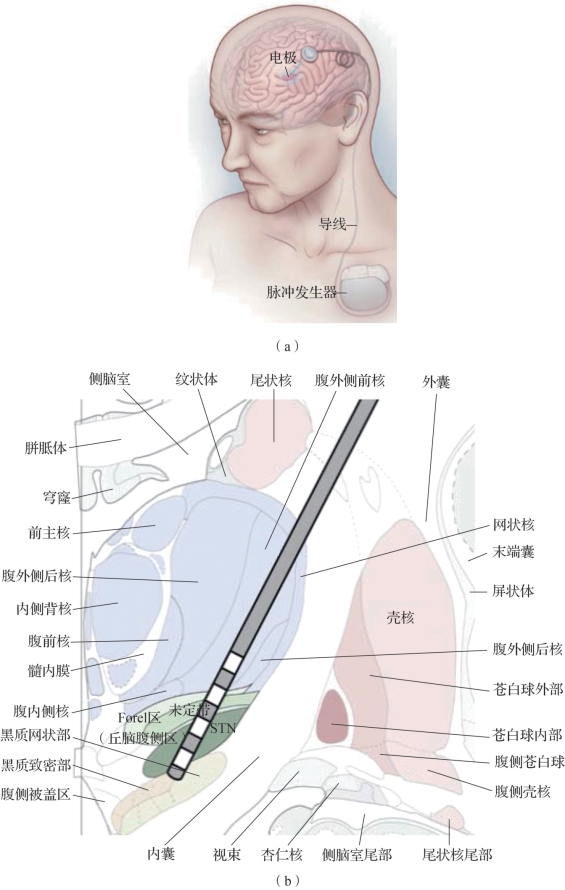
图9.1 DBS系统
(a)DBS系统构成(摘自Michael 2012[1]);(b)四接触刺激电极样式(摘自Benabid 2002[2])
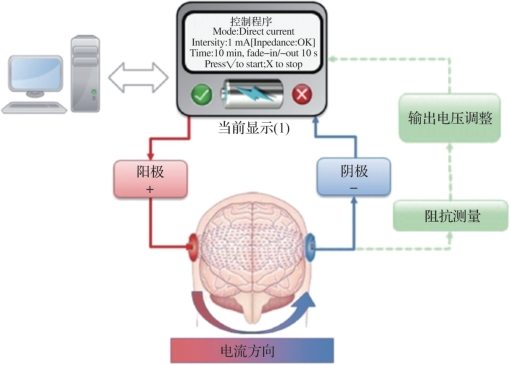
图9.2 tES系统构成(摘自Fertonani,et al.2017[3])
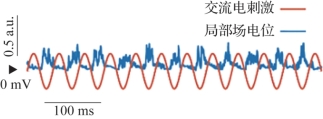
图9.3 基于计算模型的tACS效果(摘自Negahbani,et al.2018[4])
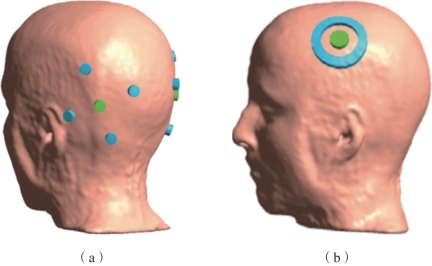
图9.4 HD-tES电极排布(摘自Saturnino,et al.2017[5])
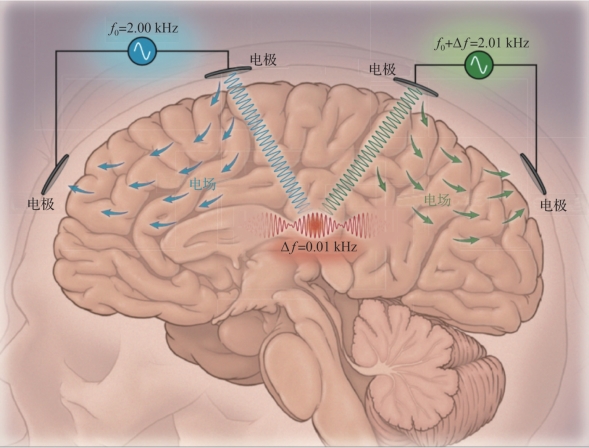
图9.5 干扰电刺激作用效果(摘自Phim ister,et al.2017[6])
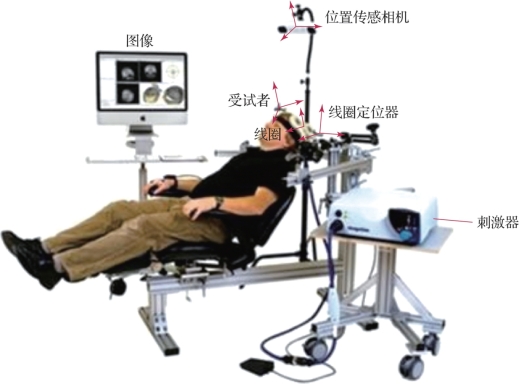
图9.6 TMS系统的构成(摘自Transcranial Magnetic Stimulation[8])
