一、蛋白质
蛋白质是生命的物质基础,它是生物体的主要构成成分,几乎参与机体的一切生命活动,是生命活动的主要承担者。因此,没有蛋白质就没有生命。
(一)蛋白质的分子组成
1.蛋白质的元素组成 组成蛋白质的元素很多,主要有碳(C)、氢(H)、氧(O)、氮(N)、硫(S),此外有些蛋白质还含有少量的磷、铁、铜、锌、锰等元素。
各种蛋白质含氮量恒定,平均为16%,即1g氮相当于6.25 g蛋白质。生物组织中的氮元素大部分存在于蛋白质分子中,所以测定生物样品中蛋白质含量时,只要测出样品中的含氮量就可以通过下列公式计算出蛋白质含量。
100 g样品中蛋白质含量(g%)=每克样品的含氮克数×6.25×100
2.蛋白质的基本组成单位——氨基酸(AA)不同种类的蛋白质经酸、碱或蛋白水解酶作用后,最终的水解产物都是氨基酸。因此,氨基酸是蛋白质的基本组成单位。
组成蛋白质的氨基酸有20种,并且各种氨基酸分子在结构上具有共同的特点。蛋白质水解得到的氨基酸都是α-氨基酸,即在连接羧基的α-碳原子上还连接一个氨基,故称α-氨基酸。α-氨基酸可以用结构通式表示(图15-1-1)。
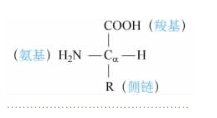
图15-1-1 α-氨基酸分子结构通式
每种氨基酸分子至少含有一个氨基(—NH2)和一个羧基(—COOH),并且都连接在同一个碳原子(α-碳原子)上。不同氨基酸的差异主要在于侧链(R基),根据侧链的不同,将氨基酸分为4类,即非极性氨基酸、极性中性氨基酸、酸性氨基酸、碱性氨基酸。
(二)蛋白质的分子结构和功能
1.蛋白质的分子结构 蛋白质是由许多个氨基酸分子互相连接而成的。氨基酸分子互相结合的方式是:一个氨基酸分子的α-羧基和另一个氨基酸分子的α-氨基相连接,同时脱去一分子的水,这种结合方式叫做脱水缩合。通常将一个氨基酸的α-羧基(-COOH)与另一氨基酸的α-氨基(-NH2)脱水缩合而成的化学键称肽键(图15-1-2)。氨基酸之间通过肽键连接而构成的化合物称肽。由两个氨基酸形成的肽称二肽,由3个氨基酸形成的肽称三肽,以此类推,通常将10个以上氨基酸形成的肽称多肽。多肽呈链状结构,又称多肽链。(https://www.daowen.com)
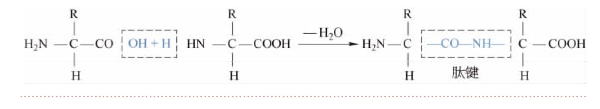
图15-1-2 肽键的结构
蛋白质多肽链中氨基酸的排列顺序是蛋白质的一级结构(基本结构),多肽链自身经过螺旋、折叠、盘曲等形成特定的空间结构(包括二级、三级、四级结构)(高级结构)。蛋白质分子必须具有特定的空间结构才有活性(功能)。
2.蛋白质的结构与功能的关系 通过大量蛋白质的结构与功能的相关性研究,发现具有不同生物学功能的蛋白质含有不同的一级结构。同样,从大量人类遗传性疾病的基因与相关蛋白质的分析结果,获知这些疾病的病因可以是基因点突变引起的1个氨基酸的改变,也可以是基因大片段碱基缺失导致大片段肽段的缺失,这说明蛋白质一级结构的变化,可导致其功能的改变。例如,镰状细胞贫血,就是由于血红蛋白分子中两个β亚基第6位正常的谷氨酸变异成了缬氨酸,患者的血红蛋白形成线状大分子,携氧能力降低,红细胞由正常的双凹圆盘状变为镰刀状,容易发生溶血。这种由遗传物质(DNA)异常导致蛋白质的一级结构改变而引起其生物学功能改变的遗传性疾病,称分子病。
蛋白质分子空间结构及其性质与生理功能的关系也十分密切。有些情况下,尽管一级结构不变,蛋白质折叠发生错误、空间构象发生改变,仍可影响其功能,严重时导致疾病的发生。例如,某些蛋白质错误折叠后,互相聚积,形成淀粉样沉淀,产生毒性而致病,这类疾病称蛋白质构象病,如阿尔茨海默病(老年痴呆)、牛脑海绵状病(疯牛病)等。
(三)蛋白质的变性作用
蛋白质分子的空间结构具有相对的不稳定性,在某些理化因素(高温、高压、紫外线、X线、γ射线、超声波、强酸、强碱、各种消毒制剂、重金属离子等)的作用下,空间结构被破坏,导致某些理化性质改变和生物学活性丧失,这种现象称蛋白质变性。
蛋白质变性在临床上应用广泛。例如,对于血液、白蛋白、球蛋白等血制品和胰岛素、干扰素等生物制品,要冷藏保管,以免蛋白质变性,否则不但失去其治疗功能,还危害患者的健康。而对于一些医疗器件、患者用品、病房等采用高温、高压、紫外线、消毒制剂的目的是使细菌蛋白质变性而失去活性,防止交叉感染。
(四)蛋白质的分类
1.按蛋白质分子组成成分 分为单纯蛋白质和结合蛋白质2类。单纯蛋白质是完全由氨基酸组成的蛋白质,如白蛋白、球蛋白等。结合蛋白质由蛋白质和非蛋白质(又称辅基)2部分组成,如糖蛋白、脂蛋白、核蛋白等。
2.根据蛋白质分子形状 可分为球状蛋白质和纤维状蛋白质2类。球状蛋白质有胰岛素、血红蛋免疫球蛋白等。纤维状蛋白质有角蛋白、胶原蛋白等。
3.根据蛋白质功能 可分为活性蛋白和非活性蛋白2类。活性蛋白有酶、蛋白质激素等。非活性蛋白有角蛋白、胶原蛋白等。
