临床试验数据管理机制的条例、准则和流程
与临床研究的其他领域类似,CDM流程必须遵循相应的指导原则和标准。制药业越来越多以电子方式收集药物的评估数据,因此不仅需要遵循CDM机制的指导原则,还需要维持电子数据获取的标准。电子记录必须遵循联邦法规(Code of Federal Regulations,CFR)。本规则适用于创建、修改、维护、存档、检索或传输电子格式的记录。此外,要求使用经过验证的系统,以确保数据的准确性、可靠性和一致性,并使用安全的由计算机生成的、有时间标记的审核跟踪过程,来独立记录数据条目的日期和时间,以及创建、修改或删除的电子记录。并且,应当建立适当的程序和控制,以确保数据的完整性、真实性和保密性。
临床数据管理学会(Society for Clinical Data Management,SCDM)出版的临床数据管理实践准则(Good Clinical Data Management Practices,GCDMP),是CDM内部操作要遵循的最佳专业标准。GCDMP最初发表于2000年9月,此后进行了多次修订。2013年10月版本是当前使用的GCDMP版本(Society for Clinical Data Management,2013)。
临床数据交换标准协会(Clinical Data Interchange Standards Consortium,CDISC)是一个全球性、开放、多学科、非营利性的组织,通过建立标准来支持采集、交换、递交和储存临床研究数据与元数据。其使命是发展和支持建立全球性的数据标准平台,使信息系统能够互相交流,从而促进医药研究和相关卫生保健领域研究的发展。CDISC创建了一系列临床研究数据的标准,在这些标准中,有两个很重要的标准,即研究数据表格模型实施指南(Study Data Tabulation Model Implementation Guide for Human Clinical Trials,SDTMIG)和临床数据采集标准(Clinical Data Acquisition Standards Harmonization,CDASH),这两个标准在CDISC网站(www.cdisc.org)可以免费提供。作为指南,SDTMIG描述了数据的模型和标准术语的详细信息。CDASH定义了在临床试验中收集数据的基本标准,并从临床、管理和科学角度记录所需的基本数据信息。图10-1和图10-2显示了临床数据管理的基本流程。
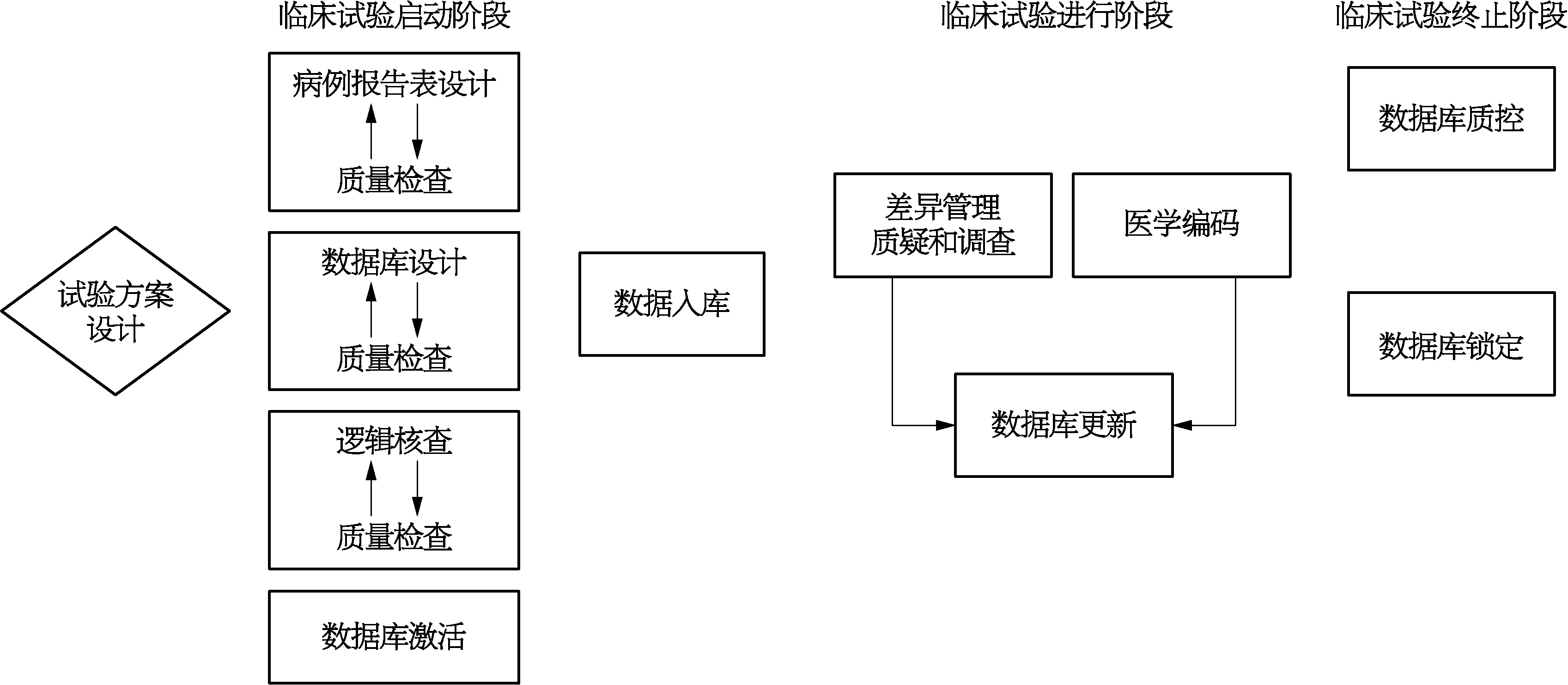
图10-1 临床数据管理流程图
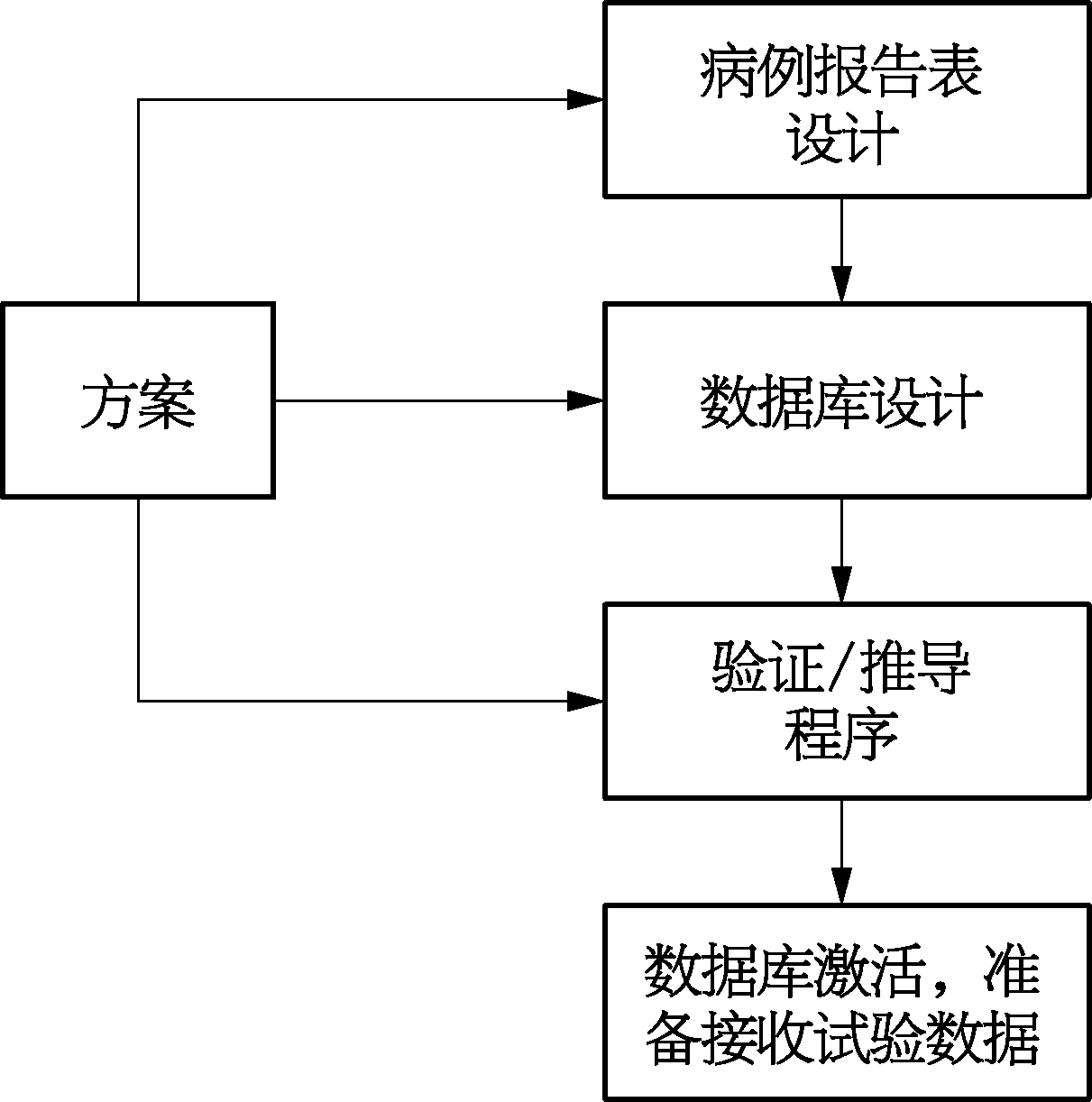
图10-2 临床试验数据管理启动过程图
