ICH技术指导原则
如上所述,ICH旨在协调各国的人用药的上市标准,使其建立在统一的科学与技术基础上,所以其核心工作是制订和修订相关的技术指导原则。ICH的技术指导原则按内容分类,分别为质量部分(quality,Q)、安全性部分(safety,S)、有效性部分(efficacy,E)和多学科部分(multidisciplinary,M,也就是综合部分)四大类。M部分包含各成员国适用统一的通用技术文件格式(common technical documents,CTD),作为药品上市申报文件的基本标准。质量指南(Q),在质量领域的协调成就,包括关键的里程碑如开展稳定性研究、定义杂质检测的相关阈值,以及一个更加灵活的方法对药品质量进行风险管理,此方法基于良好的生产实践(GMP)。安全指南(S),ICH制定了全面的安全指南,以揭示潜在的风险,如致癌性、基因毒性。最近的一项突破是评估QT间隔时间延长责任的非临床测试策略,这是近年来导致停药的最重要原因。有效性指南(E),ICH在有效性标题下开展的工作涉及临床试验的设计、实施、安全和报告。它还包括从生物技术过程中获得的新型药物以及利用药物遗传学/基因组学技术生产更好的靶向药物。多学科指南(M),这些为交叉的课题,不适用于统一的质量、安全和有效性类别。它包括ICH医学术语(MedDRA)、通用技术文件(CTD)和制定用于监管信息传输的电子标准(ESTRI)。
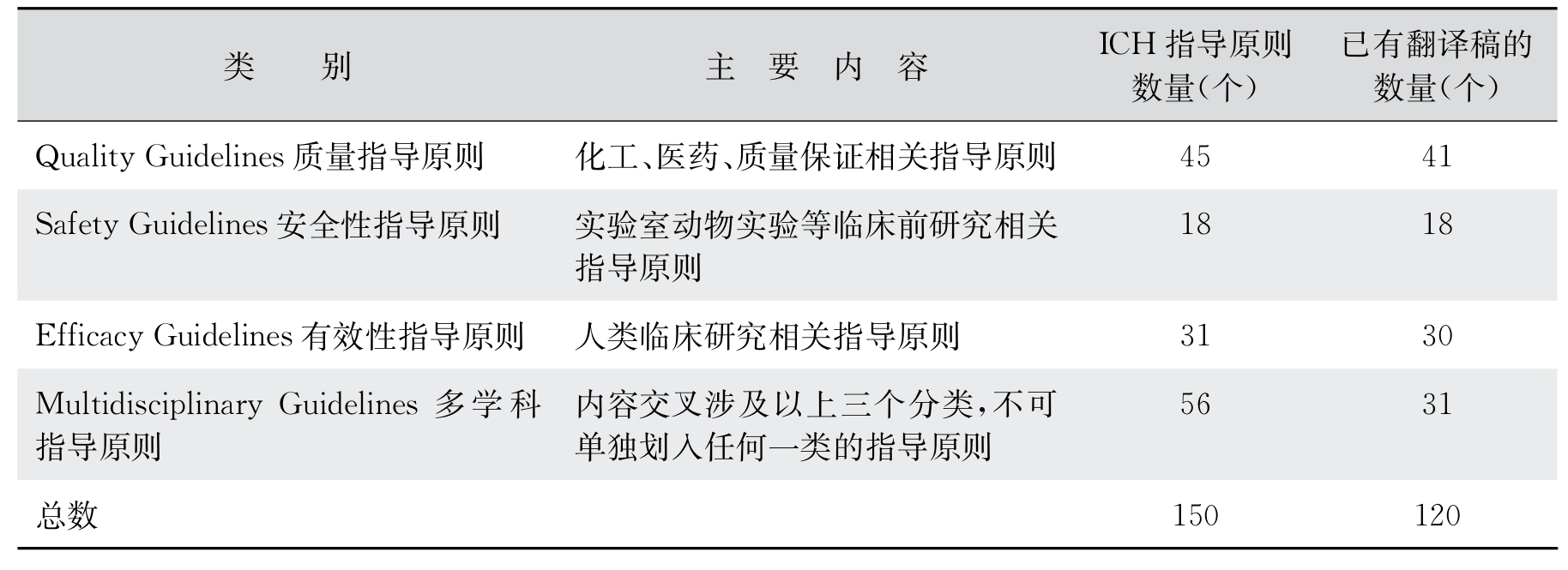
表12-3列出了截至2020年12月ICH有关质量、安全性和有效性的所有指导原则,并包括指导原则及其问答文件,多学科指导原则中还包括概念文件、工作计划及相关规范性文件等,其中指导原则文件12个,其他文件49个,也指出了已有中文翻译的数量。读者可以从药品审评中心网站下载和查阅。
表12-3 ICH有关指导原则
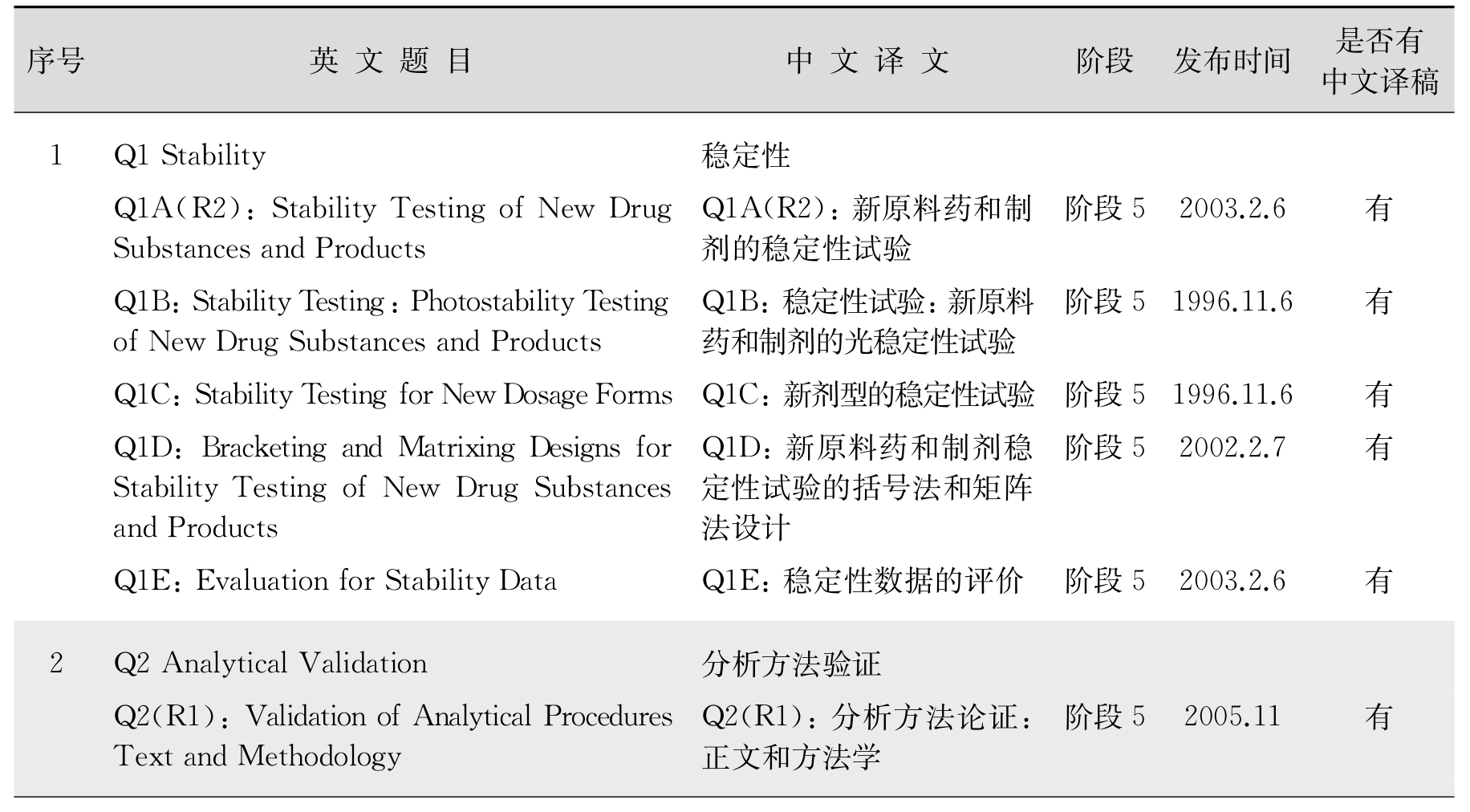
1.质量(M)部分技术指导原则 ICH的质量部分技术指导原则包含12个方面,包含药品研发和生产过程中的关键环节,如稳定性研究、分析方法验证、有关物质或杂质的检测的限度、质量标准等(表12-4)。其中Q7是药物有效成分的GMP,Q8、Q9和Q10是质量源于设计(quality by design,QbD)的一个系列,Q11专门适用于原料药的研发和生产。
表12-4 质量(Quality Guidelines)包含内容
(续表)

(续表)

(续表)
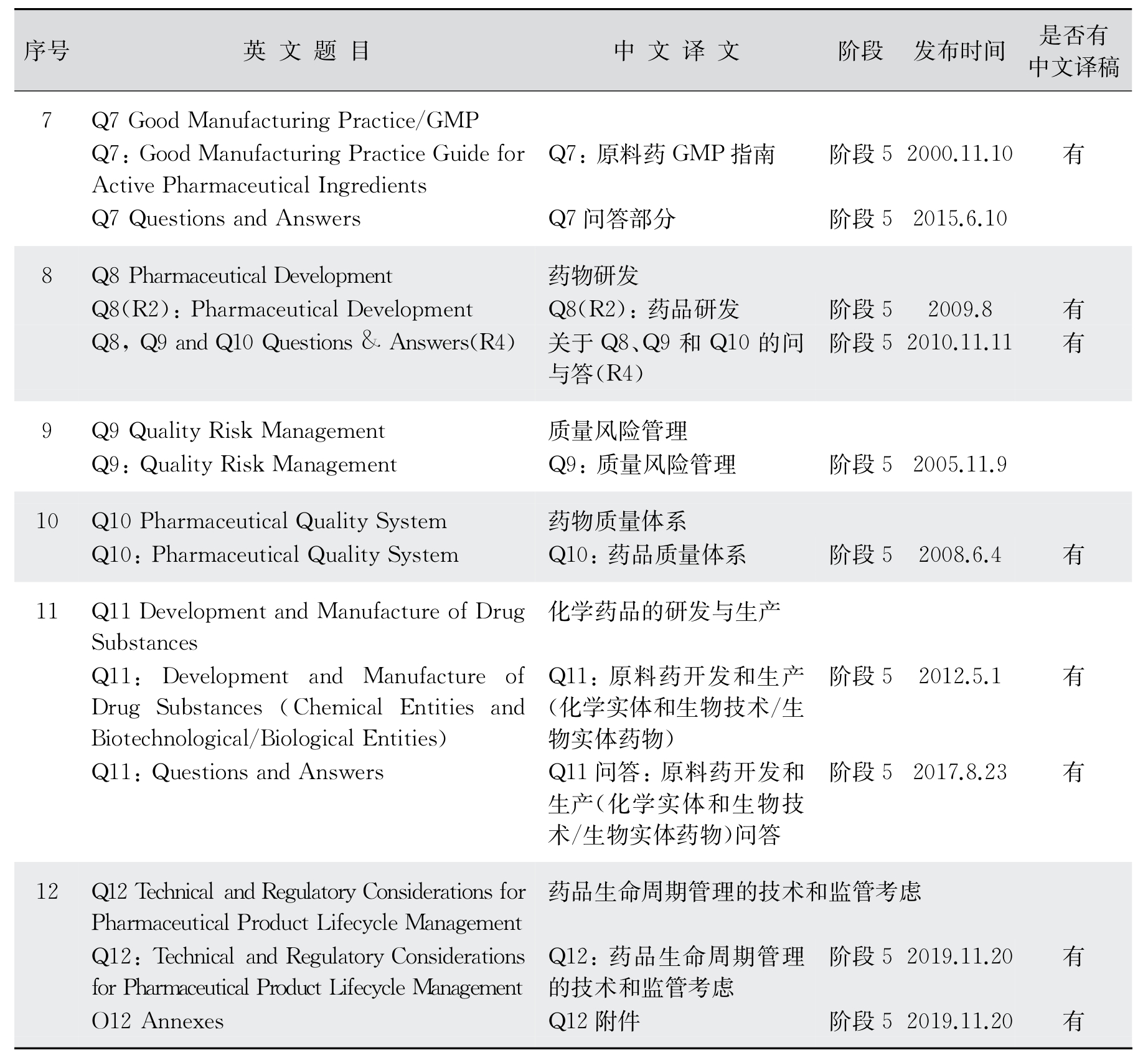
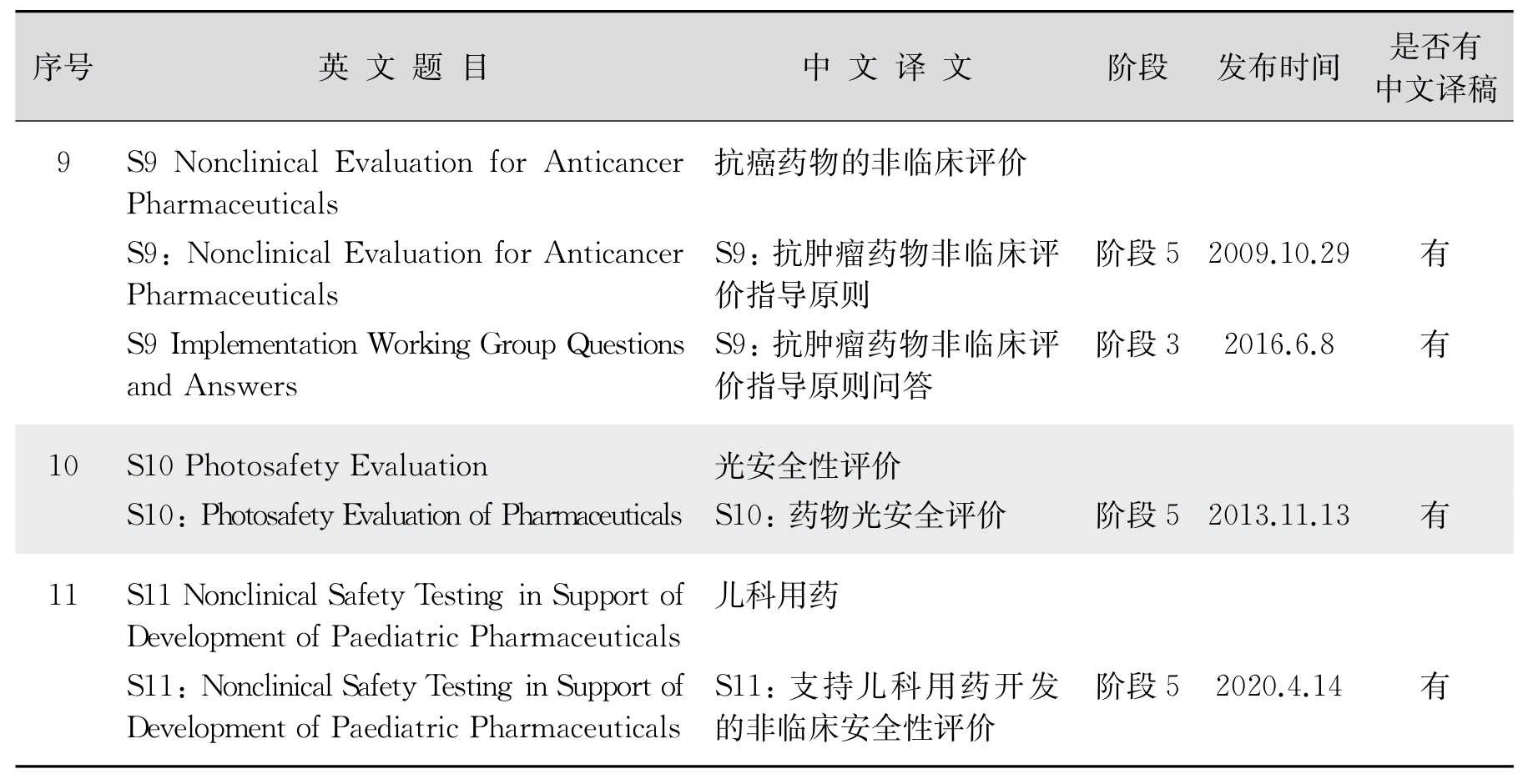
2.安全性(S)部分技术指导原则 ICH的安全性部分技术指导原则用于指导药物研发的非临床毒性研究和设计,也就是动物研究部分,如致癌性、基因毒性、生殖毒性和免疫毒性等(表12-5)。
表12-5 安全性(Safety Guidelines)包含内容

(续表)

(续表)
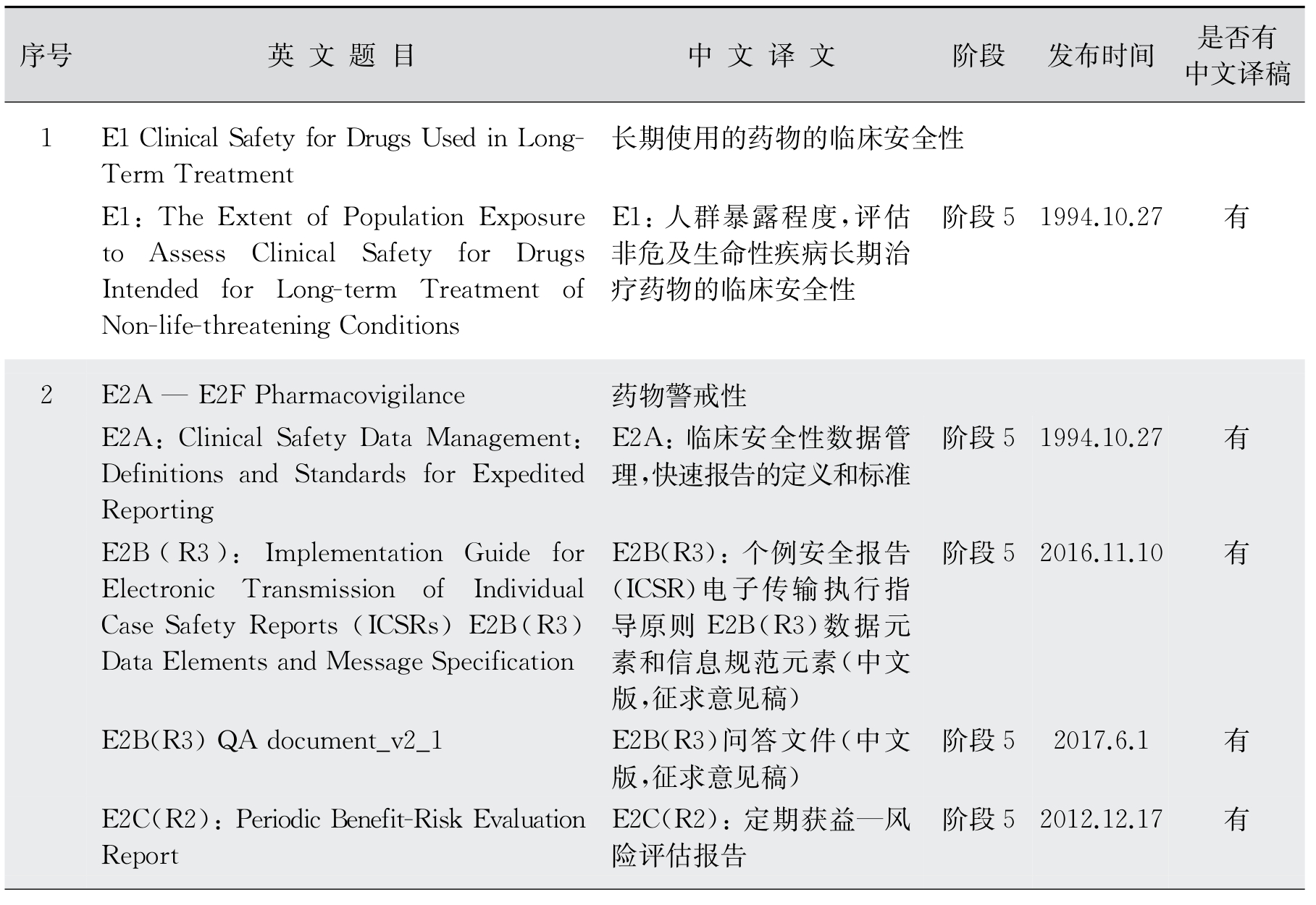
3.有效性(E)部分技术指导原则 E1到E19是对各种临床试验的设计、实施,药物安全和试验报告的指导,比如E3是对临床试验报告(Clinical Study Report,CSR)的撰写指导,E6是GCP指导原则,E14是关于心脏毒性试验指导,E11是儿童试验指导等(表12-6)。
表12-6 有效性(Efficacy Guidelines)包含内容
(续表)

(续表)

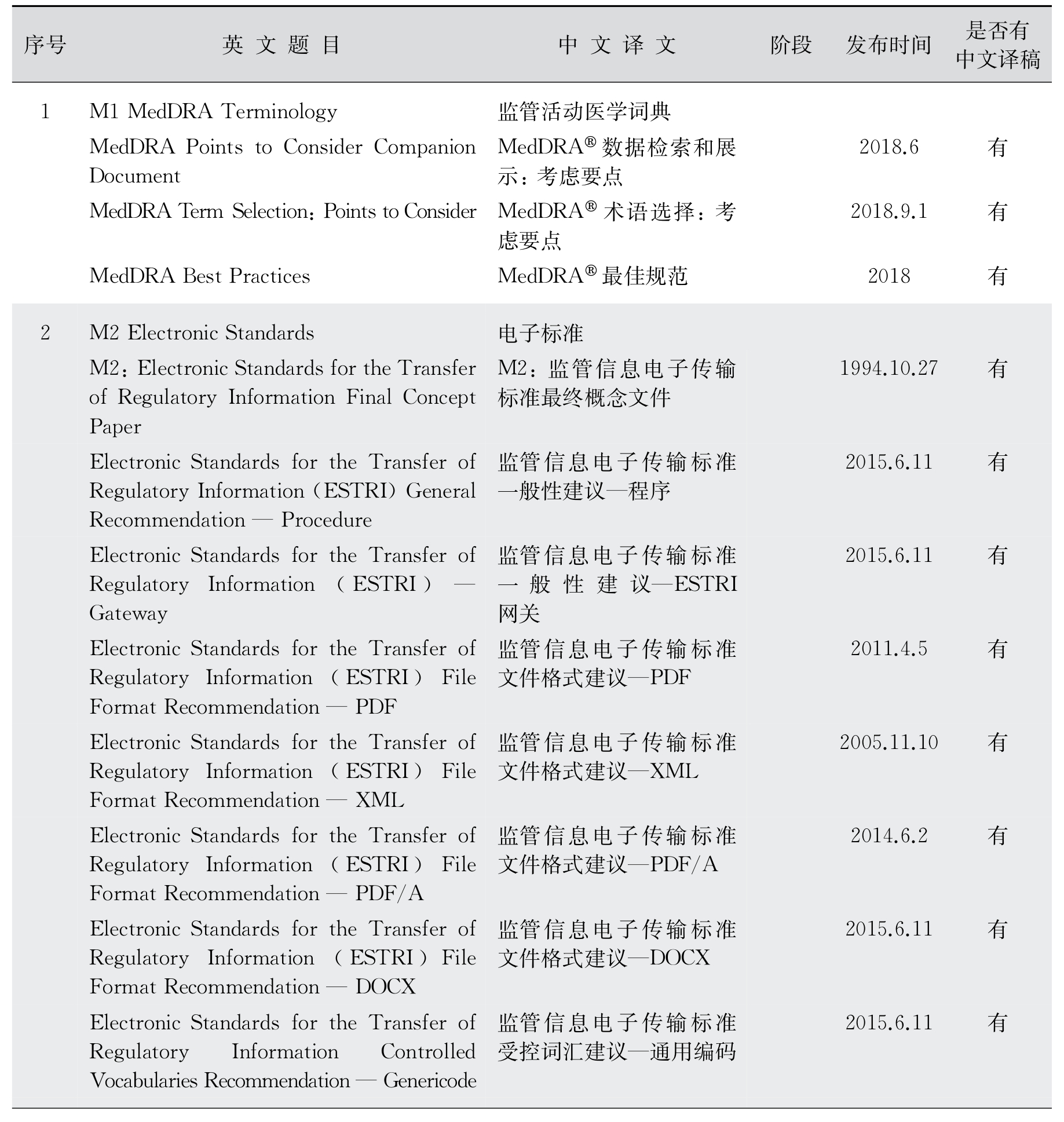
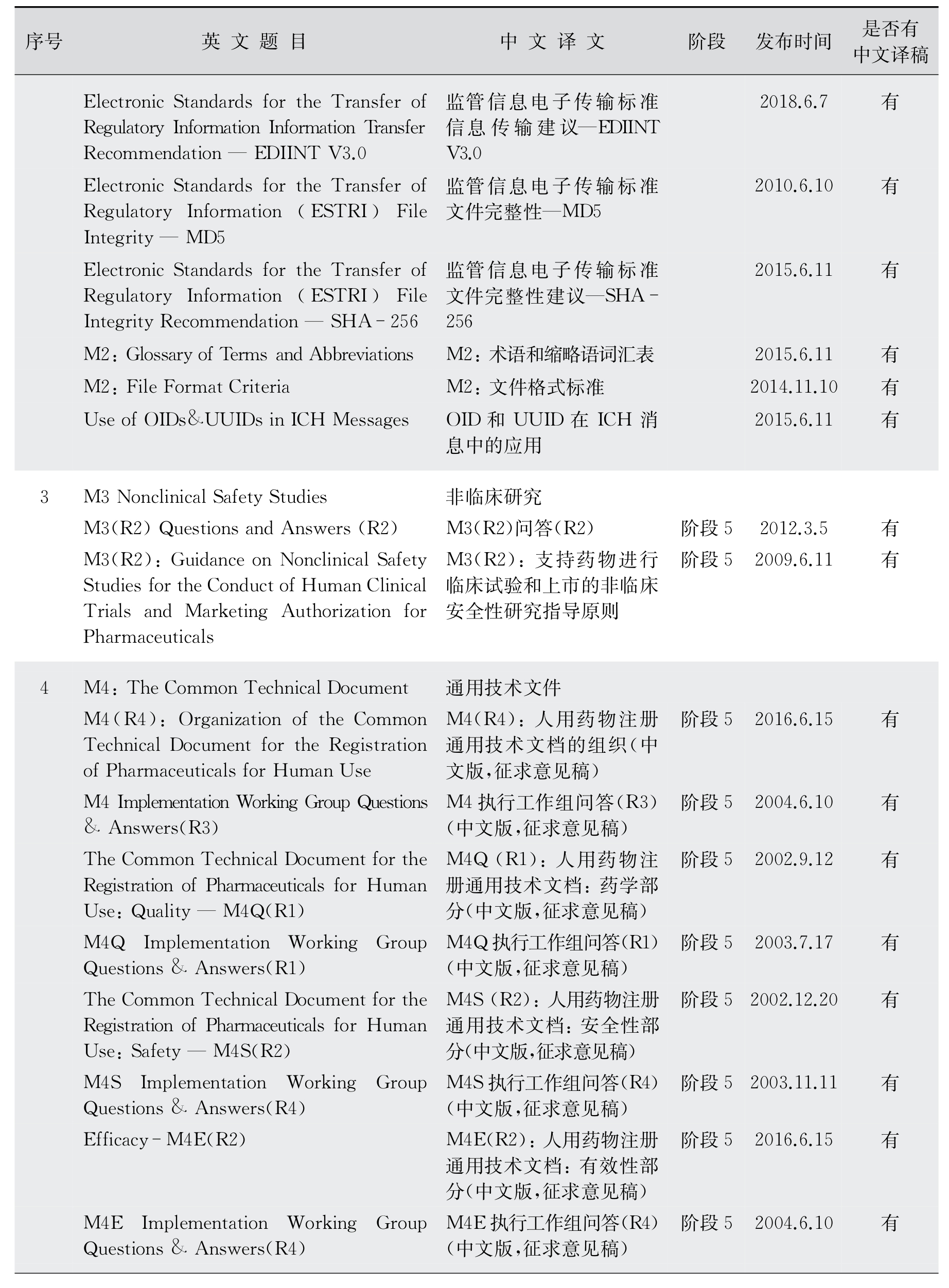
4.多学科(M)部分技术指导原则 ICH的多学科技术指导原则适用于所有人用药产品。在全球范围内,制定并及时更新医药法规系统统一使用的《药事管理的标准医学术语集》(MedDRA),也是ICH的重要工作之一。MedDRA在ICH网站上是公开的信息,每年更新2次(表12-7)。MedDRA适用于除动物毒理以外的所有药品研发阶段。从功能上,MedDRA不但用于药品的上市注册,也广泛用于药品的日常安全性测试、不良反应报告及上市后药品的安全性追踪监测。与之相关的《MedDRA术语选择:考虑要点》(Med DRA Points to Consider Documents,Med DRA PtC)是MedDRA工作组(point to consider working group,PtC WG)为方便用户,以符合MedDRA术语集规定的方式描述症状、体征和疾病编辑的文件,也可以从网站下载。
表12-7 多学科(Multidisciplinary Guidelines)包含内容
(续表)
(续表)

(续表)

(刘国梁 郑航)
