3.1.4 不饱和烃交联固化
1.烯类化合物交联固化
叠氮基团结构中的1、3氮原子带负电荷,其与不饱和烯烃双键易发生环加成反应,生成具有五元环结构的1,2,3-三唑啉,1,2,3-三唑啉热稳定性差,受热分解放出N2,进而生成氮丙啶类化合物。因此,叠氮基与不饱和烯烃双键反应时需在低温下进行,反应时间长,约两个星期。加热可加速叠氮基团与烯烃双键的反应速率。例如:石油醚中,降冰片烯和芳香叠氮化合物在60~90 ℃下回流3~4 h即可完成环加成反应[7]。
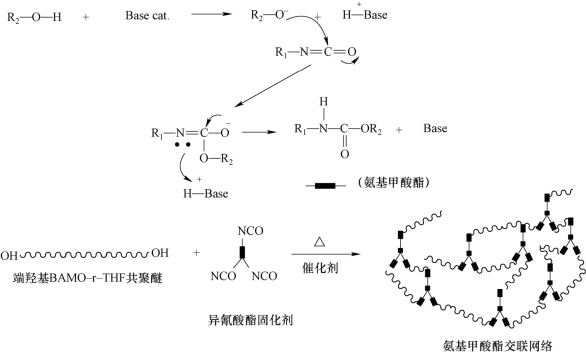
图3-2 BAMO-r-THF共聚醚端羟基与异氰酸酯催化反应交联示意图
BAMO-r-THF共聚醚分子链上含有许多侧挂的叠氮基团,其与双官能度烯类化合物反应即可形成化学交联网络,图3-3是双官能度2-甲基丙烯酸酯交联BAMO-r-THF共聚醚反应示意图。由于共聚醚中任一叠氮基均可与双键反应,叠氮基团可发生部分或全部交联,弹性体交联密度调节范围宽,赋予该交联弹性体较宽范围的力学性能[8]。
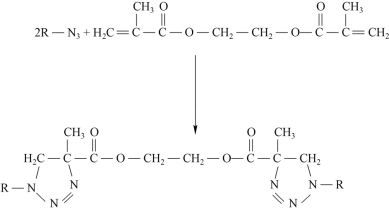
图3-3 叠氮基团与亲电化合物反应示意图
与聚氨酯反应体系相比,叠氮基与不饱和烯烃双键的反应不受水蒸气影响,可省去对反应原料的干燥处理。此外,由于该反应生成的三唑啉基团热稳定性差,其结构还可以提高推进剂燃速。通过叠氮基和丙烯酸、丙烯酸酯、丙烯酰胺类化合物的反应可制备高燃速叠氮聚醚推进剂[9]。
Varma等人[10]研究了叠氮聚醚和双马来酸亚胺、双衣康酸亚胺、桥-5-降冰片烯-2,3-二碳酰胺的反应。实验表明:40~60 ℃条件下,上述化合物与叠氮聚醚生成的交联弹性体柔性好,热稳定性也较高。可用于叠氮聚醚交联的烯类化合物还有:二亚甲基甘醇二丙烯酸酯、四乙烯基甘醇二丙烯酸酯、乙烯基甘醇二丙烯酸酯、己二醇二丙烯酸酯、季戊四醇三/四丙烯酸酯、己烷二醇二丙烯酸酯等多官能度丙烯酸类化合物,以及己烷二胺双丙烯酸胺,亚甲基双丙烯酰胺等丙烯酰胺类化合物。
2.炔基固化剂
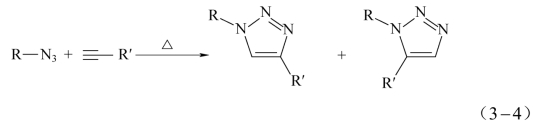
与叠氮基和烯烃双键生成三唑啉化合物不同,叠氮基与炔基反应可生成1,2,3-三唑化合物。1,2,3-三唑基团结构中三个氮原子和两个碳原子均以sp2杂化轨道进行共价键键接,形成平面五元环;垂直于平面五元环、含6个电子的5个p轨道离域形成大π键,分子结构呈高度芳香性,三唑基团具有较高的稳定性,如图3-4所示[11]。琥珀酸二丙炔酯、4,4′-二乙炔基联苯、1,4-二丙炔氧基苯等炔基化合物均可与叠氮基反应形成高热稳定性的三唑化合物。
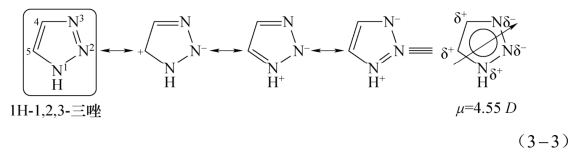
与常规苯环类芳香性化合物不同,1H-1,2,3-三唑分子结构中3个高电负性氮原子位于五元环一侧,使得五元环结构中的σ键骨架及离域π电子发生强烈极化[12]。密度泛函理论计算表明:1H-1,2,3-三唑化合物存在4种共振结构式,其叠加效应为五元环中N1、C4、C5位携带正电荷,而N2、N3位携带负电荷;1H-1,2,3-三唑呈现4.55 D(Debye)的高偶极矩(见式(3-3))[13]。
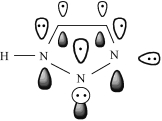
图3-4 1H-1,2,3-三唑分子轨道电子示意图
有关叠氮基与炔基的反应研究可追溯到19世纪末。1893年,Michael等[14]报道了非催化条件下叠氮化合物与炔基化合物的环加成反应,由于该反应产率极低,没有应用价值。1910年,Dimroth和Fester将HN3与乙炔的丙酮溶液进行反应,100 ℃下反应70 h可得到环加成产物[15]。Sheehan和Hartzel等以苯为溶剂,将上述反应在密闭容器内,90~135 ℃下反应29~48 h,产物收率达30%~60%[16]。1963年Huisgen提出有机叠氮化合物和端炔烃之间的环加成机制属于1,3-偶极环加成反应,该反应活化能高,需在高温、高压条件下进行,且所得产物为1,4-二取代三唑和1,5-二取代三唑的混合物,反应方程式见式(3-4)[17]。上述研究结论是在叠氮基团与炔基基团等当量条件下反应获得的。
当少量多官能度炔基化合物与叠氮聚醚混合时,叠氮基团浓度远高于炔基基团,可加速炔基与叠氮基的反应进程,形成无规三维交联网络结构。该反应在0~90 ℃内均可进行,最佳反应温度为25~40 ℃。在低温或增塑条件下时,上述固化反应速率较慢[18,19]。二官能度炔基固化剂与叠氮聚醚聚合物反应形成交联网络结构示意图,如图3-5所示。可以看出,该反应形成的交联网络属于无规交联。
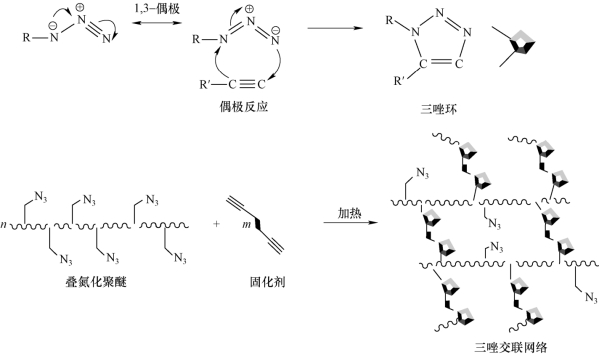
图3-5 二官能度炔基固化剂交联叠氮聚醚示意图
3.点击化学交联
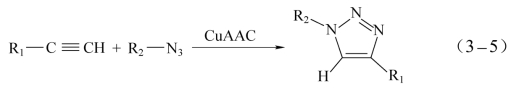
虽然叠氮基或炔基组分之一官能团过量条件下,可促使三唑反应进行,但由于叠氮基与炔基高反应活化能,很长时间内抑制了其实际应用价值。2002年,丹麦化学家Meldal[20]和美国化学家Sharpless[21]团队分别独自发现:溶液中,室温、亚铜离子(CuI)催化作用下等摩尔比端炔基/叠氮基可迅速进行Huisgen环加成反应,生成具有空间选择性的1,4-二取代1,2,3-三唑化合物。该反应被Sharpless称为CuAAC点击化学反应,见式(3-5)。点击化学作为目前最吸引人的化学反应之一,已经渗透到了诸多应用领域,如生命、高分子化学、功能材料、蛋白质组学、生物偶联技术和生物医药等[21]。
针对亚铜离子对端炔基/叠氮基反应展现的优异催化能力,Script课题组采用密度泛函理论和反应动力学测试对CuAAC反应机理进行了详细研究[22-27],结果表明,亚铜离子空轨道是CuAAC反应的关键活性点,端炔基结构中的π键与亚铜空轨道络合后,炔基端位活泼氢的pKa值较未络合时下降9.8个单位;即使在酸性条件下,此时以π键与亚铜空轨道络合的端炔基也能够通过端位脱氢过程形成以σ键配位的端炔基/亚铜络合中间体。动力学测试表明,亚铜催化剂对CuAAC反应速率的影响与其浓度有关。低浓度时,亚铜催化剂浓度与CuAAC反应速率成二级反应关系;高浓度时,催化剂易形成低活性的亚铜离子聚集体,此时催化剂浓度与CuAAC速率成零级反应关系。综合密度泛函和反应动力学研究结果,Finn提出了双金属催化反应机理:炔基首先与双金属催化剂中的一个亚铜离子空轨道进行络合;随后,叠氮基再与该催化剂中的另外一个亚铜离子空轨道作用,所得中间体通过环化反应生成三唑目标产物,其反应历程如图3-6所示。
利用BAMO-r-THF共聚醚端羟基与异氰酸酯反应形成聚氨酯末端交联弹性体时,由于异氰酸酯对H2O敏感、有副反应、反应条件苛刻等不足[32],导致弹性体微观网络结构缺陷,偏离理论预测性能。借助BAMO-r-THF共聚醚分子链上的叠氮基与炔基反应则可避免上述情况发生。近来,利用叠氮基与炔基间的环加成反应也成为制备BAMO-r-THF共聚醚弹性体研究的热点。
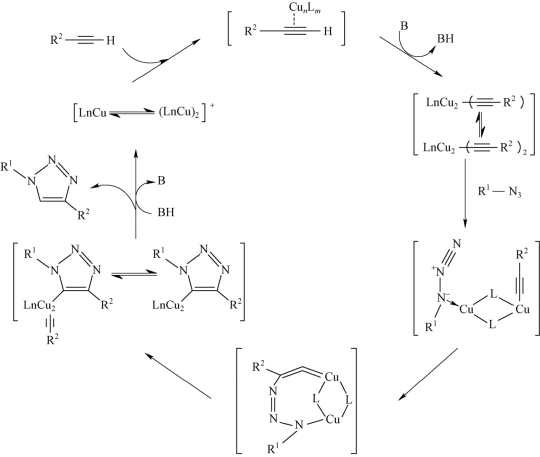
图3-6 双金属离子催化CuAAC反应历程[28-31]
