药物临床试验的类型
(一)对照试验(controI triaI)
临床治疗中所获得的疗效可能由药物引起,也可能是由于非药物因素如休息、疾病或症状自愈等因素引起。临床试验的目的是评价某种药物或治疗措施的疗效,因此,必须设立对照组。治疗组的患者接受研究药物,而对照组的患者接受安慰剂或另外一种已经开始上市的药物。对照药物的选择分为阳性对照药(即有活性的药物)和阴性对照药(即安慰剂)。新药为注册申请进行临床试验,阳性对照药原则上应选同类药物中公认的最好品种。新药上市后为了证实对某种疾病具有优于其他药物的优势,可选择特定的适应证,并选择对这种适应证公认最有效的药物(可以是与研究药物不同结构类型、不同家族,但具有类似作用的药物)作为对照。对照研究的最高原则是组间一致原则,即治疗组与对照组在受试者的一般情况、试验因素、试验条件、操作、干预时间等方面的一致性。一致性越高,越具有可比性。随机双盲对照临床试验是临床研究的金标准。主要的对照类型有安慰剂对照、阳性(即有活性的药物)对照、历史性对照、空白对照。
1.安慰剂对照(placebo control) 安慰剂是没有生物活性、没有治疗作用的片剂、液体或粉末。但是其外观、大小、颜色、剂型、重量、味道和气味等物理特征都要尽可能与研究药物相同。安慰剂常用于安慰剂对照的临床试验,研究药物要和安慰剂进行比较,以评价其疗效,这时对照组就会使用安慰剂。对于在什么情况下允许使用安慰剂做对照组,要从伦理学的角度进行分析。一般情况下急症、重症、感染性疾病或有严重器质性病变的患者,不能用安慰剂作对照。但对于轻症或功能性疾病的患者,尤其是如果研究药物作用较弱,而且受试者是一般轻、中度功能性疾病的患者时,为确定药物本身是否有肯定的治疗作用,宜选择安慰剂作为对照。只有证实研究药物显著优于安慰剂对照组时,才能确认药物本身的药效。但是如果不使用安慰剂对照,无论观察到的疗效有多好,也很难说研究药物是否真的有效。对照的意义在于给出观察指标变动的对比值以及消除偏倚的影响。
在镇痛药、抗抑郁药、抗失眠药、抗焦虑药的试验中,尤其应该考虑到安慰剂效应(placebo effect)。安慰剂效应于1955年由Henry K.Beecher提出(Beecher,1955),也就是非特定效应(non-specific effects)或受试者期望效应(subject-expectancy effect)。许多临床试验结果显示,安慰剂效应所产生的效果甚至可以达到治疗组药物疗效,比如有研究发现服用抗抑郁药物的治疗组中出现自杀或者企图自杀的下降40%,而服用安慰剂的对照组中出现自杀或者企图自杀的情况也可以下降达30%(Khan,et al.,2000)。因为尽管在试验中安慰剂本身并无药理效应,但是由于受试者自身的心理暗示作用,以及受到的很多照顾,包括频繁的探视、良好的医疗护理、各项检查等,使得他们一般状态好转,自觉病情改善,虽然事实上他们只是接受了安慰剂治疗。大量的研究表明现有疾病对于安慰剂也的确有一些反应,包括降低血压,缓解术后疼痛,减轻焦虑、沮丧、恐惧和精神分裂等症状。我们必须知道这是一种真实存在的现象,并且认识到安慰剂对临床试验有着重要的影响。安慰剂效应不但在安慰剂对照组中产生影响,有时试验中没有接受安慰剂治疗的受试者也会受到安慰剂效应的影响。因为试验中所有的受试者,无论是治疗组或在安慰剂对照组,都受到了同样的关注和医疗护理包括较多的诊疗、探望、照顾。因此,接受真实治疗和接受安慰剂治疗的受试者都体验到了安慰剂效果。
在临床试验中使用安慰剂对照意味着治疗组使用活性药物而对照组使用安慰剂,以便两组结果进行比较。试验中使用安慰剂有助于控制心理暗示作用和使用活性药物产生的副作用带来的影响。有时试验中会设计安慰剂导入期(placebo run-in period),以排除那些易受安慰剂影响的受试者。也就是说,在用药前,先设定一个导入期,每一位受试者均服用安慰剂治疗(2周),然后对受试者再做一次检测。那些症状有明显改善的,就会被排除在外,而未受到安慰剂影响的受试者进入真正的治疗期。此导入期的目的是排除安慰剂对研究药物的影响,从而使研究药物的作用可以更准确地反映出来(范大超,2009)。
此外,安慰剂导入期也可用于排除依从性较差的受试者。在治疗周期较长的试验中(如1年),有时会设置安慰剂导入期(如1个月),那些不能按时回访和依从性较差的受试者就会被剔除,从而使那些依从性较好的受试者进入试验,以降低失访率。
安慰剂也可用在叠加(add-on)试验中。例如,假设我们的试验用药品是A药,对照组是安慰剂,而受试者在试验前一直在服用B药,且由于伦理学的原因不能停用该药。因此,在受试者继续服用B药的前提下,药物随机分配后分别进入B+A组或B+安慰剂组,但是这个设计首先要排除A+B的交互作用如协同作用。否则这个试验设计的正确性会被质疑。此外,在原有的治疗方案基础上,一组加用研究药物,对照组加用安慰剂,安慰剂可用于阳性药物对照试验中。为了保证双盲试验的执行,常采用双模拟技巧,受试药和阳性对照药都制作了安慰剂以利于设盲。
2.阳性对照(active control) 在一些从伦理学角度考虑不能使用安慰剂的病例中,研究药物必须同另外一种有活性的化合物进行比较,这种研究方法称为阳性对照研究。作为对照组的阳性对照药物,必须是治疗药物中,对于所研究的疾病,疗效是公认最好的药物,一般是与所研究新药性质相同的药物。如果选择不是疗效最好的药物作对照组,既不合理,更不会被药监局接受。阳性对照主要可分两种类型,即平行对照试验与交叉对照试验。
3.平行对照(parallel control) 设试验组与对照组,将病情相同的受试者分为两组:试验组与对照组以1∶1配对,也可以是2∶1配对(试验药两组,对照药一组),或者是3∶1配对(试验药三组,对照药一组),甚至于3∶1组以上。也可以设对照药一组,试验药则以不同剂量或不同给药途径分为两组或三组以上。这是在临床试验中最普遍、最直接的统计学设计。在这样的设计中,每一个受试者进入一个治疗组或者是对照组,所有的受试者按照同样试验进度,参与试验所要求的体格检查、实验室检查和相关的疗效和安全性评估,以便试验完成时在各个组之间进行比较分析。这里可以通过图来表示常见的几种设计,平行试验如图1-2、图1-3。
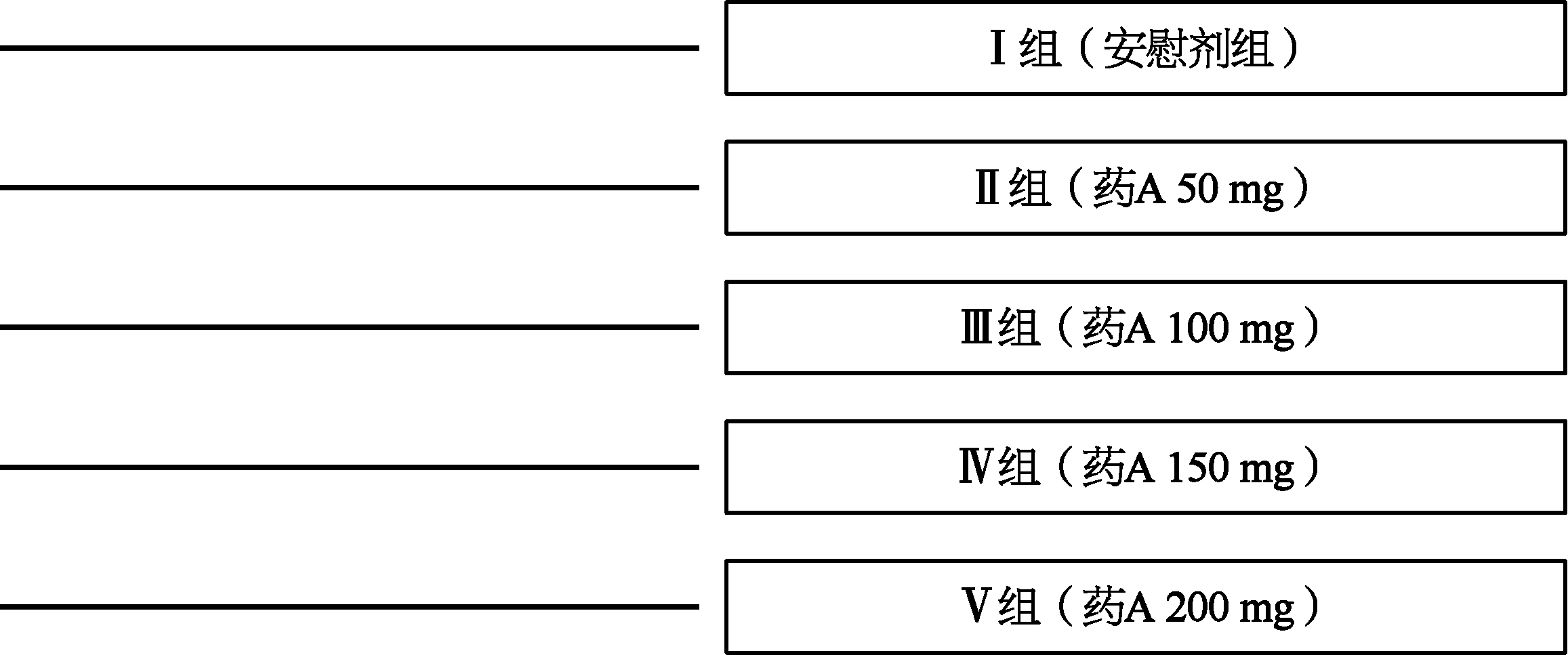
图1-2 平行对照试验分组示意图
注:药A各剂量组为平行试验组
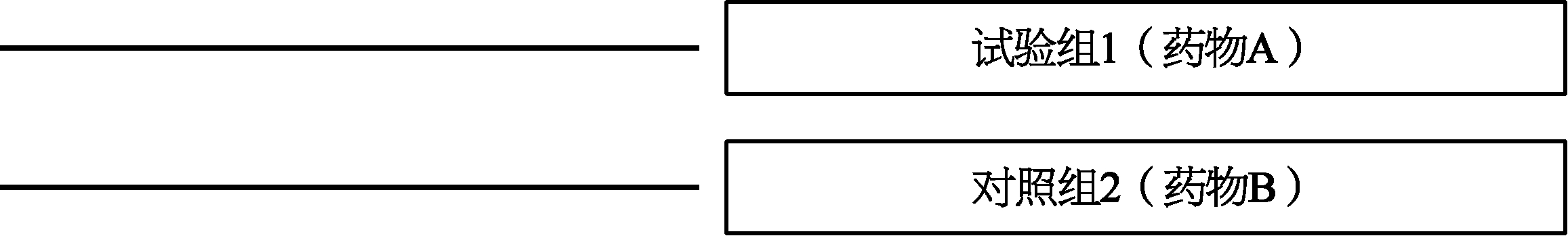
图1-3 平行对照试验分组示意图
注:药物A与药物B为平行试验组
4.交叉对照(crossover control) 两组受试者使用两种不同的治疗措施,然后相互交换用药,最后比较试验结果。整个试验设计分为两个阶段,先将受试者随机分为Ⅰ、Ⅱ两组。第一阶段:Ⅰ组接受A药,Ⅱ组接受B药。此阶段结束后,两组受试者均停药一段时间进行洗脱。之后再进入第二个阶段,对换治疗用药,即Ⅰ组接受B药,Ⅱ组接受A药。各组试验用药的顺序通过随机化方法确定,如图1-4。
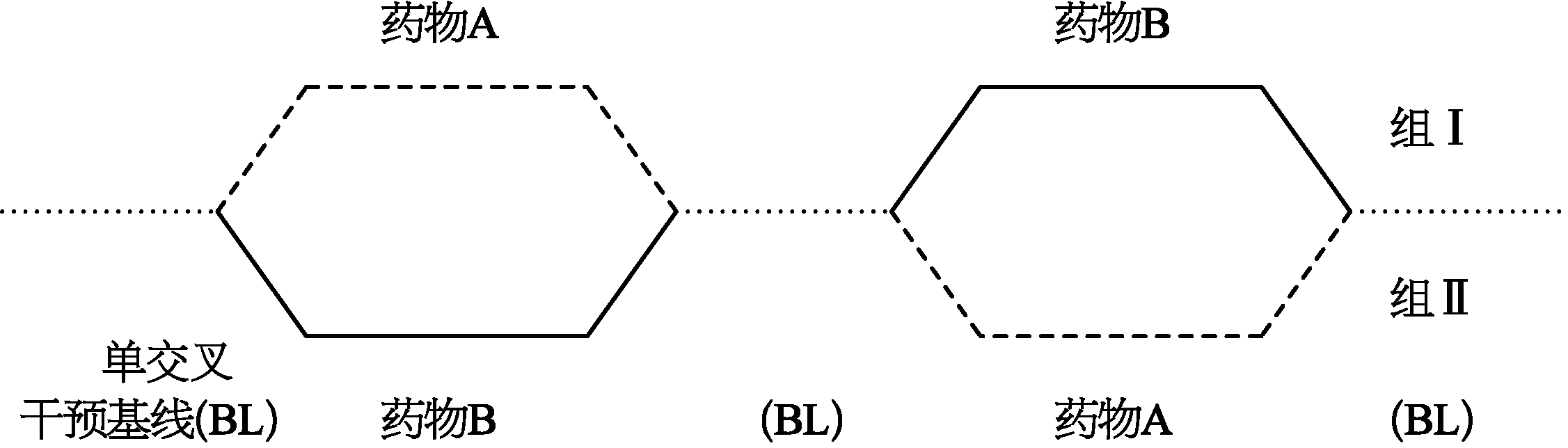
图1-4 交叉设计示意图
每组都有机会接受A药和B药,在试验的第一个阶段,有点类似平行设计,但是在第二个阶段,该组要使用对照组的药物。每一组既要同自己比较,也就是第一阶段和第二阶段比较,同时还要和对照组比较。最简单的交叉设计如图1-4。交叉设计同平行设计相比可变性减少了。然而,许多药物在停药后有遗留效应或后遗效应,因此在第一阶段和第二阶段之间,要设计一个洗脱期(washout period),这个洗脱期的长短,应该按照研究药物的半衰期,同时考虑到研究药物的适应证。一般而言,可以参考第一阶段所用药物的半衰期,洗脱期以5~7个半衰期为停药时间,然后开始第二阶段用药治疗,目的是排除第一阶段的药物的遗留效应或后遗效应,其作用不至于影响第二阶段疗效和安全性的观察。
此外,在设计交叉试验时,受试者在两个治疗阶段之间,让病情恢复到第一阶段治疗前基线,以保证进入第二阶段之前,两组患者的病情均与进入第一阶段时相同,这样两个治疗期开始前的基线是一致的。如果两个基线值不一致,第一阶段和第二阶段就不具有可比性。不但基线值要一致,而且不能有遗留效应或后遗效应。交叉对照的优点是每例受试者先后接受试验组或对照组的治疗,不仅有组间对照,而且有自身前后对照,降低了两组的变异度,受各种干扰因素和偏倚作用的影响很小,可以提高评价疗效的效率,且需要受试者的数量较少。缺点是应用病种范围受限,对于各种急性重症疾患或不能恢复到第一阶段治疗前状况的疾病(如心肌梗死),及那些不可停止治疗让病情回到第一阶段的疾病(如心力衰竭)等,都不能采用交叉对照试验。
5.历史对照(historical control) 有时在临床试验中也采用历史性对照研究。历史性对照是一种非随机、非同期的对照研究方法。此型对照是一组受试者(试验组)接受新疗法,将其疗效与以前的某个时间用某种方法治疗的同类型受试者的疗效加以比较。可分为两类:一类是以受试者本身既往的数据作为对照(没有接受治疗的、接受过相同或不同治疗的数据)。另一类是以既往其他病例的数据作为对照进行比较(没有接受治疗的、接受过相同或不同治疗的数据)。这类研究对于肿瘤这类自然病程非常清楚,没有有效治疗方法的疾病更为合适。试验是将一般人群中没有接受治疗的同一肿瘤患者与接受治疗的受试者作为对照进行死亡率的比较。例如,如果在一段特定时间内某一肿瘤未接受治疗的患者的死亡率是55%,而同一时间段内同一肿瘤类型接受治疗后患者的死亡率是25%,这就显示出使用研究药物和没有使用药物有着明显的不同。历史对照的优点是易为受试者接受,也符合伦理学要求,省钱、省时间。缺点是特别容易产生偏倚,不能保证两组患者的病情和所试验的药物以外其他因素是否具有可比性,亦不能排除目前所观察到的疗效实际上是由于其他因素所造成的。
6.空白对照(blank control) 此外,还有一种空白对照研究,即治疗组使用研究药物,而对照组不采取治疗措施的研究。但在新药临床试验中,极少采用这种研究方法。有时安慰剂对照和阳性对照可在同一个试验中同时使用(把受试者分成三个治疗组)。这就允许试验用药物可以同安慰剂做比较也可以同阳性对照做比较,以减少前面谈到的安慰剂效应。一般来说,应该有更多的受试者接受活性药物治疗而不是安慰剂治疗。如果入选的受试者被随机分配到三个治疗组中,就有2/3的患者接受活性药物治疗而1/3的患者接受安慰剂治疗。既然大多数的受试者都愿意接受活性药物治疗,那么这个对照设计也能够使研究更加吸引受试者的参加。(https://www.daowen.com)
(二)盲法原则(type of bIinds)
按照GCP2020版第二章第十一条(三十八)设盲,“指临床试验中使一方或者多方不知道受试者治疗分配的程序。单盲一般指受试者不知道,双盲一般指受试者、研究者、监查员以及数据分析人员均不知道治疗分配”。设盲目的是为了消除临床试验中主观因素所导致的偏倚,这种主观影响可以来自研究者,也可以来自受试者或者是其他参与试验的工作人员。盲法设计又可以分为单盲法、双盲法、三盲法,也可以进一步分为混合性盲法、双盲双模拟法及开放性试验。
1.单盲法(single blind) 单盲法试验是指研究者及试验人员不设盲,受试者设盲,受试者不知道自己接受的是哪一种药物和分组,不知道接受的是试验组还是对照组。单盲法由于研究者及试验人员不设盲,因而不能排除研究者及试验人员的主观偏倚(bias)。有时采用双盲法在技术上有一定的操作困难,而又必须使数据具有一定的说服力,这时通常可以采用单盲法。
2.双盲法(double blind) 研究者和受试者设盲,研究者和受试者都不知道受试者接受的是哪一种药物和分组。治疗药物与安慰剂或对照药物应大小、形状、颜色均一致。这样能充分保证研究结果不受研究者和受试者心理因素的影响。大多数的试验采用双盲法。如果在整个试验过程中盲法没有被破坏、方案的执行没有严重的偏差(deviation)、把握度(power)足够、受试者的依从性也较好的话,其数据将会有较强的说服力。
3.三盲法(triple blind) 是研究者、受试者及其他试验人员(药剂师、监查员或统计分析师)均设盲。三盲法的目的是为了更好贯彻执行双盲法,任何与研究者和受试者有接触的试验人员,比如监查员或统计分析师、药剂师或其他药品包装人员都应该设盲,从而避免这些人员对试验产生影响,避免干扰,确认双盲的有效性。如果一个试验采用双盲法,应该在临床试验之前、试验中,以及试验结束直到揭盲之前,都应始终保持盲法的有效性。
4.混合性盲法(combination of blind) 试验分两个阶段,第一阶段采用单盲、第二阶段采用双盲。或者盲态在试验过程中有所改变,比如在治疗期采用双盲;进入随访后,采用开放试验,可见于一些抗肿瘤药物的试验。
5.双盲双模拟法(double-dummy) 双盲双模拟法用于A与B两种药的外观(片剂与鼻喷剂)或气味均不相同又无法改变时,可制备两种外观或气味分别与A或B相同的安慰剂,分组服药时,服A药组加服B药安慰剂,服B药组加服A药安慰剂,每组受试者均分别服用一种药物和另一种药物的安慰剂两种药,且外观与气味完全一样,这样研究者和受试者均无法区别。
6.揭盲(unblinding) 有时在治疗组与对照组中,由于不良反应发生率的不同,或者疗效不佳,或者试验室检查的数据改变,或药物本身的特性,双盲会在不自主的情况下被揭盲。例如某些会使尿液变成橘红色的药物,在临床试验中,就会被受试者发现,从而得知自己是在治疗组或对照组。因此,在制定盲法设计时,这些因素必须纳入考虑。曾经有这样一个试验,在关节腔中注射一种药物,对照组采用生理盐水,在整个试验的设计过程当中,在送伦理委员会审查及药监局的审查当中,都认为可行,但是在临床试验中有护士报告,在注射时,手感可以感觉生理盐水与研究药物的不同,事实上这个试验的双盲已经被破坏了。
7.开放试验(open label) 受试者和研究者都知道受试者接受的是哪一种药物。临床试验的最高准则是随机的对照试验,但是在有些情况下,也会采用开放性对照试验,开放性试验多见于晚期抗肿瘤药的新药试验,药代动力学试验,剂量范围探索的试验,受试者为疾病晚期、危重或昏迷状态的试验,治疗周期较长的Ⅱ、Ⅲ期临床试验,上市后考察药物长期使用的安全性和耐受性的试验,以及一些从伦理学角度不适合设盲的试验。
(三)随机化(randomization)
临床对照试验中各组病例的分配必须实行随机化。随机化是指将病例分配进入试验药组或对照药组不以人们的意志为转移,完全按照随机编排的序号入组。其目的为排除分配误差,使病例或试验对象均匀分配到各试验组(随机化的方法详见第九章临床试验的统计学原理简介)。
新药研发中临床试验依照不同的特性、是否设对照组、是否随机、是否盲法对临床试验进行分类。如果按照参加试验的中心分类,新药临床试验分为单中心试验、多中心试验、本国试验或国际多国多中心试验。
如果依据临床试验的目的,则可以分为以下几类:①以观察药物疗效为主要目的,主要为Ⅱ期和Ⅲ期临床试验。②评估药物安全性的试验,对于几乎所有的临床试验,安全性都是必不可少的观察项目,但是把安全性作为主要试验目的的试验,多见于Ⅰ期和Ⅵ期的临床试验,Ⅰ期临床试验主要在于决定研究药物对于健康受试者临床耐受性的剂量范围,以及观察不良反应、体征或生命指数的变化。Ⅵ期临床试验在新药上市后大规模人群中评价安全性。③药代动力学参数的评估试验。④新检查方法评估的试验,比如新型的造影剂需要临床试验的验证。⑤新剂型的临床试验。⑥新给药途径的临床试验。⑦评价医疗器械受试产品是否具有预期的安全性和有效性,如血糖仪、测氧仪。
