通用技术文件格式
2026年01月16日
四、
通用
技术文件
格式

随着国家食品药品监督管理总局于2017年加入ICH组织,并且当选为管理委员会成员,我国也要求提交资料符合CTD(common technical document)格式。CTD格式的资料要求实现了药品研发技术内容与记录资料形式的完美统一。CTD格式资料包的结构如图12-1。
CTD格式的资料要求分为五个模块,为一个三层结构。最上层是模块1,适用于各种行政性、管理性和综合性技术文件,各个国家可以规定各自的模块1要求。模块2、3、4、5是CTD的正式的通用技术文件。模块2是模块3、模块4和模块5的总结性文件,内容不得超出模块3至模块5。模块3是生产和质量控制的具体文件。模块4是已经完成非临床研究报告,需要将完成的报告归类到具体的类别中,比如毒性研究、非临床药理研究、药效学研究等。模块5是已经完成的临床研究报告,也需要按照类别进行归类。CTD对整个文件的结构和具体格式要求都有比较翔实的规定,撰写CTD格式的文件应符合相关章节的具体要求和格式。
eCTD是在CTD格式的基础上按照一定的要求整理为电子版提交资料,通过网上平台进行提交,避免纸质提交文件的繁琐和巨大的审评工作量,包括了交叉索引、超链接、书签等功能,最大限度地方便审评人员的审查和存档工作。西方发达国家已经实施eCTD多年,我国因起步较晚,目前仍在实施纸质版的CTD提交资料,正在探索eCTD提交的模式和具体要求。ICH的多学科章节有对eCTD的一些术语和要求做非常详细的介绍。
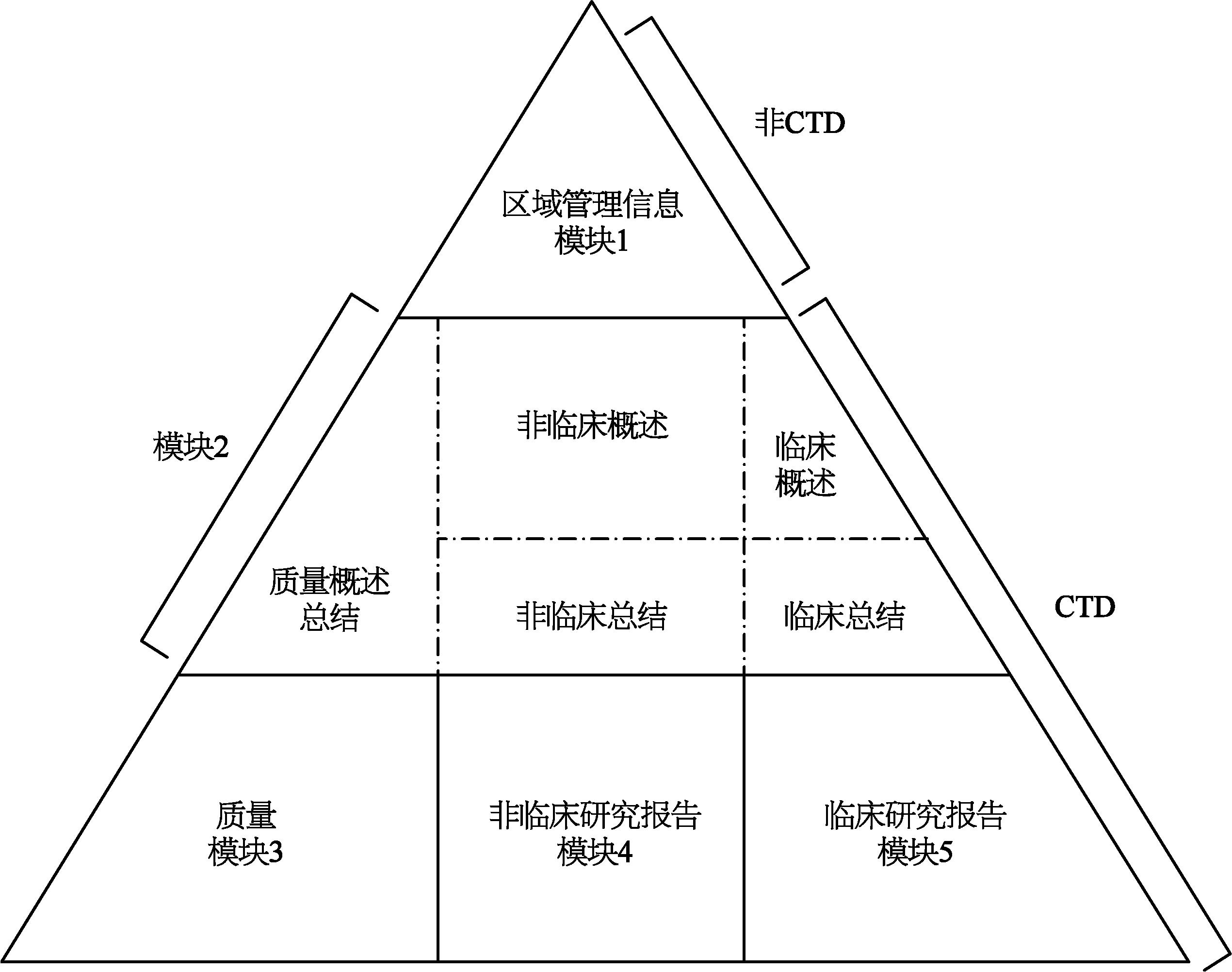
图12-1 CTD格式资料包结构
