二、进度管理
在一个项目的生命周期中,项目经理需要对项目进度进行把控,让项目在项目生命周期的每个节点达到预定的目标。时间就是金钱,自承接一个项目的那一刻开始,项目经理就开始不断追赶进度。项目进度的管理分为项目计划、项目启动、项目实施和项目结束几个部分,项目控制贯穿项目生命周期的始终。
(一)项目计划
在项目开始之前,项目经理同公司管理层确定项目的总体计划。这个计划包括财务预算、团队组成、项目完成的时间等。“兵马未动,粮草先行”,项目经理需要规划从项目开始到结束总共需要的人力、物力和资金,这样可以避免在中途出现人员不足或资金不足的情况。对于新药的临床试验,还需要特别关注药品供应的问题。因为新药的产量往往有限,临床试验的规模需要与新药的生产能力相匹配。不要认为,只要资金充足就能解决所有问题,临床试验中的许多问题不是钱能够解决的。在项目计划之初,应该对此要有全盘和周密的考虑。项目经理根据项目操作的实际需求,准确预计项目完成的总体时间以及到达项目生命周期中每个节点所需要的时间。公司管理层根据项目经理的进度计划,预计产品上市的时间,协调药品生产、质控、注册、医学、市场、销售等部门进行分工协作,在产品上市之前就开始进行市场推广的铺垫活动,为药品上市后的市场推广和销售奠定基础。
(二)项目启动
临床试验的项目启动会(kick-off meeting)是项目正式启动的标志性事件。这个会由项目经理,各协作部门的经理,如医学监查部门、药物警戒部门、数据管理部门、统计分析部门、中心实验室、药品供应部门等参加,同时公司的领导层也会根据情况出席会议。监查员一般不用参加项目启动会。这个会议的目的是宣布项目的总体计划,同时确认各方有关项目的人员设备和物资已经齐备,明确各个职能部门的责任,可以启动项目了。如果项目是由申办方外包给CRO公司进行,启动会的时间需要事先与申办方确认,因为项目一旦启动,就会产生相关的费用。如果开完启动会后发现某些开展项目的必须条件尚不具备,就会产生不必要的花费。但有时申办方为了加快进度,可以接受这些额外的花费,那就是例外的情况了。此外,每一家医院试验开始也有一个启动会,正式的名称是医院第一次访视(site initiation visit,SIV)。
在项目启动会以后,便进入了项目启动阶段。这个阶段是指从项目启动到各个医院启动的阶段,从时间上看就是从项目启动会到第一家医院启动之间的时间。有些公司成立专门的团队来负责这方面的工作,叫做研究启动团队(study start up,SSU)。在这个时间段,项目经理需要完成以下工作。
(1)项目启动后即开始可行性调查(feasibility study,FS)。有时可行性调查会同研究者的筛选合并到一起。通过可行性调查和对研究者的筛选,确定邀请哪些研究者参加这个临床试验项目。这个过程需要的时间需要项目经理根据项目经验来确定。有时候为了缩短项目的总时间,一些可行性调查工作可以在启动会之前开始。对于既往合作良好的研究者,也可以简化筛选的过程。
(2)在确定参加临床试验项目的研究者后,进行伦理委员会的审批。项目经理根据各中心伦理委员会的要求,准备各种伦理递交资料,在计划的时间内获得伦理委员会的批件。项目经理应该对伦理委员会批准的时间进行预估,所以需要了解伦理委员会开会的时间和日期,是每月1次,还是2个月1次,同时应该考虑到需要2次或2次以上的审查会议才能够获得伦理的批准。有的医院要求牵头单位的伦理委员会批准以后,才开始本医院的伦理审批,有些医院在伦理审批以前还要经过医院临床试验机构的审批。项目经理应该考虑到这些时间的花费,对项目的进度进行管理和控制。
(3)在获得伦理委员会批准以后,如果是涉外企业或CRO公司,还需要获得中国人类遗传资源管理办公室的批件,一般也需要2~4个月的时间才能获得批准。项目经理需要对这个时间做出计划。
(4)在获得人类遗传资源管理办公室的批件以后,进入与各医院签署合同的阶段。对于合同的金额、责任等各种细节问题,往往每个医院都有自己的特殊要求,需要在医院和申办方之间协商多次,同时需要双方法务部门的参与。项目经理对于这个时间的估计不宜过于乐观。
(5)与医院签署合同以后,组织研究者会议。通过研究者会议对参与临床试验的研究者进行项目相关的培训。当各医院的临床试验必须在文件审核备齐以后,就可以预约开启动会了。
虽然在项目启动期间,伦理递交、遗传办递交、合同签署等工作可以交叉进行,但一般还是需要6个月左右的时间。有的项目或医院需要的时间更长。在项目的进度管理中,项目经理需要计划并按照计划完成每一个节点的任务,如开项目启动会的时间、确定研究者名单的时间、第一家和最后一家伦理批准的时间、第一家和最后一家遗传办批准的时间、第一家和最后一家合同签署的时间等。
项目在各个医院的启动,是以各医院的启动会(医院第一次访视,site initiation visit,SIV)为标志。各医院启动前需要对临床试验的一些必要文件进行核实,项目经理确认该医院已经具备开展临床试验的必要条件以后才能批准启动会。一般是在启动会后,临床试验的药品才会送达医院。启动会后,一般会要求研究者立刻开始受试者的筛选,同时项目经理会规定各医院在启动会后完成第一例患者入组的时间。同时,项目经理一般会要求监查员在第一例患者入组后的2周内进行第一次的监查。尽快启动、尽快供应研究用药品、尽快开展第一次监查是进度控制的关键要素。
(三)项目实施
1.入组时间 项目经理将从第一例入组到最后一例的入组的时间定为整个项目的入组时间。入组时间往往是项目进度管理中最难把握的时间,因为这个时间受众多因素的影响,如与入组需要的时间与方案规定的适应证、入选和排除标准、病例数量和医院数量等因素有关。项目经理可以采取适当措施对入组的总时间进行调节。例如,入组的速度同入组难度成反比,但同医院数量成正比。增加医院数量会缩短入组的时间,但增加医院数量又会显著增加研究的费用,同时增加质量控制方面的难度。因此,在项目开始之初,项目经理需要对各种风险进行评估,在此基础上,计划最后一例患者入组的时间。入组时间需要在项目进展过程中不断进行调节,如果发现实际入组时间比计划入组时间长,应该对入组的策略进行及时的调整。但也可能会出现实际入组时间比计划入组时间短的情况,这种情况下,项目经理应该分析入组过快的原因,保证入组患者质量,甚至采取措施控制入组速度。
2.治疗时间 从最后一例受试者入组,到最后一例受试者出组,是一个受试者完成整个用药和观察的时间,通常称为治疗时间。这个时间是根据方案来确定的。但是对于肿瘤的临床试验而言,每个患者所经历的化疗周期可能不一样,患者生存期也不一样,所以治疗时间也会不一样。项目经理根据自己的经验确定治疗期的平均时间,从而估计出项目结束的时间。在估计结束时间的时候,同时注意不要忽略安全性随访和生存期随访需要的时间。
3.中期分析 有的研究会进行中期分析,一般对项目的整体进度不构成影响。但是如果中期分析因为统计学问题对总病例数进行了调整,就会影响到项目的总体进度。这一点在制定项目计划的时候应该考虑到。
(四)项目结束
在最后一例受试者完成临床试验以后,进入数据库锁定和关闭试验场所的阶段。项目经理同数据管理部门协商数据锁定所需要的时间,同时计划出关闭试验场所所需要的时间。这个时间的长短需要监查员、研究者和数据管理人员的密切配合。监查员需要督促研究者及时完成对所有数据疑问的解答。
图5-4显示了临床试验的结束阶段大致所需要经历的时间段,假设在2021年8月锁定数据库,为什么需要5个月整个试验才算完全结束呢?因为在数据库锁定以后,进入统计分析和临床试验总结报告阶段。在研究开始之前,项目经理同统计部门和医学写作部门确认统计和总结报告的撰写需要的时间。对于一个临床试验项目来说,总结报告的完成才是临床试验项目的结束。这个时间的长短根据试验的复杂程度不同而有长有短。
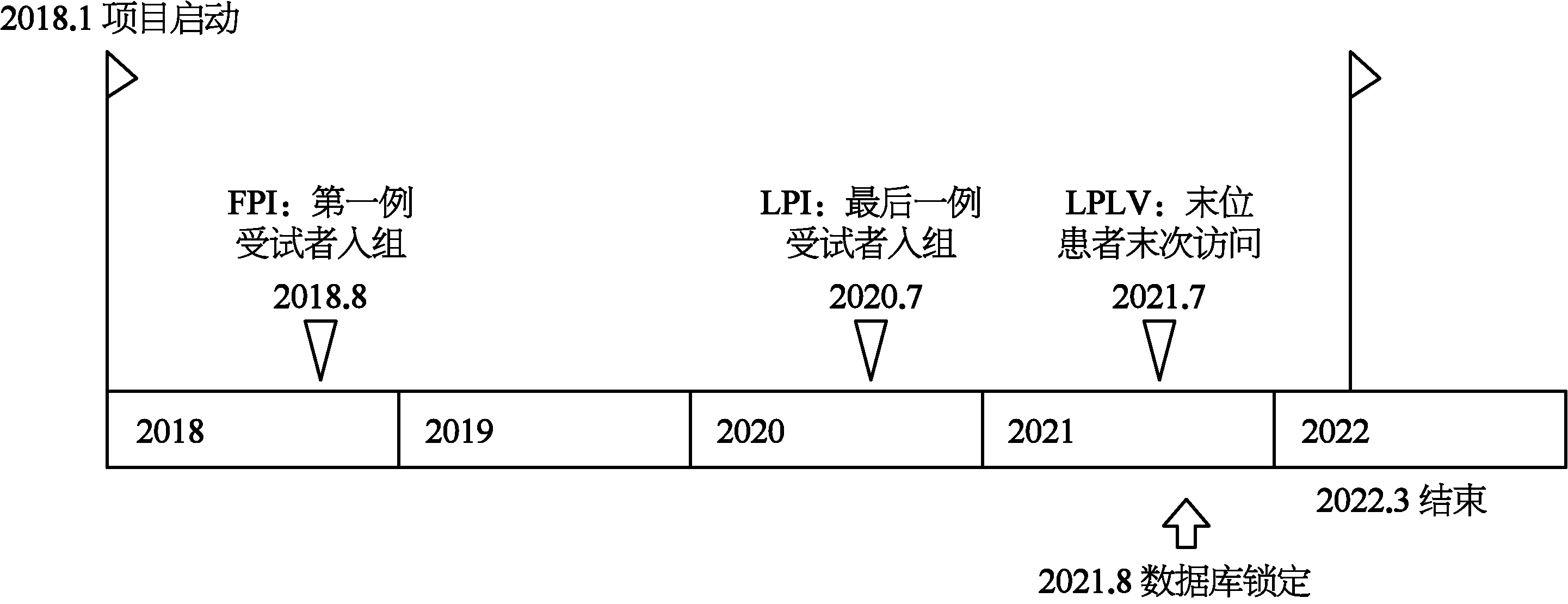
图5-4 临床试验的结束阶段
项目经理在项目的规划阶段,对每个时间点安排计划。在实施阶段,对每个时间点事件进行跟进,采取措施,确保项目在每个时间点都能达成预定目标,并按照计划的时间点完成,需要项目经理具有成熟的项目管理经验和能力。
此外,按照GCP2020版第四章第二十八条,研究者应当提供试验进展报告:“(一)研究者应当向伦理委员会提交临床试验的年度报告,或者应当按照伦理委员会的要求提供进展报告。(二)出现可能显著影响临床试验的实施或者增加受试者风险的情况,研究者应当尽快向申办者、伦理委员会和临床试验机构书面报告。(三)临床试验完成后,研究者应当向临床试验机构报告;研究者应当向伦理委员会提供临床试验结果的摘要,向申办者提供药品监督管理部门所需要的临床试验相关报告。”
