2.2.2 化学反应热的计算
2.2.2 化学反应热的计算
1.标准摩尔生成焓
(1)标准摩尔生成焓的定义:在标准态下,由指定的纯态单质生成单位物质量的某物质的焓变(恒压反应热),定义为该物质的标准摩尔生成焓。标准摩尔生成焓用符号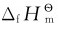 表示,上标
表示,上标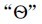 表示标准态,下标“f”(formation的词头)表示生成反应。
表示标准态,下标“f”(formation的词头)表示生成反应。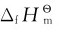 的单位为kJ·mol-1,通常使用的是298.15K的标准摩尔生成焓数据。
的单位为kJ·mol-1,通常使用的是298.15K的标准摩尔生成焓数据。
元素若有几种同素异形体,在标准态下通常以最稳定单质的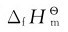 为零。但也有例外,如磷就有白磷、紫磷等多种单质,根据标准摩尔生成焓的定义,指定白磷的标准摩尔生成焓为零,即
为零。但也有例外,如磷就有白磷、紫磷等多种单质,根据标准摩尔生成焓的定义,指定白磷的标准摩尔生成焓为零,即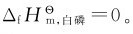 碳有石墨、金刚石等多种单质,指定石墨的标准摩尔生成焓为零,即
碳有石墨、金刚石等多种单质,指定石墨的标准摩尔生成焓为零,即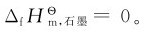
已知 的标准摩尔反应焓变
的标准摩尔反应焓变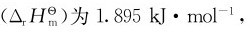 这样金刚石的标准摩尔生成焓:
这样金刚石的标准摩尔生成焓:
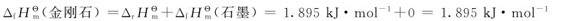
根据标准摩尔生成焓,可以判断同类型化合物的相对热稳定性。例如,298.15K下CaO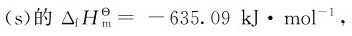 CaO加热不分解;CuO(s)的
CaO加热不分解;CuO(s)的 kJ·mol-1,高温时分解为和,这表明其代数值越小,化合物越稳定。
kJ·mol-1,高温时分解为和,这表明其代数值越小,化合物越稳定。
(2)标准摩尔反应焓变的计算:一般的化学反应及其反应热可以通过实验直接测定,也可以通过热力学数据计算得出。化学反应的标准摩尔反应焓变等于生成物的标准摩尔生成焓的总和减去反应物的标准摩尔生成焓的总和。
对于一般的化学反应:αA+βB=γC+δD
任一物质均处于温度T的标准态下,它的标准摩尔反应焓变为:
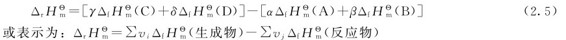
式中的νi表示反应式中物质i的化学计量数。
例2.2 计算恒压反应2Al(s)+Fe2O3(s)→Al2O3(s)+2Fe(s)的标准摩尔反应焓变,并判断此反应是吸热还是放热。
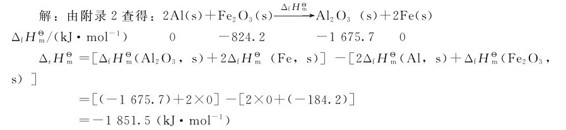
该反应为放热反应。铝热法正是利用此反应放出的热量熔化和焊接铁件的。
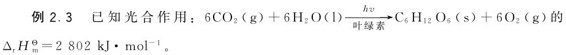
(1)试计算葡萄糖(C6H12O6)的标准摩尔生成焓;
(2)每合成1千克葡萄糖需要吸收多少千焦太阳能?

光合作用的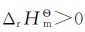 ,表明其为吸热反应,热量来自太阳光;其逆过程为放热反应,所以氧化摄入生物体内的葡萄糖能供给热量。
,表明其为吸热反应,热量来自太阳光;其逆过程为放热反应,所以氧化摄入生物体内的葡萄糖能供给热量。
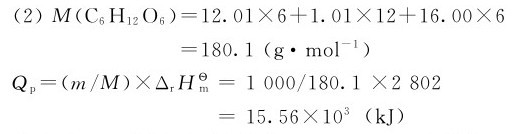
每合成1kg葡萄糖需要吸收15.56×103kJ太阳能。
2.摩尔反应热 设有化学反应:
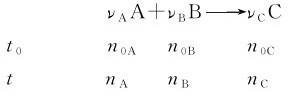
若t时刻的反应进度为ξ,则:
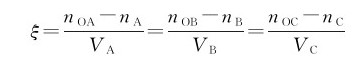
若ξ=1mol时的热效应为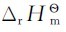 ,则ξ=2mol时的热效应为
,则ξ=2mol时的热效应为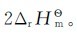
某恒压反应,当反应进度为ξ时,恒压热为ΔrH,则:
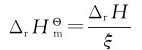
这里的ΔrHm被定义为摩尔反应热,单位是kJ·mol-1。
