3.3 化学平衡
3.3 化学平衡
在同一条件(温度、压力、浓度等)下,能同时向正、逆两个相反方向进行的反应称为可逆反应。例如:
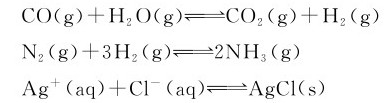
原则上讲,几乎所有的化学反应都是可逆的,但是各个可逆反应的可逆程度却有很大的差别。上面例子中CO和H2O反应的可逆程度大,Ag+和Cl-反应的可逆程度则较小。
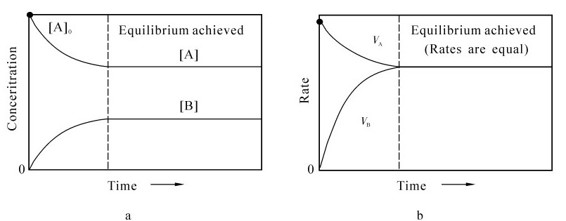
可逆反应的进行,必然导致化学平衡状态的实现。在一定的温度下,定量的反应物在密闭容器内进行可逆反应,随着反应物的不断消耗、生成物的不断增加,正反应速率将不断减小,逆反应速率将不断增大,直到某个时刻,正、逆反应速率相等,各反应物、生成物的浓度不再变化,即反应达到了某个极限,这时反应体系所处的状态称为“化学平衡状态”(chemical equilibrium)。
化学平衡状态有以下特点:
(1)只有在恒温、与外界只有能量交换而无物质交换的封闭体系中进行的可逆反应,才能建立化学平衡,这是建立平衡的前提。
(2)化学平衡是一种动态平衡,正反应和逆反应始终都在进行着,只不过两者反应速率相等,各物质的浓度保持不变,如图3.4所示,并且其他如颜色、密度等性质也不变。所以从宏观上来看,反应似乎停止,但从微观化学动力学角度来看它是一种动态平衡。
(3)体系中各物质的浓度不再随时间的改变而改变,这是平衡的标志;平衡状态是封闭体系中可逆反应进行的最大限度。
(4)化学平衡可以从正、逆两个方向实现,不论反应物初始浓度如何,也不管反应是以正反应方向开始,还是从逆反应方向开始,最后都能达到平衡。
(5)对于在一定条件下达到的化学平衡,ΔrGm=0。若平衡条件被破坏,则ΔrGm不再等于0,原有的平衡状态被破坏系统将向一新的平衡状态转移,这称作平衡的移动。因此化学平衡状态是一定条件下的化学平衡。
(6)化学平衡规律适用于各种化学平衡,如电离平衡、酸碱平衡、沉淀平衡、氧化还原平衡、配位平衡等。