8.2.2 晶体场理论
8.2.2 晶体场理论
早在1929年皮塞(H.Bethe)就提出了晶体场理论(crystal field theory, CFT),但由于人们当时未了解其重要意义而被忽视,直到20世纪50年代才开始将晶体场理论应用于配合物的研究,后来又进一步发展成为比较完整的配位场理论。
1.晶体场理论的要点
(1)中心离子和配体阴离子(或极性分子)之间的相互作用,类似离子晶体中阳、阴离子之间(或离子与偶极分子之间)的静电排斥和吸引。
(2)中心离子的五个能量相同的d轨道由于受周围配体负电场不同程度的排斥作用,能级发生分裂,有些轨道能量升高,有些轨道能量降低。
(3)由于d轨道能级的分裂,d轨道上的电子将重新分布,体系能量降低,变得比未分裂时稳定,即给配合物带来了额外的稳定化能。
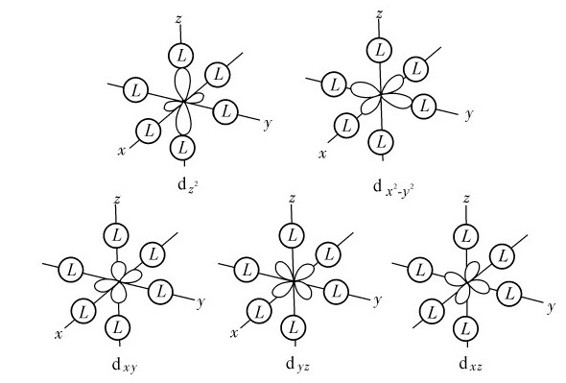
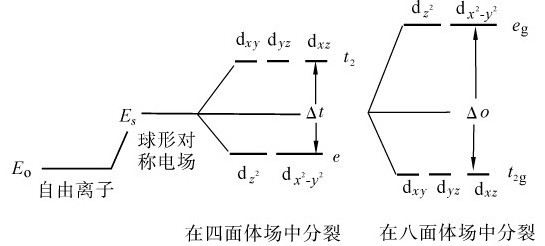
2.d轨道能级在八面体场中的分裂
(1)正八面体场:在正八面体场中,六个相同的配体L各沿着±x,±y,±z坐标轴接近中心离子,带正电的中心离子与作为配体的阴离子(或极性分子带负电的一端)相互吸引;但同时中心离子d轨道上的电子受到配体的排斥,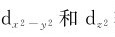 轨道处于和配体迎头相碰的位置,受到静电斥力较大,能量升高。而dxy、dyz、dxz这三个轨道正好插在配体的空隙中间,受到静电排斥力较小,它们的能量相应比前两个轨道的能量低,即在配体的影响下,原来能量相等的d轨道能级分裂为两组(图8.1):一组为能量较高的
轨道处于和配体迎头相碰的位置,受到静电斥力较大,能量升高。而dxy、dyz、dxz这三个轨道正好插在配体的空隙中间,受到静电排斥力较小,它们的能量相应比前两个轨道的能量低,即在配体的影响下,原来能量相等的d轨道能级分裂为两组(图8.1):一组为能量较高的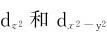 轨道,称为eg轨道,它们二者的能量相等;另一组为能量较低的dxy,dyz,dxz轨道,称为t2g轨道,它们三者的能量相等。
轨道,称为eg轨道,它们二者的能量相等;另一组为能量较低的dxy,dyz,dxz轨道,称为t2g轨道,它们三者的能量相等。
()正四面体场:在正四面体场中,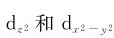 受电场作用小,低于球形场,而dxy、dyz、dxz受电场作用大,能量高于球形场。
受电场作用小,低于球形场,而dxy、dyz、dxz受电场作用大,能量高于球形场。
图8.2为d轨道在四面体场和八面体场中的分裂情况。
3.分裂能及其影响因素 分裂后最高能量d轨道和最低能量d轨道的能量之差叫做分裂能(break-up energy),可用Δ表示。此能量的大小可由配合物的光谱来测定。影响分裂能大小的主要因素分述如下。
(1)配合物的几何构型:若在八面体场中,其分裂能用Δo表示,四面体场的分裂能用Δt表示,则有:
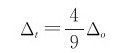
(2)配体的性质:同种中心离子,与不同配体形成相同构型的配离子时,其分裂能Δ值随配体场强弱不同而变化。
配体场强愈强,Δo值就愈大。配体场强的强弱顺序排列如下:

这个顺序是从配合物的光谱实验确定的,故称为光谱化学序列。光谱化学序列中,大体上可以将H2O、NH3作为分界弱场配体(如I-、Br-、Cl-、F-等)和强场配体(如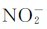 、CN-等)的界限。
、CN-等)的界限。
(3)中心离子的电荷:同种配体与同一过渡元素中心离子形成的配合物,中心离子正电荷越多,其Δ值越大。
(4)元素所在周期数:同种配体与相同氧化值同族过渡元素离子所形成的配合物,其Δ值随中心离子在周期表中所处的周期数而递增。一般第二过渡系比第一过渡系的Δ大40%~50%,第三过渡系比第二过渡系大20%~25%。这主要是由于后两过渡系金属离子的d轨道伸展的较远,与配体更为接近,使中心离子与配体间的斥力较大。
4.高自旋与低自旋配合物及其d电子分布 在八面体场中,由于t2g轨道比eg轨道能量低,按照能量最低原理,电子将优先分布在t2g轨道上。
对于具有d1~d3构型的离子,当其形成八面体配合物时,d电子应分布在t2g轨道上。例如Cr3+(构型)的三个d电子分布方式只有一种。
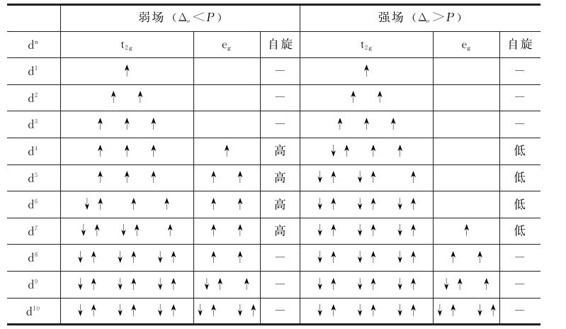
对于d4~d7构型的离子,当其形成八面体配合物时,d电子可以有两种分布方式,见表。
表8.5 八面体中d电子在t2g和eg轨道中的排布
具有d4构型的离子(如Cr2+,Mn3+),其第4个电子可进入eg轨道,此时需要克服分裂能Δo;这个电子也可进入已被d电子占据的t2g轨道之一,并和原来占据该轨道的电子成对,此时需要克服电子成对能。
所谓电子成对能(P)(pairing energy),是指当一个轨道上已有一个电子时,如果另有一个电子进入该轨道与之成对,为克服电子间的排斥作用所需要的能量。
(1)当Δo<P(弱场配体)时,电子较难成对,而尽可能占据较多的d轨道,保持较多的自旋平行电子,形成高自旋(high spin)型配合物。
(2)当Δo>P(弱场配体)时,电子尽可能占据能量低的t2g轨道而自旋配对,成单电子数减少,形成低自旋(low spin)型配合物。
同样,在八面体场中,具有d5,d6,d7构型的离子的d电子也有高自旋和低自旋两种分布方式;而具有d8,d9,d10构型的离子,其d电子分别只有一种分布方式,无高低自旋之分,见表8.5。
除上述两种情况外,少数情况下,Δo和P值相近,这时高自旋和低自旋两种状态具有相近的能量,在外界条件(如温度、溶剂)的影响下,两种状态可以互变。
5.晶体场稳定化能(CFSE) 中心离子的d轨道在八面体场中能级分裂为t2g和eg两组,轨道在分裂前后总能量应当不变。若以分裂前的球形场中的离子为基准,设其能量为零(Es=0),t2g和eg能量差等于分裂能:
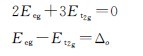
由上二式可以解出:
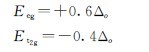
即在八面体场中d轨道能级分裂的结果与球形场中未分裂前比较,eg轨道的能量上升了0.6Δo,而t2g轨道的能量下降了0.4Δo。d电子进入分裂的轨道比处于未分裂轨道时的总能量有所降低,总能量降低值称为晶体场稳定化能(crystal field stabilization energy),用符号CFSE表示。如Cr3+(d3)在八面体场中,其电子分布为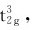 相应的晶体场稳定化能CFSE=3×(-0.4×Δo)=-1.2×Δo。Fe3+(d5)在八面体弱场中分布为
相应的晶体场稳定化能CFSE=3×(-0.4×Δo)=-1.2×Δo。Fe3+(d5)在八面体弱场中分布为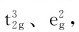 相应的晶体场稳定化能CFSE=3×(-0.4Δo)+2×0.6Δo=0;在八面体强场中分布为
相应的晶体场稳定化能CFSE=3×(-0.4Δo)+2×0.6Δo=0;在八面体强场中分布为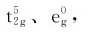 相应的晶体场稳定化能CFSE=5×(-0.4Δo)+2P=2.0Δo+2P。离子的晶体场稳定化能(CFSE)如表8.6所示。
相应的晶体场稳定化能CFSE=5×(-0.4Δo)+2P=2.0Δo+2P。离子的晶体场稳定化能(CFSE)如表8.6所示。
表8.6 离子的晶体场稳定化能(CFSE)
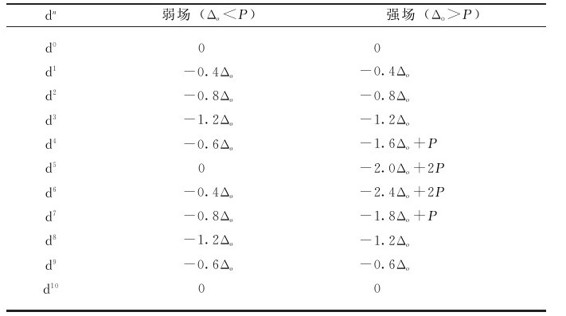
晶体场稳定化能与中心离子的d电子数有关,也与晶体场的场强有关,此外还与配合物的几何构型有关。晶体场稳定化能越负(代数值越小),体系越稳定。
6.晶体场理论的应用
(1)预测配合物的磁性:由于电子成对能P和分裂能Δ可通过光谱实验数据求得,从而可推测配合物中心离子的电子分布及自旋状态。
例如,[Co(CN)6]3-与[CoF6]3-的Δo分别为67.524×10-20J和25.818×10-20J,而Co3+的成对能P为35.350×10-20J,因此[Co(CN)6]3-与[CoF6]3-的配合物分别为低自旋和高自旋,根据表8.5,Co3+低自旋时,自旋电子数为零,磁矩为零;高自旋时,未成对电子有4个,磁矩为4.90B.M.。
(2)解释配合物的颜色:晶体场理论能较好地解释配合物的颜色。如过渡元素水合离子均为配离子,其中心离子在配体水分子的影响下,d轨道能级分裂。而d轨道又常没有填满电子,当配离子吸收可见光区某一部分波长的光时,d电子可从能级低的d轨道跃迁到能级较高的d轨道(例如八面体场中由t2g轨道跃迁到eg轨道),这种跃迁称为d-d跃迁。发生d-d跃迁所需的能量即为轨道的分裂能Δo。吸收光的波长越短,表示电子被激发而跃迁所需要的能量越大,即分裂能Δo值越大。
