7.5.3 同核双原子分子的分子轨道能级图
7.5.3 同核双原子分子的分子轨道能级图
两个原子轨道组合得到两个分子轨道,一个成键分子轨道,一个反键分子轨道。每个分子轨道都有相应的能量,其能级顺序为:成键分子轨道能量<非键分子轨道能量<反键分子轨道能量。
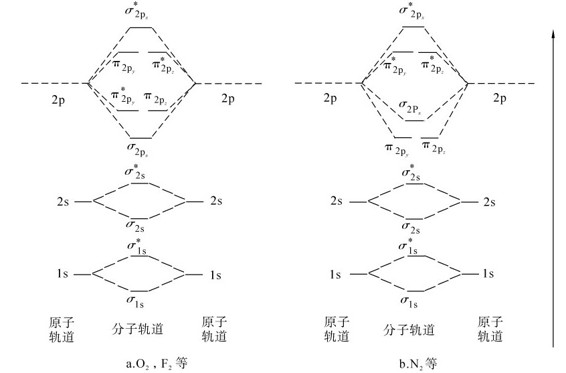
由于原子种类不同,组成的分子轨道能量也不相同。根据近代光谱测定的实验数据,可得到分子中各分子轨道的能量,依由低到高的次序排列,形成分子轨道能级图。对第二周期的同核双原子分子的分子轨道能级顺序,可根据2s和2p原子轨道的能量差异,得出两种分子轨道能级图,见图7.15。
在分子中,成键电子多,体系的能量低,分子就稳定。如果反键电子多,体系的能量高,不利于分子的稳定存在。由于分子中全部电子属于整个分子所有,分子轨道理论没有单键、双键等概念。分子轨道理论把分子中成键电子和反键电子数之差的一半定义为分子的键级(bond order)。

分子的稳定性通过键级来描述,键级越高,分子越稳定。键级为0的分子不能稳定存在。如H2分子,有两个成键电子,键级为1,能够稳定存在。He2分子,有两个成键电子和两个反键电子,键级为0,不能稳定存在。一般来说,键长随键级的增加而减小,键能随键级的增加而增大。
图7.15a表示2s原子轨道与2p原子轨道的能级差较大(如O、F、Ne),不会发生2s轨道与2p轨道的组合。图7.15b则表示2s原子轨道与2px原子轨道的能级差较小(如B、C、N),将发生2s轨道与2px轨道的组合。
从Li2到N2,由于成键原子的2s和2p轨道能量相差较小,依据图7.15b,不同原子轨道的相互作用使分子轨道能级次序顺序为:
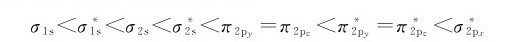
从O2到F2,由于成键原子的2s和2p轨道能量相差较大,故不必考虑2s和2p原子轨道之间的相互作用,依据图7.15a,分子轨道能级次序顺序为
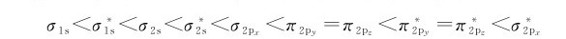
下面应用分子轨道理论来描述第二周期同核双原子分子的分子轨道。
1.锂(1s22s1) Li2分子共有6个电子,其中4个是1s电子,2个是2s电子。其分子轨道式为: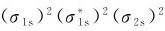 ,键级为1。Li2的分子轨道式也可以简写为
,键级为1。Li2的分子轨道式也可以简写为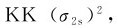 其中KK表示有两对电子分别处于2个原子K层的1s轨道。因此可以说,原子内层1s电子基本上维持了在原子轨道中的状态。
其中KK表示有两对电子分别处于2个原子K层的1s轨道。因此可以说,原子内层1s电子基本上维持了在原子轨道中的状态。
2.铍(1s22s2) Be2分子共有8个电子,其中4个是1s电子,其余4个2s电子占满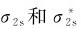 轨道。键级为0,所以该分子不稳定,目前实验中还没有发现Be2分子存在。
轨道。键级为0,所以该分子不稳定,目前实验中还没有发现Be2分子存在。
3.硼(1s22s22p1) B2分子共有10个电子。如图7.15b所示,根据洪特规则,后两个电子应分别填入π2py和π2pz轨道。B2的分子轨道式为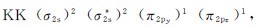 这样B2分子应含有两个单电子,也就是说B2分子具有顺磁性。实验结果表明,B2分子确实是顺磁性分子,这也是π2p能级低于σ2p的重要证据。
这样B2分子应含有两个单电子,也就是说B2分子具有顺磁性。实验结果表明,B2分子确实是顺磁性分子,这也是π2p能级低于σ2p的重要证据。
4.碳(1s22s22p2) C2分子的12个电子中有8个电子填入分子轨道,其分子轨道式为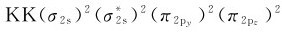 ,由于全部电子都成对,因此C2分子显示抗磁性。该分子可在高温或放电条件下检出。C2分子的键级为2,说明C2分子解离能比较高。
,由于全部电子都成对,因此C2分子显示抗磁性。该分子可在高温或放电条件下检出。C2分子的键级为2,说明C2分子解离能比较高。
5.氮(1s22s22p3) N2分子有个电子填入分子轨道,其分子轨道式为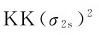
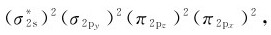 其中有8个成键电子和2个反键电子,键级为3,稳定性非常高。从分子轨道式中可以看出,N原子间存在1个σ键和2个π键,与路易斯结构式(N≡N)相一致。
其中有8个成键电子和2个反键电子,键级为3,稳定性非常高。从分子轨道式中可以看出,N原子间存在1个σ键和2个π键,与路易斯结构式(N≡N)相一致。
6.氧(1s22s22p4) O2分子中的电子,按图7.15a所示能级顺序由低到高分别填入分子轨道。其分子轨道式为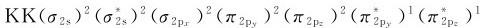 。从分子轨道理论可以清楚地看出,O2分子中含有2个成单电子,是顺磁性分子。在O2分子中,氧原子之间存在1个σ键(σ2p)和2个三电子π键
。从分子轨道理论可以清楚地看出,O2分子中含有2个成单电子,是顺磁性分子。在O2分子中,氧原子之间存在1个σ键(σ2p)和2个三电子π键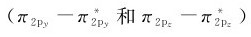 ,其结构式为:
,其结构式为: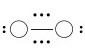 。短横代表σ键,…代表三电子π键,左右两边的黑点表示2s孤对电子,它们是由σ2s上的一对电子和
。短横代表σ键,…代表三电子π键,左右两边的黑点表示2s孤对电子,它们是由σ2s上的一对电子和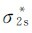 上的一对电子的能量变化相互抵消而得到的,所以和电子仍在原来的原子轨道上效果一样。根据O2分子的电子排布计算其键级为2,说明一个三电子π键的强度相当于正常π键的一半。如果在分子的最高被占轨道
上的一对电子的能量变化相互抵消而得到的,所以和电子仍在原来的原子轨道上效果一样。根据O2分子的电子排布计算其键级为2,说明一个三电子π键的强度相当于正常π键的一半。如果在分子的最高被占轨道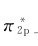 上移去或填入一个电子,就得到氧分子离子
上移去或填入一个电子,就得到氧分子离子 它们的键级分别为
它们的键级分别为 因此,其稳定性次序为
因此,其稳定性次序为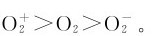
7.氟(1s22s22p5) F2分子中的所有电子都成对;键级为1,与路易斯结构式相一致。
8.氖(1s22s22p6) 实验中从未检测出Ne2分子的存在,这与分子轨道理论的判断相一致。电子填满了图7.15a中的所有分子轨道,键级为0。
分子轨道理论比较全面地反映了分子中电子的各种运动状态。运用该理论可以说明共价键的形成,也可以解释分子或离子中单键和三电子键的形成,但在解释分子的几何构型时不够直观。分子轨道理论和价键理论都以量子力学原理为基础,在处理化学问题时各有优势。它们可以互为补充,相辅相成,为人们解释化学结构和某些化学现象提供了可靠的理论依据。
