9.2.3 s区元素的重要化合物
9.2.3 s区元素的重要化合物
9.2.3.1 氧化物
碱金属和碱土金属能形成多种类型的氧化物:正常氧化物(含有O2-)、过氧化物(含有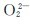 )、超氧化物(含有
)、超氧化物(含有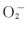 )、臭氧化物(含有
)、臭氧化物(含有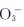 )等。s区元素所形成的氧化物列于表9.2中。
)等。s区元素所形成的氧化物列于表9.2中。
表9.2 s区元素形成的氧化物

1.正常氧化物 在空气中燃烧时,只有锂生成氧化锂(白色固体)。尽管在缺氧的空气中可以制得其他碱金属普通氧化物,但条件不易控制,所以其他碱金属的氧化物M2O必须采用间接方法来制备。例如用金属钠还原过氧化钠,用金属钾还原硝酸钾,分别可以制得氧化钠(白色固体)和氧化钾(淡黄色固体):
Na2O2+2Na=2Na2O
2KNO3+10K=6K2O+N2
碱土金属在室温或加热下能和氧气直接化合而生成氧化物MO,并可以从它们的碳酸盐或硝酸盐加热分解制得MO,例如:
CaCO3(s)=CaO(s)+CO2(g)
2Sr(NO3)2=2SrO+4NO2↑+O2↑
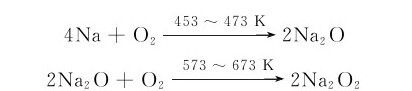
2.过氧化物 碱金属最常见的过氧化物是过氧化钠,实际用途也较大。在453~473K时,钠即被氧化为Na2O,进而增加空气流量并迅速提高温度至573~673K,即可制得Na2O2(淡黄色粉末):
Na2O2与水或稀酸反应而产生H2O2,H2O2立即分解放出氧气:
Na2O2+2H2O=H2O2+2NaOH
Na2O2+H2SO4=H2O2+Na2SO4
Na2O2与CO2反应,能放出氧气:
2Na2O2+2CO2=2Na2CO3+O2
3.超氧化物 超氧化物(hyperoxide)中的负离子是超氧离子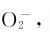 其结构式如下:
其结构式如下:
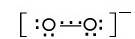
联系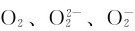 的结构可以看出:
的结构可以看出: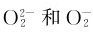 的反键轨道上的电子比O2多,键级比O2小,键能(分别为142kJ·mol-1和398kJ·mol-1)比O2(498kJ·mol-1)小。所以过氧化物和超氧化物稳定性不高。
的反键轨道上的电子比O2多,键级比O2小,键能(分别为142kJ·mol-1和398kJ·mol-1)比O2(498kJ·mol-1)小。所以过氧化物和超氧化物稳定性不高。
4.碱金属和碱土金属氢氧化物的碱性 除Be(OH)2为两性氢氧化物外,其他碱金属、碱土金属的氢氧化物都是强碱或中强碱。这两族元素氢氧化物碱性和溶解度递变规律可以归纳如下:
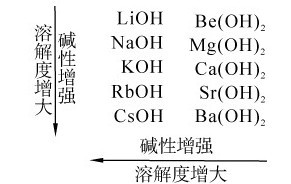
其中Be(OH)2是两性氢氧化物,它既溶于酸也溶于碱:
Be(OH)2+2H+=Be2++2H2O
Be(OH)2+2OH-=[Be(OH)4]2-
9.2.3.2 盐类
碱金属、碱土金属最常见的盐有卤化物、硫酸盐、硝酸盐、碳酸盐和磷酸盐。应该注意,碱土金属中铍盐和钡盐具有很强的毒性。
碱金属的盐大多数是离子型晶体,它们的熔点、沸点较高。由于Li+离子半径很小,极化力较强,它在某些盐(如卤化物)中表现出不同程度的共价性。碱土金属离子带两个正电荷,其离子半径较相应的碱金属小,故它们的极化力较强,因此碱土金属盐的离子键特征较碱金属的差。其中,BeCl2的熔点明显的低,这是由于Be2+半径小,极化力较强,它与Cl-、Br-、I-等极化率较大的阴离子形成的化合物已过渡为共价化合物。
碱金属离子(M+)和碱土金属离子(M2+)都是无色的。若阴离子是有色的,则它们的化合物常显阴离子的颜色。
碱金属的盐除硝酸盐及碳酸锂外一般都具有较强的稳定性,在800℃以下均不分解。卤化物在高温时挥发而不分解;硫酸盐在高温时既不挥发又难分解。
碱金属盐类的最大特征是易溶于水,并且在水中完全电离只有少数碱金属盐是难溶的。它们的难溶盐一般都是由大的阴离子组成,而且碱金属离子越大,难溶盐的数目也越多。
难溶钠盐有白色粒状的六羟基锑(V)酸钠(Na[Sb(OH)6]),黄绿色的醋酸双氧铀酰锌钠(NaAc·Zn(Ac)2·3UO2(Ac)2·9H2O)。难溶的钾盐稍多,有高氯酸钾(KClO4,白色),四苯硼酸钾[KB(C6H5)4,白色],酒石酸氢钾(KHC4H4O6,白色),六氯铂(Ⅳ)酸钾(K2[PtCl6],淡黄色),钴(Ⅲ)亚硝酸钠钾(K2Na[Co(NO2)6],亮黄色),钠、钾的一些难溶盐常用来鉴定钠、钾离子。
碱土金属的盐类中,除卤化物和硝酸盐外,多数碱土金属的盐只有较低的溶解度,例如它们的碳酸盐、磷酸盐及草酸盐等都是难溶盐(BeC2O4除外)。铍盐中多数是易溶的,镁盐有部分易溶,而钙、锶、钡的盐则多为难溶。钙盐中以CaC2O4的溶解度为最小,因此常用来鉴定Ca2+。
