习题
习题
一、是非题
1.硫酸和硝酸分子中均含有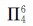 键。 ( )
键。 ( )
2.若要验证Pb(OH)2在酸中的溶解性,只能将其溶解在HAc或硝酸中。 ( )
3.铜与浓HNO3反应生成NO2,铜与稀HNO3反应生成NO,所以稀HNO3的氧化性比浓HNO3强。 ( )
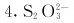 的构型与
的构型与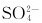 相似。 ( )
相似。 ( )
5.氯酸钾是强氧化剂,在氯酸钾的水溶液中加入KI即有I2生成。 ( )
6.硼是缺电子原子,在乙硼烷中含有配位键。 ( )
二、选择题
1.对元素周期表ⅠA族元素来说,从上到下,下列性质中变化规律正确的是 ( )
(A)金属性减弱 (B)第一电离能减小
(C)第一电离能增大 (D)电负性增大
2.下列叙述中错误的是( )。
(A)HClO3的氧化性强于KClO3
(B)KClO3在酸性溶液中可氧化Cl-
(C)将Cl2(g)通入酸性溶液中可发生歧化反应
(D)常温下在碱性介质中,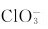 不能发生歧化反应
不能发生歧化反应
3.对于乙硼烷,下列叙述中错误的是( )。
(A)易自燃 (B)能水解
(C)易发生加合反应 (D)固态时是原子晶体
4.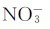 中的离域π键属于( )。
中的离域π键属于( )。

5.比较下列各组氢化物酸性的强弱,错误的是( )。
(A)H2O>NH3 (B)H2S>PH3
(C)H2Se>H2S (D)H2Se>H2Te
6.下列关于PbCl2和SnCl2的叙述中,错误的是( )。
(A)SnCl2比PbCl2易溶于水(B)它们都能被Hg2+氧化
(C)它们都可以与Cl-形成配合物(D)在多种有机溶剂中,SnCl2比PbCl2更易溶
7.下列各酸中为一元酸的是( )。
(A)H3PO4 (B)H3PO3
(C)H3PO2 (D)H4P2O7
8.下列硝酸盐分解时,产物中不含有NO2的是( )。
(A)LiNO3 (B)NaNO3
(C)Be(NO3)2 (D)Mg(NO3)2
9.下列离子在过量NaOH溶液中能生成氢氧化物沉淀的是( )。
(A)Sn2+ (B)Pb2+ (C)Bi3+ (D)Al3+
10.卤素单质中,与水不发生水解反应的是( )。
(A)F2 (B)Cl2 (C)Br2 (D)I2
11.下列化合物中属于缺电子化合物的是( )。
(A)BCl3 (B)H[BF4] (C)Al2Cl6 (D)Na[Al(OH)4]
12.下列性质中,不能说明HNO3和H3PO4之间差别的是( )。
(A)酸强度 (B)沸点 (C)成酸元素的氧化值 (D)氧化性
13.在BF3·NH3加合物中,硼原子的杂化轨道类型是( )。
(A)sp (B)sp2 (C)sp3 (D)sp3d
三、填充题
1.Na2CO3的溶解度比K2CO3的________,NaHCO3的溶解度比KHCO3的________,Na2CO3的溶解度比NaHCO3的________。NaHCO3(s)中除了离子键、共价键之外,还有________键。
2.在碘化物中加入氯水和四氯化碳并摇动,CCl4层的颜色是________色,当氯水过量时呈现________色。与前述现象相应的碘的存在形式分别为________和________。
3.ⅡA族元素中,性质表现特殊的元素是________,它与p区元素中的________元素性质相似,两者的氢氧化物都呈________。两者的氯化物都是________型化合物。
4.CO2与SiO2组成相似,但在常温常压下,CO2是气体,而SiO2为固体,其主要原因是因为CO2___________;SiO2___________。
四、写出下列反应方程式并配平
1.硫化铝与水作用。
2.在硫代锡酸钠溶液中加盐酸。
3.向硅酸钠溶液中滴加饱和氯化铵溶液。
4.PbS与浓盐酸反应。
5.在碱性溶液中,亚锡酸钠[四羟基合锡(Ⅱ)酸钠]与三氯化铋反应。
6.I2与硫代硫酸钠反应。
7.向PbS中加入过量H2O2。
8.把氯气长时间通入碘化钾溶液中。
五、问答题
1.某元素A能直接与ⅦA族中某元素B反应时生成A的最高氧化值的化合物ABx,在此化合物中B的含量为83.5%,而在相应的氧化物中,氧的质量占53.3%。ABx为无色透明液体,沸点为57.6℃,对空气的相对密度约为5.9。试回答:
(1)元素A、B的名称。
(2)元素A属第几周期、第几族及最高价氧化物的化学式。
2.一白色固体混合物可能含有KI、BaCl2、KIO3和CaI2中的两种物质。该混合物溶于水得一无色溶液,在无色溶液中加入少量稀H2SO4,溶液变为黄棕色,且有白色沉淀生成;该黄棕色溶液中加入NaOH至溶液呈碱性后,黄棕色溶液褪色,但白色沉淀却未消失。试确定该固体混合物含哪两种化合物。写出有关的反应方程式。
4.某溶液中含有K+、Mg2+、Ba2+。试设计一个分离K+、Mg2+、Ba2+的实验,说明实验步骤,写出有关反应方程式。
