习题
2025年09月17日
习题
1.MgO、CaO、SrO、BaO均为NaCl型离子晶体,试比较它们的晶格能大小和熔点高低。
2.根据杂化轨道理论预测下列分子的空间构型:PH3、BBr、SiH4、CO2、C2H4、OF2。
3.PCl3的几何构型是三角锥形,键角略小于109°28′;SiCl4的几何构型是正四面体,键角为109°28'。试用杂化轨道理论加以说明。
4.利用价层电子对推斥理论判断下列分子或离子的几何构型:
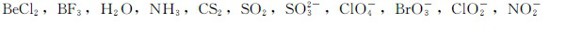
5.当键轴为x轴时,下列各组的两个原子轨道是否属于对称性匹配?
(1)s-s;(2)s-px;(3)s-py;(4)s-pz;
(5)px-px;(6)px-py;(7)py-pz;(8)py-py。
6.用分子轨道理论解释:(1)B2为顺磁性物质;(2)Ne2不存在。
7.下列分子中,哪些是极性分子,哪些是非极性分子?为什么?
CCl4,CHCl3,BCl3,NCl3,H2S,CS2
8.比较下列各组分子的分子电偶极矩的大小:
(1)CO2和SO2; (2)CCl4和CH4; (3)PH3和NH3;
(4)BF3和NH3; (5)H2O和H2S。
9.判断下列各组分子之间存在什么形式的作用力?
(1)C6H6和CCl4;(2)He和H2O;(3)C6H6气体;
(4)NH3气体;(5)CH3OH和H2O。
10.下列化合物中是否存在氢键,若存在氢键,是属于分子间氢键,还是分子内氢键?
(1)NH3;(2)H3BO3;(3)C2H6;

11.用价键理论和分子轨道理论分别说明为什么H2能稳定存在,而He2不能稳定存在?
