4.2.2 溶液的酸碱性
2025年09月17日
4.2.2 溶液的酸碱性
溶液中H3O+浓度或OH-浓度的相对大小反映了溶液的酸碱性的强弱。氢离子或氢氧根离子浓度的改变能引起水的解离平衡的移动:在纯水中,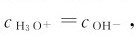 如果加入少量的或形成稀溶液,
如果加入少量的或形成稀溶液,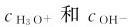 将发生改变。达到新的平衡时,
将发生改变。达到新的平衡时,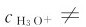
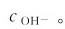 但是,只要温度保持恒定,
但是,只要温度保持恒定,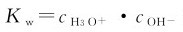 就保持不变。若已知
就保持不变。若已知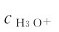 ,可根据式(4.2)求得
,可根据式(4.2)求得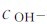 ;反之亦然。
;反之亦然。
一般稀溶液中,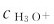 的范围为10-1~10-14·L-1,常采用pH表示,而在溶液中
的范围为10-1~10-14·L-1,常采用pH表示,而在溶液中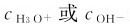 大于1mol·L-1时,用浓度直接表示溶液的酸碱性。
大于1mol·L-1时,用浓度直接表示溶液的酸碱性。

与pH对应的还有pOH,即

25℃的水溶液中:
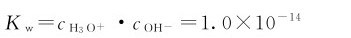
将等式两边分别取负对数,得
pKw=pH+pOH=14.00 (4.5)
pH值是用来表示水溶液酸碱性的一种标度。pH愈小,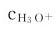 愈大,溶液的酸性愈强,碱性愈弱。溶液的酸碱性与
愈大,溶液的酸性愈强,碱性愈弱。溶液的酸碱性与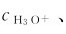 pH的关系可概括如下:
pH的关系可概括如下:
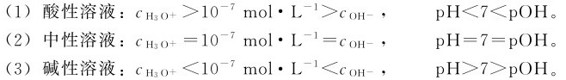
只要确定了溶液中的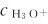 的浓度,就能很容易地计算pH。实际应用中,通常是用试纸和计测定溶液的,再计算
的浓度,就能很容易地计算pH。实际应用中,通常是用试纸和计测定溶液的,再计算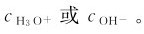 为简便,书中
为简便,书中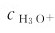 通常写为
通常写为
