4.3.1 弱酸、弱碱的电离平衡
4.3.1.1 一元弱酸的解离平衡
1.解离常数 在一元弱酸HA的水溶液中存在着下列质子转移反应:
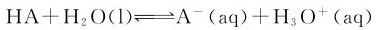
这类反应一般都能很快达到平衡,称其为解离平衡(或电离平衡)。根据平衡原理,标况下HA的解离平衡常数表达式应为

式中的Ka,HA被称为弱酸HA的标准解离常数,其值可以用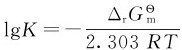 求得。弱酸解离常数的数值可表明弱酸的相对强弱。在相同温度下,解离常数大的酸是较强的酸,其给出质子的能力强。例如,25℃时,
求得。弱酸解离常数的数值可表明弱酸的相对强弱。在相同温度下,解离常数大的酸是较强的酸,其给出质子的能力强。例如,25℃时,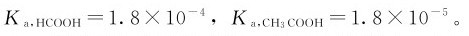 当浓度相同时,甲酸溶液的酸性强,pH小,甲酸是比乙酸强的酸。在非水溶液中,也可以用Ka的相对大小来判断酸的相对强弱。Ka不受浓度影响,是温度的函数,但受温度影响不显著。
当浓度相同时,甲酸溶液的酸性强,pH小,甲酸是比乙酸强的酸。在非水溶液中,也可以用Ka的相对大小来判断酸的相对强弱。Ka不受浓度影响,是温度的函数,但受温度影响不显著。
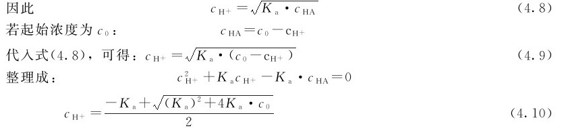
弱酸的解离常数可以借助pH计先测得溶液的pH,然后通过计算来确定。已知弱酸的解离常数Ka,就可以计算出一定浓度的弱酸溶液的平衡组成。实际上,在弱酸溶液中同时存在着弱酸和水的两种解离平衡:
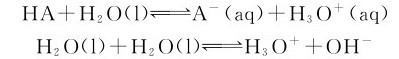
它们都能解离出H3O+,二者之间相互联系、相互影响。通常情况下,Ka>>Kw,在cHA不是很小时,H3O+主要是由HA解离产生的。因此,计算HA溶液中的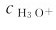 时,可以不考虑水的解离平衡。同时,解离方程可简写为:
时,可以不考虑水的解离平衡。同时,解离方程可简写为:
一元弱酸(碱)
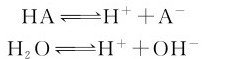
一元弱酸HA溶液中: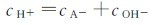
由平衡常数式可得

将其代入式(4.7)中得
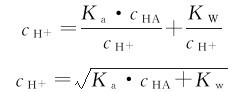
当cHA·Kw≥20Kw时,可忽略Kw(水解离所产生的H+是可以忽略的)。
这是计算一元弱酸水溶液酸度的近似式。
当c0Ka≥20Kw,且c0/Ka≥500时,可认为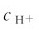 与c0相比可忽略,由式(4.9)可得最简式
与c0相比可忽略,由式(4.9)可得最简式

当c0Ka<20Kw,但c/K时,则水的解离不可忽略,但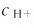 可忽略,得
可忽略,得

例4.1 计算25℃时,0.10mol·L-1HAc溶液中的H、Ac-、HAc、OH-浓度及溶液的pH。
解:查附表Ka=1.8×10-5,H3O+通常可简写为H+,则解离反应为:

2.解离度和稀释定律 在弱酸(或弱碱)的解离平衡组成计算中,常用到解离度的概念,以αHA表示之。解离度αHA是这样定义的:已解离的弱电解质分子数占其分子总数的百分数。在定容反应中,已解离的弱酸(或弱碱)的浓度与原始浓度之比等于其解离度。弱酸的解离度可表示为:
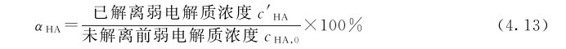
一元弱酸解离度的大小可以表示酸的相对强弱。在温度、浓度相同的条件下解离度大的酸,Ka大,其pH小,是较强的酸;解离度小的酸,Ka小,其pH大,为较弱的酸。以HA(aq)的解离平衡为例,α与Ka的定量关系如下:

式(4.14)表明了一元弱酸溶液的浓度、解离度和解离常数间的关系,随着溶液浓度的降低,解离度增大,这种规律叫做稀释定律。它表明:在一定温度下,Ka保持不变,溶液在一定浓度范围内被稀释时,α增大。由于α随浓度而变,而Ka不随浓度而变,因此,Ka能更本质地反映弱电解质的解离特性。
4.3.1.2 一元弱碱溶液的解离平衡A
一元弱碱的解离平衡组成的计算与一元弱酸的解离平衡组成的计算没有本质上的差别。在弱碱B的溶液中:
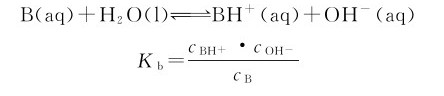
Ka称为一元弱碱的解离常数。
与一元弱酸类似,对于一元弱碱来说:
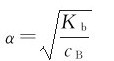
例4.2 已知25℃下,0.20mol·L-1的氨水的pH为11.27。计算溶液中OH-的浓度、解离度α和氨的解离常数Kb。
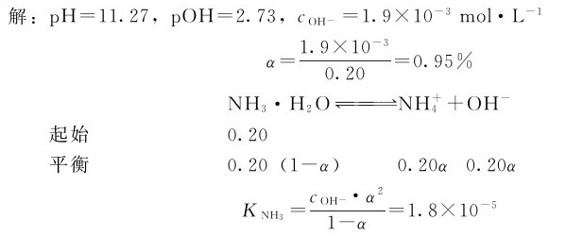
4.3.1.3 多元弱酸的解离平衡
一元弱酸、弱碱的解离过程是一步完成的,多元弱酸、弱碱的解离过程是分步进行的。前文介绍的一元弱酸、弱碱的解离平衡原理,完全适用于多元弱酸、弱碱的解离平衡。这里以碳酸为例来讨论多元弱酸的解离平衡,其分步解离平衡为:
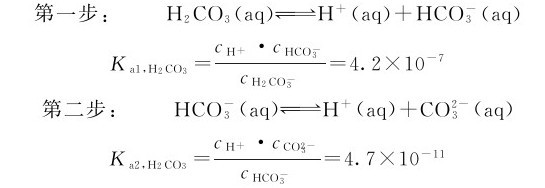
分析碳酸的分步解离可以发现:第一步解离反应的共轭碱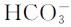 是第二步解离中的酸,其共轭碱为二元酸的酸根离子
是第二步解离中的酸,其共轭碱为二元酸的酸根离子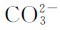 ,所以
,所以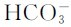 是两性物质。多数多元弱酸的Ka1、Ka2…相差很大,解离常数逐级减小。在这种情况(Ka1/Ka2≈105)下,溶液中的
是两性物质。多数多元弱酸的Ka1、Ka2…相差很大,解离常数逐级减小。在这种情况(Ka1/Ka2≈105)下,溶液中的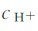 主要取决于第一步解离反应,其计算可按一元弱酸的解离平衡做近似处理。另外,在多元弱酸溶液中,实际上存在多个解离平衡,除了酸自身的多步解离平衡之外,还有溶剂(水)的解离平衡。这种多重平衡体系满足多重平衡规则。在二元弱酸H2A溶液中,
主要取决于第一步解离反应,其计算可按一元弱酸的解离平衡做近似处理。另外,在多元弱酸溶液中,实际上存在多个解离平衡,除了酸自身的多步解离平衡之外,还有溶剂(水)的解离平衡。这种多重平衡体系满足多重平衡规则。在二元弱酸H2A溶液中,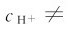
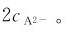 在二元弱酸H2A溶液中,
在二元弱酸H2A溶液中,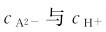 的关系可推导如下:
的关系可推导如下:
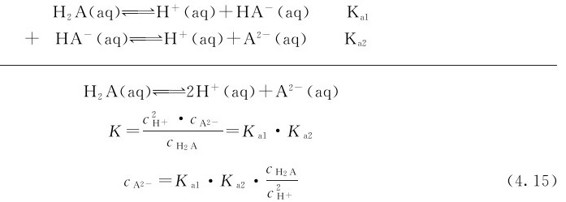
式(4.15)表明,在二元弱酸H2A中,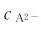 的值与溶液中的
的值与溶液中的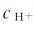 大小成反比。如果在溶液中加入强酸以增大
大小成反比。如果在溶液中加入强酸以增大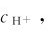 则可显著降低
则可显著降低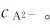 因为,此时溶液中的
因为,此时溶液中的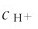 不仅来自于H2A的解离,更确切地说,主要不是来自于H2A的解离,而是来自于强酸的全部解离产生的H。这样,可以通过改变溶液pH的方法来控制
不仅来自于H2A的解离,更确切地说,主要不是来自于H2A的解离,而是来自于强酸的全部解离产生的H。这样,可以通过改变溶液pH的方法来控制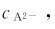 以达到实际需要的目的。
以达到实际需要的目的。
