4.5 沉淀溶解平衡
2025年09月17日
4.5 沉淀溶解平衡
电解质的溶解度是指在一定温度下,某物质在100克溶剂中达到饱和状态时所溶解的克数。溶解度往往有很大的差异,习惯上将其划分为可溶、微溶和难溶等不同等级。如果在100g水中能溶解1g以上的溶质,这种溶质被称为可溶的;物质的溶解度小于0.1g/100g水时,称为难溶;溶解度介于可溶与难溶之间的,称为微溶。
溶度积概述
在一定温度下,将难溶强电解质放入水中时,就发生溶解和沉淀两个过程。以硫酸钡为例,BaSO4是由Ba2+和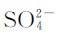 组成的,将其放入水中时,固体中的Ba2+和
组成的,将其放入水中时,固体中的Ba2+和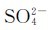 在水分子的作用下,不断由固体表面进入溶液中,成为无规则运动的水合离子,这是BaSO4的溶解过程。与此同时,溶解到溶液中的Ba2+(aq)和
在水分子的作用下,不断由固体表面进入溶液中,成为无规则运动的水合离子,这是BaSO4的溶解过程。与此同时,溶解到溶液中的Ba2+(aq)和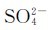 (aq)在不断运动中相互碰撞,或与未溶解的BaSO4表面碰撞时,会以固体BaSO4(沉淀)的形式析出,这是BaSO4的沉淀过程。任何难溶电解质的溶解和沉淀过程都是相互可逆的。开始时,溶解速率较大,沉淀速率较小。在一定条件下,当溶解和沉淀速率相等时,便建立了一种动态的多相离子平衡,可表示如下:
(aq)在不断运动中相互碰撞,或与未溶解的BaSO4表面碰撞时,会以固体BaSO4(沉淀)的形式析出,这是BaSO4的沉淀过程。任何难溶电解质的溶解和沉淀过程都是相互可逆的。开始时,溶解速率较大,沉淀速率较小。在一定条件下,当溶解和沉淀速率相等时,便建立了一种动态的多相离子平衡,可表示如下:
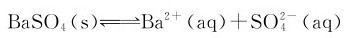
该动态平衡的标准平衡常数表达式为:
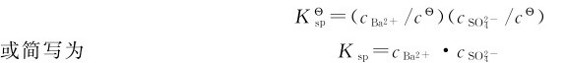
式中Ksp为溶度积常数,简称溶度积。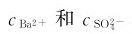 是饱和溶液中Ba2+和SO2-的浓度。Ksp是表征难溶电解质溶解能力的常数,与其他平衡常数一样,Ksp也是温度的函数,可以通过热力学数据计算得到,粗略计算时也可以由实验测得。
是饱和溶液中Ba2+和SO2-的浓度。Ksp是表征难溶电解质溶解能力的常数,与其他平衡常数一样,Ksp也是温度的函数,可以通过热力学数据计算得到,粗略计算时也可以由实验测得。
对于一般的沉淀反应来说:
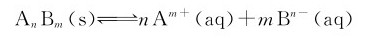
则溶度积的通式为:

溶度积等于沉淀—溶解平衡时离子浓度幂的乘积,每种离子浓度的幂与化学计量式中的计量数相等。要特别指出的是,在多相离子平衡系统中,必须有未溶解的固相存在,否则就不能保证系统处于平衡状态。
