10.6.3 Hg(Ⅰ)与Hg(Ⅱ)的相互转化
10.6.3 Hg(Ⅰ)与Hg(Ⅱ)的相互转化
汞在酸性溶液中的电势图如下
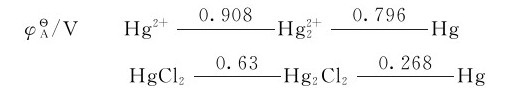
因为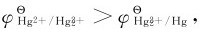 故在溶液中,Hg(I)不发生歧化反应,而Hg2+可以氧化金属H生成
故在溶液中,Hg(I)不发生歧化反应,而Hg2+可以氧化金属H生成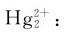
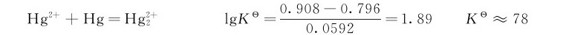
欲使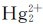 的歧化反应能进行,必须降低溶液中Hg(Ⅱ)的浓度,例如使Hg(Ⅱ)变为某些水不溶物或稳定配合物:
的歧化反应能进行,必须降低溶液中Hg(Ⅱ)的浓度,例如使Hg(Ⅱ)变为某些水不溶物或稳定配合物:
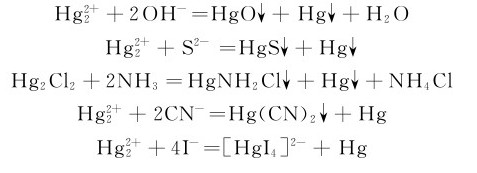
【阅读材料】
绿色化学
绿色化学是在地球环境日益恶化,能源、资源面临危机的情况下首先在欧美产生的。20世纪90年代初,化学家提出了绿色化学的概念,1995年美国设立“绿色化学总统奖”,并设专门机构推动其发展。与此同时,欧洲也提出“可持续发展化学工业”的概念。1997年中国制订的《国家重点基础研究发展规划》,将绿色化学的基础研究项目作为支持的重要方向之一。
绿色化学又称环境无害化学、环境友好化学、清洁化学,是用化学的技术和方法去减少或消灭那些对人类健康、生态环境有害的原料、催化剂、溶剂和试剂、产物、副产物等的使用和产生,是一门从源头上阻止污染的化学。绿色化学是近10年才产生和发展起来的,最大的特点是在始端就采用预防污染的科学手段,因而过程和终端均为零排放或零污染。世界上很多国家已把“化学的绿色化”作为新世纪化学进展的主要方向之一。
绿色化学的核心之一是原子经济性,即充分利用反应物中的各个原子,因而既能充分利用资源,又能防止污染。原子经济性的概念是1991年美国著名有机化学家Trost(为此他曾获得了1998年度的总统绿色化学挑战奖的学术奖)提出的,用原子利用率衡量反应的原子经济性,为高效的有机合成应最大限度地利用原料分子的每一个原子,使之结合到目标分子中,达到零排放。
绿色化学的核心之二主要体现在五个R上:Reduction——减量,即减少三废排放;Reuse——重复使用,诸如化学工业过程中的催化剂、载体等,这是降低成本和减少三废排放的需要;Recycling——回收,可以有效实现“省资源、少污染、减成本”的要求;Regeneration——再生,即变废为宝,节省资源、能源,这是减少污染的有效途径;Rejection——拒用,指对一些无法替代,又无法回收、再生和重复使用的,有毒副作用及污染作用明显的原料,拒绝在化学过程中使用,这是杜绝污染的最根本方法。
绿色化学的研究内容主要集中在以下几个方面:
1.开发原子经济反应 理想的原子经济反应是原料分子中的原子百分之百地转变成产物,不生副产物或废物,实现废物的零排放。对于大宗基本有机原料的生产来说,选择原子经济反应十分重要。如广泛使用的镇静止疼药物布洛芬的生产,传统的工艺包括6步化学计量反应,原子有效利用率低于40%,新工艺采用3步催化反应,原子有效利用率近80%(如考虑副产品乙酸的回收,则达99%)。
2.采用无毒、无害的原料 为了人类健康和社区安全,需要用无毒无害的原料代替它们来生产所需的化工产品。在现有化工生产中使用的剧毒光气和氢氰酸等,工业上已开发成功一种由胺类和二氧化碳生产异氰酸酯的新技术,取代了常规的光气合成路线。Monsanto公司开发的安全生产氨基二乙酸钠的工艺,改变了过去的氨、甲醛和氢氰酸为原料的二步合成路线。
3.采用无毒、无害的催化剂 目前烃类的烷基化反应一般使用氢氟酸、硫酸、三氯化铝等液体酸催化剂。这些液体催化剂对设备的腐蚀严重,对人体危害大,产生废液、废渣污染环境。多年来国外正从分子筛、杂多酸、超强酸等新催化材料中大力开发固体酸烷基化催化剂,其中采用新型分子筛催化剂乙苯液相烃化技术,催化剂选择性很高,乙苯重量收率超过99.6%,而且催化剂寿命长。
4.采用无毒、无害的溶剂 大量的与化学品制造相关的污染问题不仅来源于原料和产品,而且源自在其制造过程中使用的物质,如反应介质,分离和配方中所用的溶剂。采用无毒无害的溶剂代替挥发性有机化合物作溶剂已成为绿色化学的重要研究方向。
在无毒无害溶剂的研究中,最活跃的研究项目是开发超临界流体(SCF),特别是超临界二氧化碳作溶剂。超临界二氧化碳是指温度和压力均在其临界点以上的二氧化碳流体,它有常规液态溶剂的溶解度,又具有很高的传质速度。超临界二氧化碳的最大优点是无毒、不可燃、价廉等。
另一个研究热点是离子液体,它是指由可变换的阴阳离子组成的有机液体物质,该溶剂在室温下是流质,由于该溶剂可按使用者的需要而设计,所以又称之为“设计者溶剂”。离子液体既可作溶剂又可作催化剂,离子液体对热稳定,不可燃、不挥发、不氧化、不爆炸、低毒性,故用于合成反应,对环境是清洁友好。
5.利用可再生的资源合成化学品 利用生物质(生物原料)代替当前广泛使用的石油,是保护环境的一个长远的发展方向。M.Holtzapp开发了一系列技术:把废生物质转化成动物饲料、工业化学品和燃料而获得1996年美国总统绿色化学挑战奖中的学术奖。
6.环境友好产品 环境友好产品本身不会引起环境污染或健康问题,产品使用后应能再生循环或降解为无害物质。如塑料制品使用后成为难以降解的主要白色污染物,将变性淀粉与可降解的聚酯共混后制成的塑料薄膜具有完全生物降解性。
绿色化学具有重大的社会效益、环境效益和经济效益,它体现了化学与社会的相互联系和相互作用,是化学高度发展以及社会对化学科学发展的作用的产物。随着人们对生存环境质量要求的逐步提高和科学技术的发展,绿色化学必将得到快速发展。
【思考题】
1.试以原子结构理论说明:
(1)第四周期过渡金属元素在性质上的基本共同点。
(2)讨论第一过渡系元素的金属性、氧化态、氧化还原稳定性及酸碱稳定性变化规律。
2.回答下列问题:
(1)三价钴盐没有二价钴盐稳定,而其配离子的稳定性恰好相反,为什么?
(2)为什么不能在水溶液中由Fe(Ⅲ)和KI制备FeI3?
(3)当Na2CO3溶液作用于FeCl3溶液时,为什么得到的是Fe(OH)3而不是Fe2(CO3)3?
3.FeCl3能腐蚀Cu,而Fe比Cu金属活泼性更大,这有无矛盾?
4.CrCl3·6H2O与Cr(NO)3·9H2O的颜色为何不同?
5.在K2Cr2O7溶液中加入AgNO3溶液,其现象如何?加入浓硝酸后又有何变化?试加以解释。
6.根据锰的电势图回答下列问题:
(1)在酸性溶液中,用过量的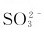 离子可将
离子可将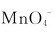 离子还原成什么?如果
离子还原成什么?如果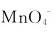 离子过量,产物又是什么?在强碱性介质中,
离子过量,产物又是什么?在强碱性介质中,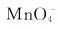 离子过量时可被
离子过量时可被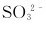 离子还原成什么?如果
离子还原成什么?如果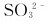 过量,产物将是什么?
过量,产物将是什么?
(2)欲把Mn2+离子氧化为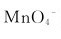 离子,应选用何种氧化剂?
离子,应选用何种氧化剂?
